SMRACAD1通过上皮-间充质转化促进胃癌细胞生长和迁移的机制研究
田小容,刘嘉玺,占 婷,陈梦阁,田 霞,黄晓东
1. 武汉大学中南医院消化内科(武汉 430071)
2. 武汉市第三医院(武汉大学附属同仁医院)消化内科(武汉 430060)
胃癌是一种常见的起源于胃上皮细胞的恶性肿瘤,居全球癌症死亡相关原因第三位,仅次于肺癌和结直肠癌[1]。由于胃癌早期症状缺乏特异性,确诊主要依靠内镜检查,因此大多数患者诊断为进展期和晚期[2]。确定新的生物标志物有助于进一步提高对胃癌的理解,有助于开发新的靶向治疗方法,以提高胃癌患者的生存率。SMRACAD1是SNF2 螺旋酶亚家族和含DEAD/H盒螺旋酶结构域蛋白的ATP 酶SWI/SNF 家族成员,其参与DNA 复制、转录调节、异染色质建立和维持,以及DNA 损伤修复[3-4]。起初,人类Hel1 基因(现在被命名为SMRACAD1)被发现在e1a 表达细胞系中过表达,并通过基因组重排增加基因再激活的能力,这表明人类Hel1 基因可能在遗传不稳定发展中发挥作用,并将该基因定位到4q22-23 染色体上[5]。目前越来越多的研究表明,SMRACAD1与肿瘤细胞的增殖、上皮-间充质转化(epithelial-mesenchymal transition, EMT)和化疗药物敏感性有关,如肝细胞癌、胰腺癌、乳腺癌和恶性周围神经鞘肿瘤[6-10],然而关于SMRACAD1在胃癌中的表达及其发病机制的报道较少。本研究旨在探讨SMRACAD1对人胃癌细胞增殖和侵袭能力的影响及相关分子机制。
1 资料与方法
1.1 主要试剂和仪器
高糖 DMEM 培养基、F-12K 培养基、RIPA1640 培养基、胎牛血清、胰酶、冻存液均购自美国Gibco 公司;HiTrnace A、HiTrance B、shCON 和shSMRACAD1购自上海吉凯基因公司;荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自北京康为世纪公司;EDU 细胞增殖检测试剂盒购自上海碧云天生物公司;细胞凋亡检测试剂盒购自上海三箭生物公司;Trizol裂解液购自美国Invitrogen 公司;BCA 蛋白测定试剂盒和ECL 化学发光试剂盒购自美国Thermo Fisher 公司;SAMARCAD1抗体、E-钙黏蛋白抗体(E-cadherin)、N-钙黏蛋白抗体(E-cadherin)、波形蛋白抗体(Vimentin)、Snail 抗体、磷脂酰肌醇-3 激酶抗体(phosphatidylinosital-3 kinase,PI3K)、 蛋白激酶B 抗体(protein kinase B,AKT)、哺乳动物雷帕霉素靶蛋白抗体(mamalian target of repamycin,mTOR)、磷酸化PI3K 抗体(phosphorylated PI3K,p-PI3K)、 磷酸化AKT 抗体(phosphorylated AKT,p-AKT)、磷酸化mTOR抗体(phosphorylated mTOR,p-mTOR)、β-actin 抗 体、GAPDH 抗 体HRP 标记的山羊抗兔二抗购自英国Abcam 公司;CO2恒温细胞培养箱购自美国Thermo Fisher 公司;荧光定量PCR 仪、凝胶成像分析器、流式细胞分析仪购自美国Bio-Rad 公司;荧光倒置显微镜购自日本OLYMPUS 公司。
1.2 方法
1.2.1 生物信息学分析
胃腺癌(stomach adenocarcinoma, STAD)组织和正常组织数据集来自癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/),TCGA-STAD 数据集包括407 个组织,其中373 个胃癌组织、2 个癌旁组织、32 个正常组织。利用胃癌组织和正常组织数据分析SMRACAD1的差异表达。来自373 个胃癌组织的SMRACAD1数据用于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。
1.2.2 细胞培养
人胃黏膜细胞系GES-1 和人胃腺癌细胞系AGS 均购自中国科学院细胞培养库(中国上海),其中GES-1 细胞生长于高糖DMEM 培养基,HGC-27 细胞生长于RIPA1640 培养基,AGS 细胞生长于Ham's F-12K 培养基,置入37℃、含5%CO2培养箱中恒温培养。高糖DMEM 和Ham's F-12K培养基均加入10%的胎牛血清和1%的青-链霉素制成完全培养基。RIPA1640 培养基加入20%的胎牛血清和1%的青-链霉素制成完全培养基。
1.2.3 细胞转染
从上海吉凯基因公司获得表达SMRACAD1shRNA和阴性对照的慢病毒构建体,shRNA序列如下:
SMRACAD1shRNA:
5’-CCAGCACCTGACAATTAA-3’
shCON:
5’-GCCTTATTTGACAATGCTTAT-3’
取对数生长期AGS 细胞进行铺板,待细胞密度达30%左右时,按照制造商说明使用HiTrance A转染试剂将SMRACAD1shRNA 和shCON 分别转移至六孔板内,转染72 h 后留取细胞进行后续实验。
1.2.4 实时荧光定量PCR
取Trizol 裂解液从细胞中提取总RNA,操作步骤按照试剂盒说明书进行。PCR 在以下条件下进行:95℃10 min,95℃15 s,60℃20 s,72℃40 s,40 个循环。计算Ct 值,以β-actin 为mRNA 的归一化参考,采用2-△△Ct方法定量相对表达量。每个样本检测3 个,重复进行统计分析。PCR 中使用的正向(F)和反向(R)引物序列如下:
SMRACAD1:
正向:5’-TCTTTGGCCCCTTTGTGTCC-3’
反向:5’-GAGAAGCTCCCTGTGCTACC-3’
β-actin:
正向:5’-CCTTCCTGGGCATGGAGTC-3’
反向:5’-TGATCTTCATTGTGCTGGGTG-3’
1.2.5 蛋白印迹法
取RIPA 裂解液裂解细胞后,用BCA 蛋白检测试剂盒对细胞裂解液中的蛋白含量进行定量。将蛋白加入SDS-PAGE 分离过程中,转移到PVDF膜上,5%脱脂牛奶室温封闭膜,用特异性单克隆一、二抗检测SAMARCAD1、E-catenin、N-catenin、波形蛋白(Vimentin)、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mMOR、β-actin 和GAPDH 蛋白。
1.2.6 平板克隆实验
取胰酶消化各组细胞后,用完全培养基将离心后的细胞制成细胞悬液,以500 个细胞/孔平铺至6 孔板中,静置培养12 天肉眼可见克隆的细胞团块,4%多聚甲醛固定,结晶紫染色,计数细胞克隆数。
1.2.7 CCK-8实验
取胰酶消化各组细胞制备细胞悬液,每孔取100 μL,含4 000 个悬浮细胞,平铺至96 孔板中,分别在细胞培养的第2、3、4、5 天时每孔加入10 μL CCK-8 溶液,避光培养2 h 后用酶标仪参数为450 nm 的光密度(optical density,OD)值测量细胞的增殖情况。
1.2.8 划痕实验
取转染后的细胞6 孔板继续培养24 h,用200 μL 枪头竖直划痕,PBS 清洗后完全培养基继续培养,拍照后放入培养箱,待12 h、24 h 后再次拍照。
1.2.9 Transwell小室检测细胞迁移和侵袭能力
取各组转染后细胞培养2 天后,胰酶消化各组细胞制备细胞悬液,取200 μL 含5×104个悬浮细胞的无血清培养基,在涂有Matrigel 基质胶(侵袭)或不涂有(迁移)Transwell 上室加入200 μL细胞悬液,下室加入500 μL 完全培养基。培养24~48 h 后4%聚甲醛固定30 min,0.1%结晶紫染色30 min,PBS 清洗后显微镜下观察并拍照。
1.3 统计学方法
采用SPSS 22.0 软件进行数据分析,插图数据均采用GraphPad Prism 进行分析。符合正态分布的计量资料用均数和标准差(±s)表示,采用t检验;计数资料以频数和百分比(n,%)描述,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 SMRACAD1在胃癌中表达上调
分析TCGA-STAD 数据集发现SMRACAD1在胃癌组织中表达上调(P<0.001),见图1-A。此外,PCR 结果显示,与GES-1 细胞相比,HGC-27 细胞(P<0.01)和AGS 细胞(P<0.001)中SMRACAD1表达显著增高(图1-B)。蛋白印迹法(Western blot,WB)结果与实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qPCR)结果一致,表明SMRACAD1的117kDa 的蛋白带在HGC-27细胞和AGS 细胞中有差异,见图1-C。
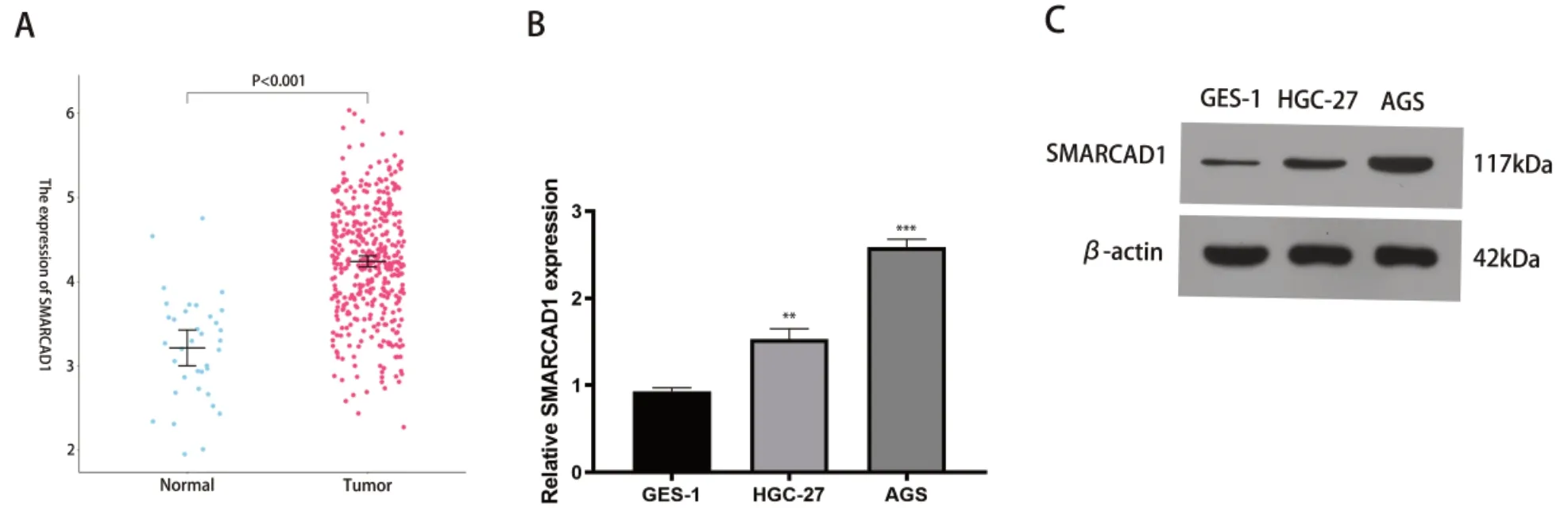
图1 SMRACAD1在胃癌组织和胃癌细胞系中的表达Figure 1. Expression of SMRACAD1 in gastric cancer tissues and cell lines
2.2 SMRACAD1下调抑制胃癌细胞的增殖
使用特异性靶向SMRACAD1的慢病毒载体处理AGS 细胞后,PCR 结果提示AGS 细胞转染shSMRACAD1后下调了SMRACAD1的表达(P<0.001),见图2-A。SMRACAD1表达下调后行CCK-8 检测和平板克隆实验,结果显示与shCON 组相比,shSMRACAD1组的AGS 细胞增殖速度在第2 天开始减弱,在第3 天增殖速度明显减慢(P<0.001),并且显著抑制了AGS 细胞的克隆形成数,见图2-B、图2-C。
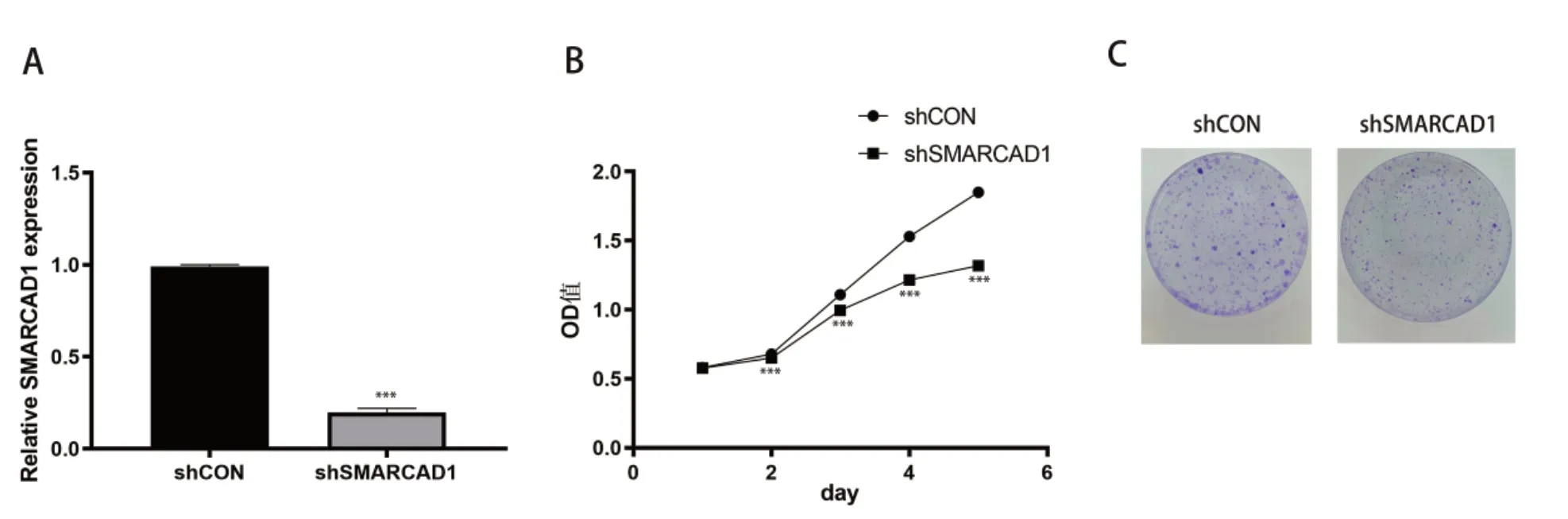
图2 下调SMRACAD1后AGS细胞的增殖活性Figure 2. The proliferation activity of AGS cells after downregulating SMRACAD1
2.3 SMRACAD1下调抑制胃癌细胞的迁移和侵袭
划痕实验结果显示,与shCON 组相比,shSMRACAD1组AGS 细胞在12 h、24 h 内划痕愈合速度明显降低(P<0.05),见图3-A。此外,Transwell 迁移和侵袭实验结果显示,与shCON 组相比,shSMRACAD1降低了AGS 细胞的迁移数量(P<0.01)和侵袭数量(P<0.001),见图3-B、图3-C。
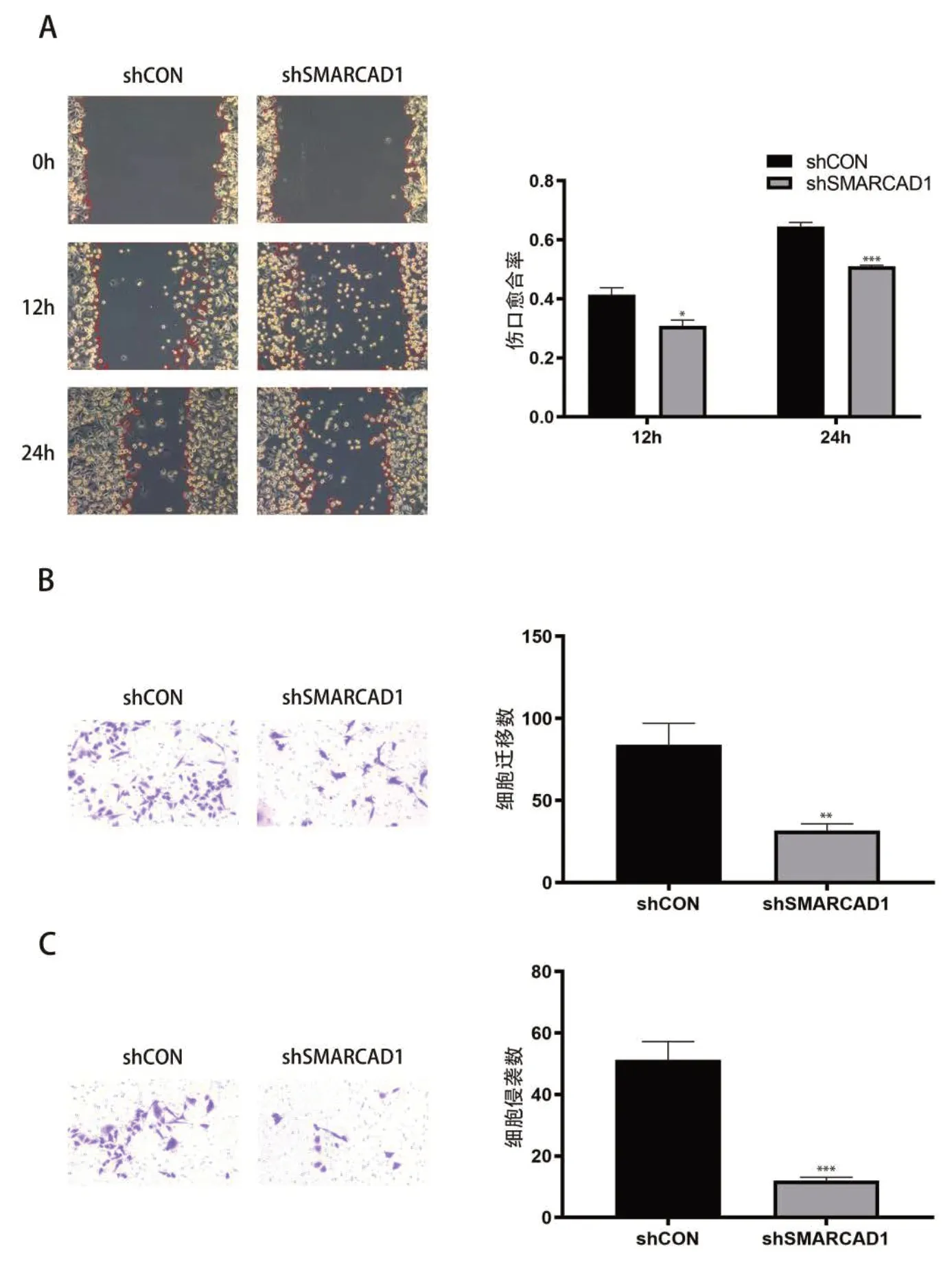
图3 下调SMRACAD1后AGS细胞的迁移和侵袭能力Figure 3. The migration and invasion ability of AGS cells after downregulating SMRACAD1
2.4 SMRACAD1下调抑制胃癌细胞EMT和PI3K/AKT/mTOR信号通路的激活
KEGG 富集分析结果显示,SMRACAD1主要参与中间丝组织、依赖于中间丝的细胞过程、中间丝的细胞骨架组织和角质化(图4-A)。SMRACAD1表达下调后AGS 细胞中上皮标志物E-cadherin 表达上调,间充质细胞标志物N-cadherin、间充质标志物Vimentin 和Snail 表达下调(图4-B)。此外,与对照组相比,shSMRACAD1组AGS细胞PI3K、AKT、mTOR 表达无明显差异,p-PI3K、p-AKT、p-mTOR 表达下调(图4-C)。
3 讨论
近年来,随着卫生标准的提高、幽门螺杆菌的根除和早期胃癌的筛查等,胃癌发病率从全球癌症发病率第五位下降至第七位,但中国仍然是全球胃癌发病率和死亡率最高的地区[1,11-12]。尽管胃癌诊断及治疗取得了显著进展,但由于术后转移复发,胃癌患者五年生存率在30%~35%[13]。探究胃癌进展的分子机制及新的治疗靶点对胃癌的诊断和预后具有重要意义。
SMRACAD1是解旋酶超家族的染色质重塑ATP酶,在维持染色质稳定性方面起重要作用,特别是在DNA 双链断裂(DNA double-strand breaks, DSBs)修复中[14]。近年来,有研究发现SMRACAD1与肿瘤的进展和转移有关。Al Kubaisy 等发现SMRACAD1促进乳腺癌细胞的迁移、侵袭和转移,并减少细胞间黏附能力[9]。Arafat 等发现SMRACAD1在乳腺癌组织中表达升高,下调SMRACAD1表达可通过下调IKK-β 表达和减少STAT3 磷酸化减少乳腺癌细胞增殖、集落形成和肿瘤生长,可成为乳腺癌潜在的治疗靶点[15]。Liu 等发现SMRACAD1在胰腺癌组织中表达上调,是胰腺癌预后的不利因素,且下调SMARCDA1表达后可通过抑制Wnt/ β-catenin 信号通路抑制胰腺癌细胞的增殖、侵袭和EMT[8]。本研究对TCGA 数据库进行差异基因分析发现SMRACAD1在胃癌组织中表达上调,体外实验发现SMRACAD1在胃癌细胞中表达上调。此外,下调SMRACAD1表达后AGS 细胞增殖、侵袭和迁移能力降低。
EMT 在肿瘤进展和迁移中起着重要作用,被认为是肿瘤细胞获得更高侵袭和转移能力的关键步骤[16]。许多信号通路参与EMT 的调控,其中PI3K/AKT/mTOR 信号通路与EMT 密切相关[17]。PI3K/AKT/mTOR 信号通路通过促进细胞增殖、血管生成、EMT 和化疗耐性药性等多种机制参与胃癌的进展和转移[18]。KEGG 通路富集分析表明,SMARCDA1主要富集在与中间丝有关的信号通路。Vimentin 是蛋白质中间丝家族的主要成分,也是EMT 的关键生物标志物之一,有研究认为Vimentin 可作为癌症治疗的潜在分子靶点[19]。本研究发现下调SMRACAD1表达后E-catenin 表达升高,E-catenin、Vementin 和Snail 表达降低,这表明SMARCDA1通过诱导EMT 促进胃癌细胞转移。本研究还发现下调SMRACAD1表达抑制了胃癌细胞中p-PI3K、p-AKT、p-mTOR 的表达,因此,SMRACAD1可能通过PI3K/AKT/mTOR 信号通路促进胃癌细胞的EMT。
综上所述,SMRACAD1在胃癌组织和胃癌细胞系中表达上调,下调SMRACAD1的表达可抑制胃癌细胞的EMT和PI3K/AKT/mTOR信号通路的活化,SMRACAD1可能通过激活PI3K/AKT/mTOR 信号通路诱导胃癌细胞的增殖、侵袭、迁移和EMT 过程。

