针刺中脘调节胃运动的神经通路研究进展
曲萌 陈幼楠 杨丹妮 贺萌 林小娟
作者单位:264200 山东中医药大学附属威海市中医院治未病科(曲萌);北京中医药大学针灸推拿学院[陈幼楠、杨丹妮、贺萌(硕士研究生)、林小娟(硕士研究生)]
胃动力紊乱可引起持续性或复发性恶心、厌食、早饱、饱腹感、腹胀等一系列症状,临床多见于功能性消化不良(functional dyspepsia,FD)、慢性萎缩性胃炎等消化系统疾病,也可见于糖尿病、帕金森、中风等非消化系统疾病。胃动力紊乱的病理机制相对复杂,而针刺可以通过多种途径发挥整体调节作用,并且相较于促胃动力药物具有疗效稳定、副作用小、长期可用等优势。中脘属任脉,是胃的募穴、八会穴之腑会,为任脉、手太阳、手少阳、足阳明的交会穴,善调腑之气机,能降胃和中。临床研究显示,针刺中脘在改善FD、糖尿病胃轻瘫、慢性萎缩性胃炎等疾病引发的早饱、餐后饱胀、饱腹感、上腹胀、恶心、呕吐、纳差等症状方面取得了较好的治疗效果[1-3]。针刺中脘在胃动力紊乱的临床应用中不断探索和发展,对其机制的研究也日益深入。本文总结整理近15年参与针刺中脘调节胃运动的神经核团及相关通路,以期为临床应用中脘等腹部穴位干预消化系统疾病提供帮助与借鉴。
1 针刺中脘调节胃运动的效应与针刺时长的关系
中脘位于人体前正中线上,脐中上4寸,其下有皮下组织、腹白线、壁腹膜浅层、第七与第八胸神经前支的分支及前皮支等[4]。针刺中脘可通过痛觉传感器经传入神经传至脊髓后角,经交感神经调节胃运动;传入脊髓的信号上传至脑内,经迷走神经调节胃运动;还可调节中枢及外周脑肠肽水平调节胃运动。目前研究发现,针刺时间是影响针刺中脘发挥双向调节效应的因素之一,其机制可能与激发了不同的神经机制密切相关。
1.1 感觉神经末梢TRPV1通道
辣椒平阻断辣椒素受体1(transient receptor potential vanilloid type-1,TRPV1)是一种非选择性阳离子通道,主要表达于哺乳动物的感觉神经系统,如神经末梢、脊神经节初级感觉神经元,尤其是C类、Aδ纤维[5]。针刺可激活穴区神经末梢、脊神经节、脊髓与感觉皮层TRPV1及其相关通路,进而发挥针刺效应[6]。短时间针刺可能经游离末梢TRPV1介导的第七、八胸神经前支中的Aδ与C纤维传至T7~T8脊神经节的假单极神经元再传入脊髓,经脊髓反射抑制胃运动。Yu Z等[7]用不同强度电针(直刺5 mm,1、2、4 mA,2/15 Hz,2分钟)刺激健康小鼠中脘,有效抑制胃运动,且呈现“强度依赖”;针刺阻断TRPV1受体小鼠与TRPV1基因敲除小鼠中脘,抑制胃运动的作用部分减弱,且“强度依赖”效应消失。Su Y S[8]针刺(5 mm,1 Hz或2 Hz,捻转补泻,1分钟)健康小鼠中脘,有效抑制胃运动且呈现“强度依赖”;以同等强度、频率使用电针针刺TRPV1基因敲除小鼠中脘对胃运动的抑制作用明显减弱。
1.2 交感神经与迷走神经
脊髓T5~T9节段发出交感神经支配胃运动[9],脑干迷走神经背核复合体(dorsal vagal complex,DVC)发出迷走神经支配胃运动。针刺中脘调节胃运动作用依赖于迷走神经结构功能完整性,短时间针刺可能经DVC支配的迷走神经发挥抑制胃运动作用。孙国杰等[10]针刺(平补平泻,直刺,均匀提插捻转,30秒)健康大鼠中脘,孤束核(nucleus of solitary tract,NTS)神经元放电明显增强,抑制胃运动。余芝[11]切断迷走神经前、后支,针刺中脘(直刺3 mm,2/15 Hz,3分钟)抑制胃运动效应明显减弱。殷茵等[12]针刺(直刺3~4 mm,2 mA,2/15 Hz,1分钟)健康小鼠中脘,有效抑制胃运动;电针M2&3受体基因敲除小鼠中脘能抑制胃运动,但抑制效应有所延迟;电针β1&2受体基因敲除小鼠中脘,抑制胃运动效应不明显。
针刺中脘调节胃运动作用依赖于交感神经结构功能完整性,短时间针刺可能经脊髓支配的交感神经发挥抑制胃运动作用。孙光[13]针刺(直刺2 mm,捻转法平补平泻,2分钟)胃扩张(gastric distention,GD)大鼠中脘,能有效抑制脊髓后角神经元放电,抑制胃运动。陈建志等[14]针刺(直刺3~4 mm,1 mA、2 mA、4 mA,2/15 Hz,2分钟)健康大鼠中脘可有效抑制胃运动,切断健康大鼠内脏大神经后,针刺的抑制作用明显减弱。刘坤[15]发现注射β2、β3、α2受体激动剂后,电针(1 mA,10 Hz,30秒;手针:直刺3~4 mm,提插捻转,30秒)健康大鼠中脘抑制胃运动作用增强,注射胆碱受体激动剂后,电针健康大鼠中脘对胃运动影响不大。
1.3 神经—内分泌网络
神经系统与内分泌系统既相互独立,又有着密切的信息联系,二者通过神经递质、脑肠肽及受体和细胞内信息传递系统构成一个复杂的网络体系,共同调节胃运动。生理状态下,长时间针刺中脘可促进胃运动,其机制可能与调节中枢及外周胃动素(motilin,MTL)、胃泌素(gastrin,GAS)、胃动素受体(motilin receptor,MTL-R)、胃泌素受体(gastrin receptor,GAS-R)表达有关。申国明等[16]电针健康大鼠中脘穴(直刺2 mm,平补平泻,得气后改用疏密波,9 V,20~100 Hz,20分钟),可提高DVC中c-fos表达,增强胃运动幅度。章梦婷[17]使用电针针刺(直刺2 mm,电压9 V,疏密波20~100 Hz,20分钟)GD大鼠中脘,DVC中GD敏感神经元放电频率明显提高,下丘脑、胃窦中的MTL-R、GAS-R表达明显提高,胃内压振幅及胃运动频率均明显提高。WANG H等[18]使用电针针刺(直刺2 mm,2 mA,20~100 Hz,20分钟)GD大鼠中脘,PVN中MTL、GAS表达明显提高,下丘脑中MTL-R、GAS-R表达明显提高,胃运动明显增强。
病理状态下,长时间针刺中脘可调节中枢与外周多巴胺(dopamine,DA)、去甲肾上腺素(norepinphrine,NE)、谷氨酸(glutamic acid,Glu)、一氧化氮(nitric oxide,NO)、5-羟色胺(5-hydroxy tryptamine,5-HT)、胆囊收缩素(cholecystokinin,CCK)、生长素(Ghrelin)等多种神经递质与脑肠肽含量从而双向调节胃运动。王柳等[19]使用电针针刺(直刺2 mm,20~100 Hz,9 V,20分钟)FD大鼠中脘,胃窦运动幅度提高,DMV区Glu相关N-甲基-D-天冬氨酸受体(N-methyl-D-aspartric acid receptor,NMDAR)亚基NR1表达明显增加,血清NO含量明显降低。王灵[20]研究发现使用电针针刺(疏密波,4/20 Hz,20分钟)胃溃疡大鼠中脘可升高胃黏膜及血清NO含量,抑制胃运动。KANG K S等[21]电针(直刺1~2 mm,10 Hz,10分钟)顺铂所致厌食大鼠中脘,有效抑制NTS中c-fos的表达,提高血清CCK、Ghrelin水平,降低血清5-HT水平,促进胃运动。Baek J Y等[22]电针(垂直针刺2 mm,10 Hz,16 A,10分钟)顺铂所致厌食大鼠中脘,有效抑制NTS中c-fos的表达,降低血清5-HT、DA、NE水平,提高Ghrelin、神经肽Y的水平,促进胃运动。
1.4 小结
针刺中脘对胃运动的调节是多方面、多维度、多靶点的综合调控。针刺参数是影响针刺效应的重要因素,针刺中脘双向调节胃运动的效应与针刺时间长短密切相关,其内在机制可能与神经反射调节、神经—内分泌调节存在时效性差异有关。未来可深入探究针刺中脘促进、抑制胃运动的时间临界区间及相关机制,进一步揭示针刺中脘调节胃运动的作用机制。
2 针刺中脘调节胃运动的中枢神经机制
中枢神经系统对胃的调节由脑、脊髓接受体内、外环境传入的信息,经整合后由自主神经和神经内分泌系统将调控信息传递到肠神经丛,或直接作用于胃平滑肌细胞。中枢神经系统内与胃运动相关的核团包括DVC、蓝斑核(locus coeruleus,LC)、中缝大核(magnus raphe nucleus,NRM)、下丘脑外侧区(lateral hypothalamic region,LHA)、室旁核(paraventricular nucleus,PVN)、弓状核(arcuate nucleus,Arc)、小脑顶核(fastigial nucleus,FN)杏仁核与海马及这些核团相互之间组成的神经通路。针刺中脘调节胃运动的核团包括海马、杏仁核、PVN、LHA、FN、DVC及杏仁核-PVN通路、PVN-DVC通路与NTS-DMV-迷走神经通路[18,23-27](见图1)。
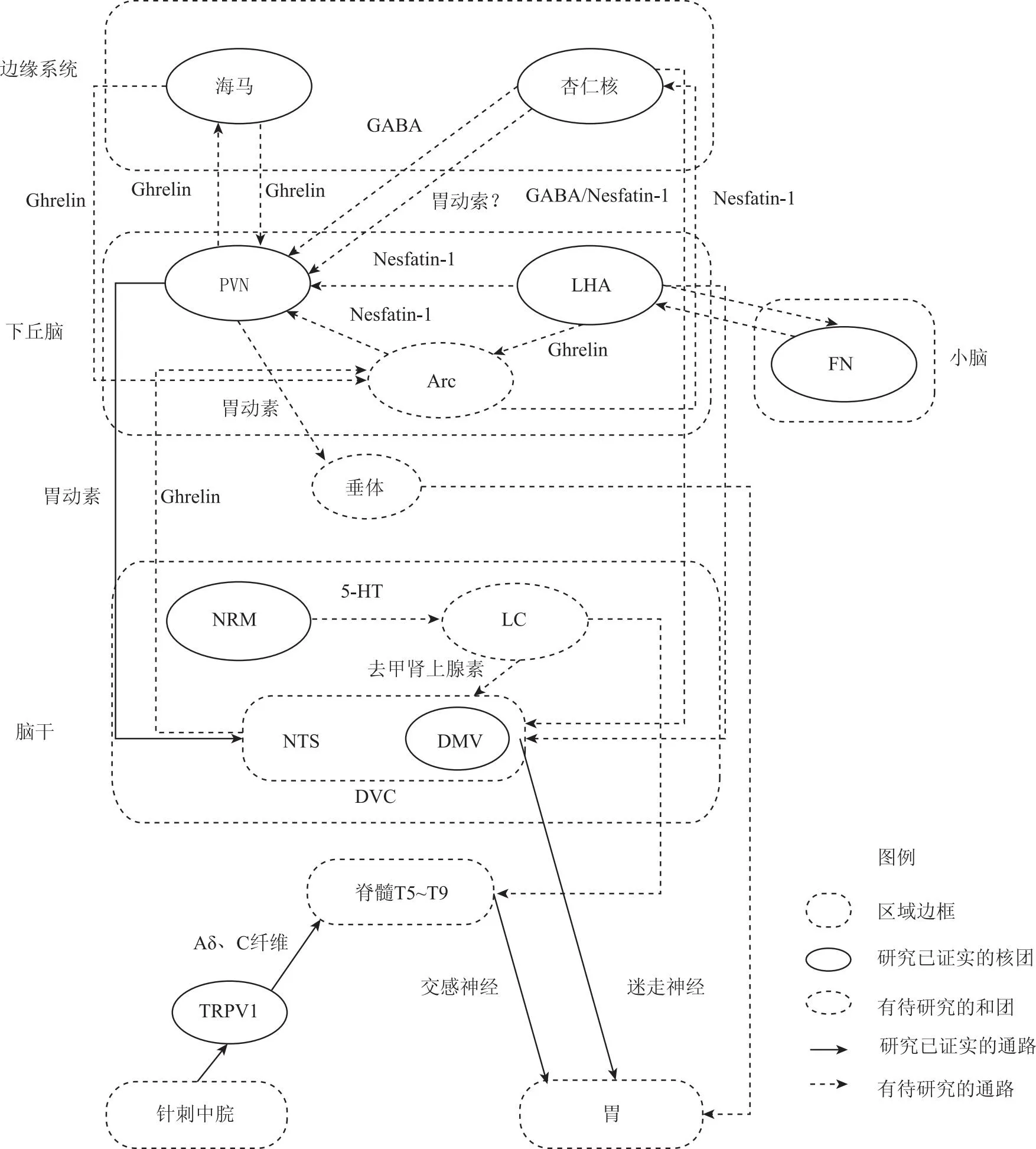
图1 针刺中脘调节胃运动的神经通路
2.1 杏仁核、海马是针刺中脘调节胃运动与情绪的共同响应核团
杏仁核位于颞叶海马回沟的深面,侧脑室下角尖端的前方,海马位于大脑丘脑和内侧颞叶之间,二者均属于边缘系统。杏仁核与海马既参与情绪的调控,也参与胃运动的调节,二者是针刺中脘调节胃运动与情绪的共同响应核团。
2.1.1 杏仁核、海马参与情绪调节 杏仁核是储存关于情绪事件的非陈述性记忆的神经中枢,杏仁核中γ-氨基丁酸(γ-amimobutyric acid,GABA)能神经元参与情绪的调控。周平艳等[28]认为,杏仁核与海马的相互作用在情绪的加工以及情绪影响记忆的过程中发挥重要作用。王瑾等[29]认为抑郁情绪的产生与抑制性GABA系统及兴奋性Glu系统失衡密切相关。李瑞锡等[30]研究发现,杏仁核中含有丰富的GABA能神经元,这些GABA能神经元在情绪性学习记忆的处理过程中发挥主要作用。刘冬播等[31]研究发现,慢性负性刺激可降低小鼠杏仁核中GABA能神经元的功能(动作电位的数量减少、频率降低、从静息膜电位到阈电位的激发难度增大),作者认为情绪性记忆与杏仁核GABA能神经元兴奋性密切相关。
海马区负责情绪事件的陈述性记忆,海马中Glu能神经元及NMDAR参与情绪的调控。尚立芝等[32]研究发现,抑郁症模型大鼠海马NMDAR1、NMDAR2A、NMDAR2B表达水平明显升高,且过高的兴奋性致使海马Glu能神经元损伤。Gómez-Galán等[33]研究发现抑郁症的发生机制与海马区Glu能突触传递水平显著升高、NMDAR过度激活密切相关。
2.1.2 杏仁核、海马参与胃运动调节 杏仁核中GABA能神经元参与调节胃运动。贾宏阁[34]研究发现,中央杏仁核(central amygdala,CeA)投射至NTS的纤维几乎全部为GABA能神经元,电刺激中央杏仁核可抑制NTS(81%)和DMV(47%)神经元兴奋性,且CeA对NTS神经元的抑制作用可能由GABA介导。HE F等[35]的研究显示,电刺激CeA内侧,NTS与DMV中神经元峰电位显著降低、DMV中神经元峰电位显著增加、胃内压升高;电刺激CeA外侧,NTS中神经元峰电位显著增加、DVC中神经元峰电位显著降低、胃内压降低,表明杏仁核可双向调节胃运动。有学者认为,杏仁核-DVC通路可能参与胃运动的调控[36]。
海马中NMDAR参与调节胃运动。王明华等[37]研究发现,海马微量注射NMDAR阻断剂可消除大鼠抑郁样行为,有效提高胃的收缩幅值与频率。李跃兵等[38]研究发现,FD模型大鼠海马区NMDAR的亚基NR1表达明显提高、NR2表达明显降低。
2.1.3 杏仁核、海马参与针刺中脘调节情绪和胃运动 杏仁核、海马参与针刺中脘对情绪的调控。临床研究显示,针刺中脘等腹部穴位可有效缓解抑郁症状,影响杏仁核、扣带回、壳核、海马等脑核团功能,且杏仁核静息态rsFC变化与抑郁症状改善程度呈显著相关[39]。基础研究表明,针刺中脘等穴可有效改善伴随胃肠动力障碍的抑郁症模型大鼠抑郁症状,促进胃动力恢复,提高海马区多巴胺表达水平、血清P物质含量,降低血清降钙素基因相关肽水平[40]。
杏仁核、海马参与针刺中脘对胃运动的调控。王浩等[24]的研究表明,使用电针针刺中脘可显著提高CeA中c-fos表达,有效促进胃运动,其机制与CeA(GABA)-PVN通路有关;该团队后续研究发现,针刺中脘可有效降低FD大鼠海马区Glu浓度,突触间Glu的释放,减少NMDAR亚基NR1的表达[41]。胡梦洁等[25]研究发现针刺中脘能有效增强FD大鼠胃运动幅度,提高海马c-fos表达,NMDAR的亚基NR2A表达升高,NR1、NR2B表达下降。
2.1.4 小结 杏仁核、海马既参与情绪调控,也参与胃运动调节,二者是针刺中脘对情绪和胃运动调节的共同响应核团,但具体机制尚不完全明确。未来可开展针刺中脘调节情绪和胃运动共同效应的机制研究,为针刺中脘治疗伴随情绪障碍的功能性胃肠病及伴随胃动力紊乱的精神疾病提供新的靶点和实验依据。
2.2 PVN是针刺中脘发挥神经与神经—内分泌调节作用的重要中枢
PVN是中枢神经系统中各类脑肠肽调节胃运动重要的中继核团之一,它与LHA、杏仁核、海马、Arc等多个脑核团之间均存在密切的纤维联系。作用于PVN的脑肠肽包括MTL、Ghrelin、摄食抑制因子1(nesfatin-1)[42]、食欲素A(orexin-A)[43]等。针刺中脘可通过PVN(MTL)-DVC-迷走神经通路及PVN中的Ghrelin神经—内分泌途径调节胃运动。
2.2.1 PVN中的MTL MTL主要由肠道内分泌细胞产生,其广泛分布于中枢(如下丘脑、垂体、视顶盖和端脑等 ) 和外周组织 (如食道、胃、肠道、肾脏、肝脏和脾脏等),参与摄食、胃运动、消化吸收等生理功能功能的调节[44-45]。MTL作用于PVN,既可通过影响迷走神经兴奋性,又可经由下丘脑—垂体途径实现对胃运动的调节。薛峰等[46]研究发现,于PVN中注射MTL,可显著加快消化间期胃运动的频率,摘除垂体后,上述作用显著减弱。韩晓华等[47]研究发现,杏仁核中注射MTL,PVN中c-fos表达及MTL含量明显提高,胃运动明显增强,切断迷走神经,上述作用明显减弱。
针刺中脘可通过影响PVN(MTL)-DVC-迷走神经通路调节胃运动。WANG H等[18]和黄顺等[48]使用电针针刺GD大鼠中脘,PVN中c-fos表达提高,MTL、MTL-R表达提高,DVC内c-fos表达提高,胃内压升高;损毁PVN后,针刺中脘的效应明显减弱。
2.2.2 PVN中的Ghrelin Ghrelin是一种由胃底黏膜细胞分泌的多功能肽,广泛分布于下丘脑、垂体、海马等脑核团,它与生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR)结合后通过中枢和(或)外周途径参与胃运动、摄食、能量代谢等多种生理功能的调节[49-50]。
PVN中的Ghrelin可经神经—内分泌途径调节胃运动。王光明等[51]和王玮等[52]研究发现,PVN中微量注射Ghrelin可增强清醒大鼠胃运动及胃电活动,这种作用可能由迷走神经胆碱能通路介导。齐玉霞等[53]研究发现,海马CA1区可通过Ghrelin能神经元调控PVN内GD敏感神经元的活性。
PVN中的Ghrelin可经迷走神经调节胃运动。邱贝贝等[54]研究发现PVN可调控海马CA1区GD敏感神经元放电活动,在PVN-海马直接或间接通路中Ghrelin参与了兴奋传递的调控。齐玉霞等[53]和邱贝贝等[54]研究表明,PVN-海马通过Ghrelin形成直接或间接的神经环路,且该环路参与胃运动的调控。
针刺中脘等穴可经PVN中Ghrelin的神经—内分泌途径调节胃运动。文琪琦[55]研究发现,针刺中脘、足三里可上调下丘脑及血清中Ghrelin的表达,加快下丘脑、胃窦中Ghrelin的转录过程进而调节胃运动,且效果优于针刺足三里、内关。另有研究发现,Ghrelin与糖尿病胃轻瘫发病及治疗均存在密切的联系,针刺中脘、足三里在改善DGP饱腹感、易饱、餐后饱胀及腹胀症状方面优于针刺内关、足三里[56]。
2.2.3 小结 针刺中脘可通过PVN(MTL)-DVC-迷走神经通路调节胃运动;也可能经PVN中Ghrelin的神经—内分泌途径调节胃运动。针刺中脘能否经由PVN(MTL)—垂体途径及PVN中Ghrelin的神经途径调节胃运动有待进一步探究。脑肠肽的参与使胃运动与神经系统、神经—内分泌系统的关联更加密切。未来可以PVN为切入点,深入探究针刺中脘调节胃运动的神经—内分泌网络效应机制,或可为针刺调节胃动力提供更多靶点及方向。
2.3 DVC是针刺中脘调节胃运动的关键靶点
DVC由NTS与DMV和最后区组成,是中枢神经系统及神经—内分泌网络调节胃运动的重要中枢,脑干中的LC等核团以及下丘脑的PVN、Arc、LHA和边缘系统的杏仁核等高位中枢脑核团都可直接或间接通过DVC参与胃运动的调控。
2.3.1 多条DVC相关通路参与调节胃运动 DVC相关的多条神经通路参与胃运动调节过程。孙洪兆[57]研究显示,电刺激NTS可引起DMV中神经元同时产生兴奋或抑制两种效应,且刺激NTS不同部位可产生相反的胃运动调节作用。Babic T等[58]采用逆行示踪法研究发现NTS神经元有纤维直接传至DMV,通过兴奋性Glu能和抑制性GABA能突触联系DMV并调节迷走神经兴奋性,进而调节胃运动。乔卉等[59]研究发现,LC-DMV通路参与胃运动的调控,其机制可能与去甲肾上腺素能神经元有关。Gong Y等[60]研究发现,LHA存在Ghrelin神经元直接投射至DVC,且该通路参与胃运动的调控。HE F等[35]研究发现,DVC参与杏仁核对胃运动的双向调节。
多种脑肠肽均作用于DVC发挥调节胃运动作用。张雪华等[61]研究发现,DVC中的orexin-A可能通过Ghrelin神经肽系统发挥促进胃运动的作用。XU L等[62]研究发现DVC-Arc通路可能通过Ghrelin参与胃运动的调节。Wang Q等[63]研究发现Nesfatin-1通过杏仁核中的黑素皮质素途径调节DMV中GD敏感神经元的兴奋性进而调节胃运动。
2.3.2 DVC 参与针刺中脘调节胃运动的神经、内分泌途径 DVC是针刺中脘经神经途径调节胃运动的关键靶点。申国明等[16]使用电针健康大鼠中脘穴,可提高DVC区c-fos表达,增加胃运动幅度。Wang H等[18]研究发现,针刺中脘可经PVN-DVC通路调节胃运动。章梦婷[17]使用电针针刺GD大鼠中脘,DVC中GD敏感神经元放电频率明显提高,胃内压振幅及胃运动频率均明显提高,损毁DVC或切断膈下迷走神经,电针效果均显著减弱。
DVC是针刺中脘经神经—内分泌途径调节胃运动的关键靶点。王柳等[19]研究发现,使用电针针刺FD大鼠中脘可通过调节DMV区Glu相关NMDAR亚基NR1表达,从而降低血清NO含量促进胃运动。王浩等[64]研究发现,针刺健康大鼠中脘,胃窦运动幅度明显增加,DVC中GAS表达明显提高。
2.3.3 小结 DVC是针刺中脘经PVN-DVC-迷走神经途径、DVC中GAS及DVC中Glu-NMDAR-外周NO等神经—内分泌途径调节胃运动的重要靶点,针刺中脘能否经杏仁核-DVC、DVC-Arc等DVC相关的神经通路及DVC相关的nesfain-1、orexin-A、Ghrelin等内分泌途径调节胃运动有待探究。针刺中脘调节胃运动的外周神经机制相对清晰,中枢神经机制研究相对不足。未来可以DVC为切入点,结合神经示踪、光遗传、化学遗传等技术,深入研究针刺中脘的中枢神经机制。
3 结语与展望
目前对针刺中脘等腹部穴位的神经调节机制已取得一定的进展,主要包括TRPV1-Aδ与C纤维—脊髓、脊髓—交感神经、海马Glu-NMDAR亚基NR1、CeA(GABA)-PVN、PVN(MTL)-DVC-迷走神经、DVC-NMDAR亚基NR1-外周NO等神经及神经—内分泌机制。众多研究成果充分证明针刺中脘具有双向调节胃动力效应,也说明针刺的干预作用不是单方面的,而是多方面、多维度、多靶点的综合调控。神经与内分泌系统相互作用,构成复杂的网络体系,这也意味着在针刺的治疗机制方面还存在诸多需要深入探讨的问题。现有研究针刺手法各异,且多从单一通路入手,研究取材仅限于某一时间点的状态,未能体现针刺的综合、整体、动态效应机制。因而目前对于针刺中脘调节胃动力的效应机制尚缺乏整体认识。
为了进一步推动相关研究的发展,我们认为今后可以从如下几个角度继续探索:(1)基于针刺手法与中医理论,进一步规范针刺实验操作,统一针刺深度、频率、电针参数、补泻手法、时长、疗程等针刺相关因素。(2)针刺多途径、多靶点、整体性的特点决定了其各个机制之间往往是相互影响而非独立存在,今后可结合脑功能fMRI、神经示踪、脑微透析、光遗传、化学遗传等脑科学技术,设计更为全面、合理的实验方案,更加深入地研究各机制之间的内在关联,以综合、整体、动态的视角探究其作用原理,补充完善针刺整体调节作用的理论。(3)针刺中脘等腹部穴位调节胃动力的神经调节机制仍需要进一步探索,如可从肠神经系统、脑肠肽等方向开展研究,丰富针刺机制研究。探究以中脘为代表的腹部穴位效应机制可揭示针灸疗法中近治作用的内在机理。未来应开展更多更深层次的基础及临床研究,以获取更多更有力的证据,有助于构建针刺中脘等腹部穴位的“神经—内分泌—免疫”调节网络,使古老的针刺疗法迸发出更强大的活力。

