外周血中性粒细胞与淋巴细胞比值对老年转移性食管癌免疫治疗预后的影响
朱武刚 翟晨彤 刘德干 徐文静
食管癌是危及人类健康的重大疾病,在全球最常见的癌症中排名第八,在癌症相关死亡原因中排名第六[1]。其中有超过一半的新发病例和死亡病例发生在我国[2]。目前,食管癌的治疗首选手术切除或内镜治疗,但大多数病人诊断食管癌时已出现远处转移,失去手术机会[3],并且随着社会老龄化的加剧,高龄食管癌病人所占的比重越来越高[4],无法耐受强烈化疗。
与传统化疗的抗肿瘤机制不同,免疫检查点抑制剂(ICIs)通过阻断程序性死亡受体1(PD-1)/PD-1配体(PD-L1)通路,增强T细胞的疗效和特异性来抑制肿瘤进展[5-6]。但是,免疫治疗并不是在所有病人中都能取得预期疗效[7]。有研究显示,只有四分之一至五分之一的人群可以从免疫治疗中获得长期益处[8],这就需要我们在治疗前筛选出免疫治疗的获益人群。目前潜在的预测性生物标志物,如PD-L1表达水平、肿瘤高突变负荷(TMB)存在不同阈值不同检测方法的限制、检测繁琐、费用较高等缺点,在临床实践中难以开展[9]。因此,实际临床工作中亟需简单、经济、有效的可以预测免疫治疗疗效的预后指标。
炎症已经被证实是癌症发生和发展的主要驱动因素之一[10-11]。人体炎症及免疫的相关细胞,如中性粒细胞、单核细胞和淋巴细胞等,在肿瘤与炎症相互交联的调控中发挥着重要作用[12]。中性粒细胞与淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)作为反映炎症的血清学标志物之一,在肝癌、胰腺癌、肺癌等多种恶性肿瘤预后中的价值已被多项研究结果证实[13-15]。最近有研究报道了NLR对局部晚期食管癌预后的影响[16-17],但其在老年转移性食管癌免疫治疗预后预测中的价值仍不清楚。因此,本研究旨在探讨治疗前NLR水平是否与接受ICIs治疗的老年转移性食管癌病人的预后相关。
1 资料与方法
1.1 研究对象 选取2019年1月31日至2022年7月31日期间兴化市人民医院收治的接受ICIs治疗的老年转移性食管癌病人。纳入标准:(1)病理证实为食管癌,包括鳞癌和腺癌,根据第八版TNM分期确定有远处非区域淋巴结或脏器转移;(2)年龄≥60岁;(3)既往未接受放疗、化疗和手术治疗;(4)治疗前无感染性疾病,无血管炎、系统性红斑狼疮等血液系统疾病;(5)接受ICIs治疗至少2个周期;(6)初始ICIs治疗前1周内有完整的血液学检测结果。排除随访资料不全的病人。
1.2 资料收集 通过电子病历系统提取病人的基本特征,如年龄、性别、吸烟史、饮酒史、美国东部肿瘤协作组评分(Eastern Cooperative Oncology Group,ECOG)等。记录肿瘤的病理特征,如TNM分期、分化程度、转移部位。收集病人进行免疫治疗前1周内的实验室检查结果,包括中性粒细胞计数、淋巴细胞计数和单核细胞计数,并计算NLR。
1.3 随访 本研究纳入的所有病人每3个月进行一次随访,随访内容包括体格检查、肿瘤指标、B超及胸部CT等,由两位副高职称以上的医师对检查内容进行独立评估,根据实体瘤免疫治疗疗效评价标准(immune response evaluation criteria in solid tumor, iRECIST)[18]评估病情进展。无进展生存期(progression free survival,PFS)定义为PD-1抑制剂开始使用日期与疾病进展日期之间的时间,总生存期(overall survival,OS)定义为PD-1抑制剂开始使用日期至病人死亡或至末次随访日期的时间。随访截止日期为2023年2月28日。
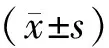
2 结果
2.1 临床特征 本研究共纳入116例食管癌病人,其中男73例,女43例,年龄60~82岁,中位年龄为67岁,其中68例病人有吸烟史。116例病人中,90.5%(105/116)经病理诊断为鳞癌,9.5%(11/116)为腺癌;95.7%(111/116)病人的ECOG评分为0~1分,4.3%(5/116)为2分。肿瘤病理:高分化23例(19.8%),中分化41例(35.4%),低分化52例(44.8%)。肿瘤发病部位:食管上段39例(33.6%),食管中段47例(40.5%),食管下段30例(25.9%)。所有病人均明确有远处转移,其中非区域淋巴结转移31例(26.7%),脏器转移85例(73.3%)。所有病人均接受免疫治疗联合化疗,其中使用卡瑞利珠单抗53例,帕博利珠单抗4例,信迪利单抗34例,替雷利珠单抗25例。化疗方案为紫杉醇或替吉奥±铂类药物。
2.2 NLR临界值的确立及与临床特征的关系 基于病人的生存状态和生存时间,使用X-tile软件找出NLR的最佳临界值为2.8。以2.8为截断点,NLR<2.8为低NLR组,NLR≥2.8为高NLR组。低NLR组有57例(49.1%),高NLR组有59例(50.9%)。2组性别、年龄、吸烟史、病理类型、分化程度、肿瘤位置、转移部位、ECOG评分和免疫治疗药物类型差异均无统计学意义(P>0.05),见表1。

表1 不同NLR分组病人临床病理特征比较(n,%)
2.3 影响老年转移性食管癌病人免疫治疗预后的单因素及多因素分析 单因素Cox回归分析显示,NLR水平、ECOG评分与病人OS及PFS均相关,见表2。将单因素Cox回归分析有意义的变量纳入多因素Cox回归分析,结果表明,NLR、ECOG评分是老年转移性食管癌病人免疫治疗OS及PFS的独立影响因素。见表3。
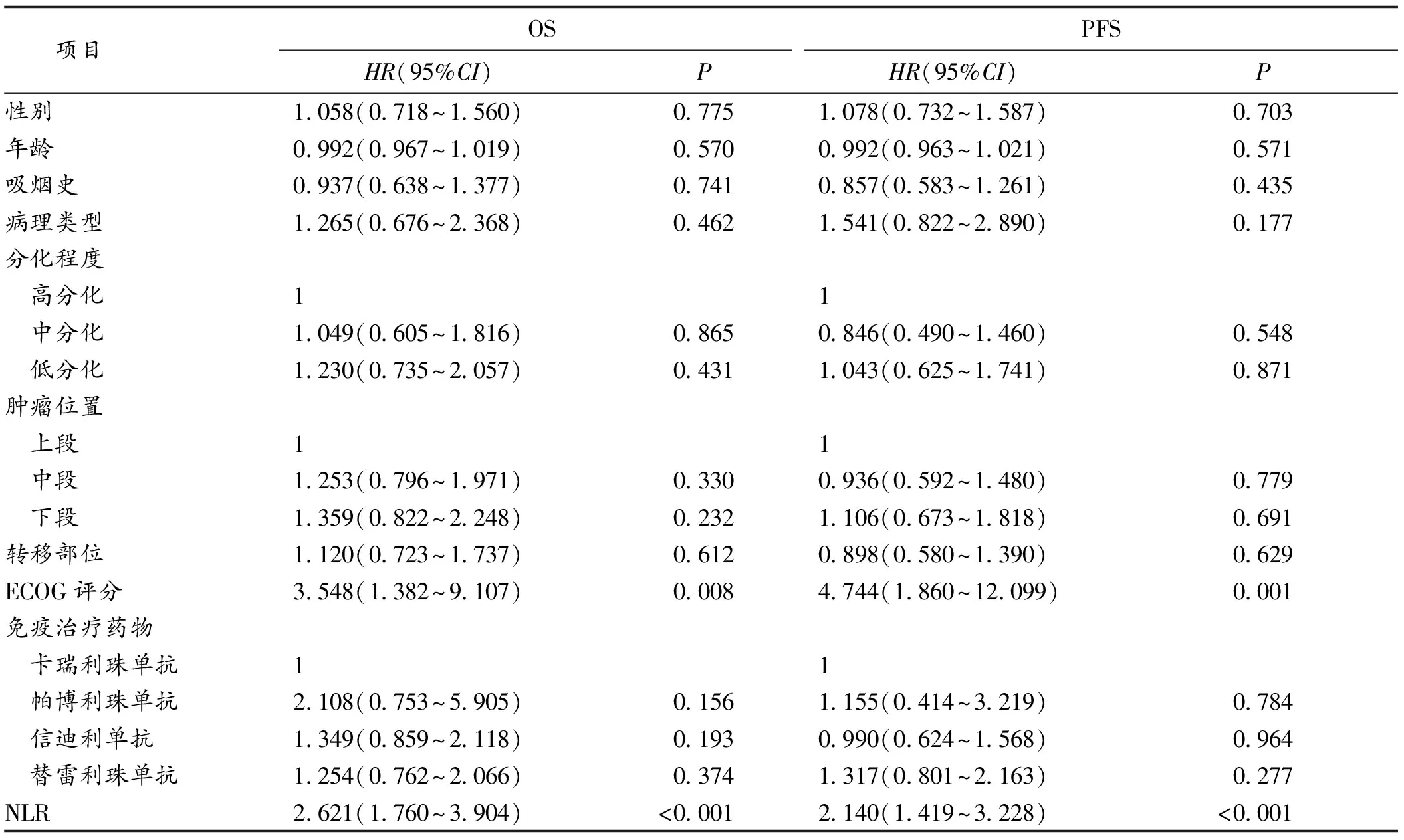
表2 单因素Cox回归分析病人临床病理特征与生存预后的关系
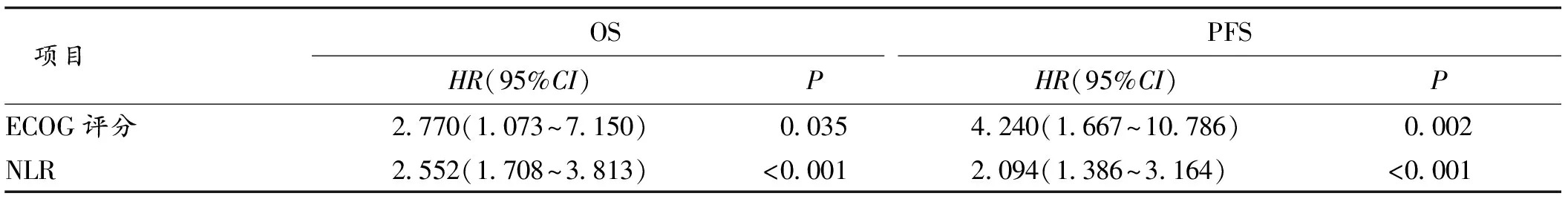
表3 多因素Cox回归分析病人临床病理特征与生存预后的关系
2.4 NLR的预后预测价值 采用Kaplan-Meier法分别构建NLR与OS、PFS的生存曲线。低NLR组的中位OS为17.2个月,高NLR组的中位OS为6.8个月,2组差异具有统计学意义(P<0.001)。低NLR组的中位PFS为9.7个月,高NLR组的中位PFS为3.5个月,2组差异具有统计学意义(P<0.001) 。见图1。

图1 低NLR组与高NLR组OS以及PFS的Kaplan-Meier生存曲线
3 讨论
食管癌是我国高发的恶性肿瘤之一,因早期症状隐匿,诊断时多数已出现远处转移,失去手术和放疗的机会。化疗是转移性食管癌的主要治疗手段,但有效率较低且不良反应发生率较高[19]。许多高龄病人脏器储备功能较差,并且往往合并有多种基础疾病,因此无法耐受强烈化疗。近年来随着CheckMate-648、ESCORT-1、KEYNOTE-590等研究结果的相继发布,一线化疗联合免疫治疗已成为老年转移性食管癌的标准治疗[20-22]。但值得注意的是,部分病人还无法从免疫治疗中获益。因此,我们努力寻找临床上可用于判断食管癌免疫治疗预后的指标,从而使病人可以从当前治疗策略的抉择中最大程度的获益。
目前,炎症与恶性肿瘤之间具有密切关联已经成为学界的共识,越来越多的研究表明,系统性炎症反应不仅促进或抑制肿瘤的发生和进展,还影响病人对全身抗肿瘤治疗的反应[23-24]。NLR是系统性炎症反应的重要指标之一,本研究探讨了NLR与接受免疫治疗的老年转移性食管癌病人预后的相关性,是少数在老年转移性食管癌一线免疫治疗中探索生物标志物的研究。本研究进一步优化 NLR分组的界值,不同于以往研究中采用中位数作为截断值或ROC曲线多次分组衡量得出的截断值,而是采取了一种更加客观和科学的方法,利用X-tile软件进行连续型变量的分类,得出最优截断值[25]。本研究结果显示,在接受一线免疫治疗的老年转移性食管癌病人中,NLR与PFS和OS显著相关。多因素Cox回归分析表明,NLR、ECOG评分是病人预后的独立影响因素。这与刘思凡等[17]在进展期食管癌中观察到的结果相一致。NLR可以作为抗PD-1免疫治疗的老年转移性食管癌病人简单、经济、有效的预后指标。
综上所述,NLR作为一种简单、经济且有效的预后指标,可以作为老年转移性食管癌病人免疫治疗疗效的预测因子,有利于临床决策。本研究的主要局限性是单中心、回顾性研究,还有一些潜在的混杂因素可能影响本研究结果。因此,我们期望一项前瞻性、多中心、大样本的临床试验来进一步探索。

