机械力化学法无溶剂合成β-苯并咪唑乙基丙二酸二甲酯类化合物
庞 杰, 车立杰, 吴 双, 刘志平, 黄燕敏
(南宁师范大学 广西天然高分子化学与物理重点实验室,广西 南宁 530001)
机械力化学作为一种新兴的绿色化学合成技术[1],不需反应溶剂(或仅需要少量液体助剂),依靠机械力提供振动能量在研磨罐中进行反应以完成高效化学转化[2]。与传统化学合成相比,机械力化学无需反应溶剂、反应时间短、反应效率高,并且能实现某些在反应瓶中难以实现的化学转化[3],这些特点完美契合了绿色化学的宗旨,在目前的绿色化学及小分子合成中发挥重要的作用。
供受体(D-A)环丙烷是一类重要的活性分子[4-6],在酸性条件下开环成1,3-两性离子,从而与强亲核性化合物(含氮、氧、硫等杂原子的亲核试剂)发生亲核加成的开环反应,成为构建含杂原子化合物的重要方法之一[7-10]。 2019年,FENG等[11]报道了乙烯基环丙烷-1,1-二羧酸酯与杂环化合物的开环反应,合成了一系列β-1,3-氮杂乙基丙二酸酯类化合物(图1)。体外抗肿瘤活性评估表明,部分化合物对急性淋巴白血病癌细胞生长(RS4; 11和H3122)具有显著的抑制效果。该反应需要在115 ℃的甲苯条件下微波反应30 min完成。
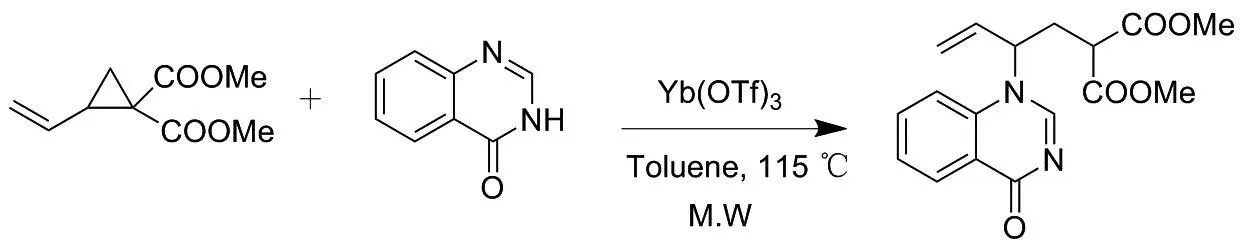
图1 β-1,3-氮杂杂芳环乙基丙二酸酯类化合物的合成路线Figure 1 Synthesis route of β-1,3-azaarylcycloethyl malonates
苯并咪唑为苯环与吡咯的稠杂环,分子中也具有氮杂芳环结构,其在材料、医药、化工和农药等领域有重要价值[12-13]。此外,很多含苯并咪唑的化合物具有抗菌[14]和抗肿瘤[15]等活性,在发光材料和荧光探针领域也有广泛的应用。若以苯并咪唑与供-受体环丙烷在路易斯酸催化下发生开环反应,也应得到具有β-苯丙咪唑乙基丙二酸酯类的结构化合物。
为丰富β-芳基乙基丙二酸酯类化合物的多元化合成,寻找一种反应时间较短、操作简单且无需有毒溶剂的方法来实现此反应。本课题组以供-受体环丙烷二酯(1a~1j)与苯并咪唑(2)为原料,以Yb(OTf)3(10%,物质的量分数,下同)为催化剂,采用机械力化学法于35 Hz频率振动研磨1.5 h,以42.9%~77.5%收率无溶剂合成了10个β-苯并咪唑乙基丙二酸二甲酯类化合物(3a~3j),合成路线如图2所示。

图2 β-苯并咪唑乙基丙二酸二甲酯类化合物的合成路线Figure 2 Synthesis route of β-benzimidazole ethyl dimethyl malonate derivatives
1 实验部分
1.1 仪器与试剂
AM100S型机械力球磨仪; Bruker Avance-400型核磁共振仪测定(CDCl3为内标); Waters Xevo G2型QT质谱仪; PL203型梅特勒电子天平。
所用试剂均为分析纯。
1.2 化合物3a~3j的合成(以3a为例)
将供-受体环丙烷1a(0.12 mmol)苯并咪唑2(0.1 mmol)依次放入装有3个研磨球(不锈钢材质,直径5 mm)的球磨罐(不锈钢材质,5 mL)中,然后加入10% Yb(OTf)3,将球磨罐置于球磨机中于35 Hz频率下研磨90 min。随后用二氯甲烷洗涤反应混合物及球磨罐,洗涤液浓缩后通过快速硅胶柱层析纯化得到β-苯并咪唑乙基丙二酸二甲酯类衍生物(3a)。3b~3j合成方法与3a相同。
2-(2-(1H-苯并[d]咪唑-1-基)-2-苯基乙基)丙二酸二甲酯(3a):黄色油状液体,收率60.0%;1H NMR(400 MHz, CDCl3)δ: 8.03(s, 1H), 7.81(dd,J=7.0 Hz, 1.8 Hz, 1H), 7.37~7.30(m, 4H), 7.28~7.21(m, 5H), 5.60(dd,J=8.8 Hz, 7.0 Hz, 1H), 3.70(d,J=6.3 Hz, 6H), 3.28(dd,J=7.9 Hz, 6.7 Hz, 1H), 3.07~2.94(m, 2H); HR-MS(ESI)m/z: calcd for C20H20N2O4{[M+Na]+}375.1325, found 375.1315。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(对甲苯基)乙基)丙二酸二甲酯(3b):黄色油状液体,收率49.4%;1H NMR(400 MHz, CDCl3)δ: 8.00(s, 1H), 7.83~7.77(m, 1H), 7.34~7.30(m, 1H), 7.26 ~7.21(m, 2H), 7.16(s, 4H), 5.55(t,J=7.9 Hz, 1H), 3.70(d,J=5.2 Hz, 6H), 3.27(t,J=7.3 Hz, 1H), 3.05~2.88(m, 2H), 2.32(s, 3H); HR-MS(ESI)m/z: calcd for C21H22N2O4{[M+Na]+}389.1479, found 389.1472。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(邻甲苯基)乙基)丙二酸二甲酯(3c): 黄色油状液体,收率48.2%;1H NMR(400 MHz, CDCl3)δ: 7.87(s, 1H), 7.79(m, 1H), 7.45~7.36(m, 2H), 7.29~7.25(m, 4H), 7.24~7.20(m, 1H), 5.86~5.81(m, 1H), 3.72(d,J=9.0 Hz, 6H), 3.39(t,J=7.2 Hz, 1H), 3.01~2.81(m, 2H), 2.25(s, 3H); HR-MS(ESI)m/z: calcd for C21H22N2O4{[M+Na]+}389.1481, found 389.1472。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(4-甲氧基苯基)乙基)丙二酸二甲酯(3d):黄色油状液体,收率42.9%;1H NMR(400 MHz, CDCl3)δ: 7.97(d,J=1.2 Hz, 1H), 7.82~7.77(m, 1H), 7.35~7.30(m, 1H), 7.27~7.17(m, 5H), 6.90~6.84(m, 2H), 5.53(t,J=7.9 Hz, 1H), 3.78(s, 3H), 3.69(dd,J=5.1 Hz, 1.2 Hz, 6H), 3.26(dd,J=7.9 Hz, 6.7 Hz, 1H), 3.02~2.85(m, 2H); HR-MS(ESI)m/z: calcd for C21H22N2O5{[M+Na]+}405.1430, found 405.1421。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(2-甲氧基苯基)乙基)丙二酸二甲酯(3e):黄色油状液体,收率45.4%;1H NMR(400 MHz, CDCl3)δ: 8.02(s, 1H), 7.83~7.78(m, 1H), 7.33~7.29(m, 1H), 7.27~7.23(m, 3H), 6.88~6.82(m, 2H), 6.78(t,J=2.2 Hz, 1H), 5.58~5.52(m, 1H), 3.75(s, 3H), 3.70(d,J=5.0 Hz, 6H), 3.28(dd,J=7.7 Hz, 6.9 Hz, 1H), 3.04~2.87(m, 2H); HR-MS(ESI)m/z: calcd for C21H22N2O5{[M+Na]+}452.1433, found 452.1421。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(4-氟苯基)乙基)丙二酸二甲酯(3f):黄色油状液体,收率77.5%;1H NMR(400 MHz, CDCl3)δ: 8.02(s, 1H), 7.84~7.79(m, 1H), 7.29~7.22(m, 5H), 7.07~7.01(m, 2H), 5.59(dd,J=8.9 Hz, 6.8 Hz, 1H), 3.69(d,J=9.9 Hz, 6H), 3.26(dd,J=8.0 Hz, 6.5 Hz, 1H), 3.06~2.89(m, 2H); HR-MS(ESI)m/z: calcd for C20H19FN2O4{[M+Na]+}393.1233, found 393.1221。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(4-氯苯基)乙基)丙二酸二甲酯(3g):黄色油状液体,收率49.1%;1H NMR(400 MHz, CDCl3)δ: 7.96(s, 1H), 7.75(d,J=7.6 Hz, 1H), 7.26(d,J=8.6 Hz, 1H), 7.19(d,J=4.8 Hz, 4H), 7.14~7.10(m, 2H), 5.55 ~5.49(m, 1H), 3.63(d,J=9.7 Hz, 6H), 3.19(dd,J=8.1 Hz, 6.4 Hz, 1H), 2.90(m, 2H); HR-MS(ESI)m/z: calcd for C20H19BrN2O4{[M+Na]+}430.0432, found 430.0420。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(3-氯苯基)乙基)丙二酸二甲酯(3h):黄色油状液体,收率48.2%;1H NMR(400 MHz, CDCl3)δ: 8.04(s, 1H), 7.85~7.80(m, 1H), 7.30~7.25(m, 6H), 7.11(m, 1H), 5.59(dd,J=9.2 Hz, 6.5 Hz, 1H), 3.70(d,J=9.6 Hz, 6H), 3.26(dd,J=8.3 Hz, 6.2 Hz, 1H), 3.03~2.92(m, 2H); HR-MS(ESI)m/z: calcd for C20H19ClN2O4{[M+Na]+}409.0932, found 409.0926。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(呋喃-2-基)乙基)丙二酸二甲酯(3i):黄色油状液体,收率56.8%;1H NMR (400 MHz, CDCl3)δ: 7.91(s, 1H), 7.81~7.77(m, 1H), 7.44(m, 1H), 7.40(dd,J=1.8 Hz, 0.8 Hz, 1H), 7.29~7.25(m, 2H), 6.41~6.35(m, 2H), 5.68(t,J=7.9 Hz, 1H), 3.69(s, 3H), 3.65(s, 3H), 3.23(t,J=7.3 Hz, 1H), 2.91(m, 2H); HR-MS(ESI)m/z: calcd for C18H18N2O5{[M+Na]+}365.1113, found 365.1108。
2-(2-(1H-苯并[d]咪唑-1-基)-2-(噻吩-2-基)乙基)丙二酸二甲酯(3j):黄色油状液体,收率50.3%;1H NMR (400 MHz, CDCl3)δ: 7.96(d,J=1.1 Hz, 1H), 7.84~7.79(m, 1H), 7.44~7.40(m, 1H), 7.29(m, 3H), 7.05(m, 1H),7.00(m, 1H), 5.88(dd,J=8.7 Hz, 7.0 Hz, 1H), 3.69(dd,J=20.2 Hz, 1.1 Hz, 6H), 3.30~3.24(m, 1H),3.11~2.92(m, 2H); HR-MS(ESI)m/z: calcd for C18H18N2O4S{[M+Na]+}381.0883, found 381.0879。
2 结果与讨论
2.1 供-受体环丙烷与苯并咪唑开环反应的条件优化
采用供-受体环丙烷(1a)与2为底物,以三氟甲烷磺酸镱为催化剂,在振动频率35 Hz下反应1.5 h,以中等收率60%得到目标产物3a(表1, Entry 1)。随后对催化剂路易斯酸,反应时间以及振动频率进行筛选。首先考察了不同催化剂对反应收率的影响,发现其它催化剂只有少量产物(表1, Entries 2~6),因此确定了三氟甲烷磺酸镱为反应催化剂。接着筛选了液体研磨辅助剂,发现加入微量甲苯较其它助剂效果稍好,但对收率影响不大(表1, Entries 7~11)。但考虑环境的影响,还是选择无溶剂反应。之后对反应时间进行考察,发现反应时间对产物收率有很大的影响(表1, Entries 12~13),由实验结果表明,反应时间为1.5 h时,收率为60%,效果最佳。在确定反应时间以及催化剂无溶剂的情况下,又对振动频率进行筛选,发现振动频率越低,收率越低(表1, Entries 14~15)。因此确定反应的最优条件为:以三氟甲烷磺酸镱为催化剂,振动频率为35 Hz,反应时间为1.5 h。
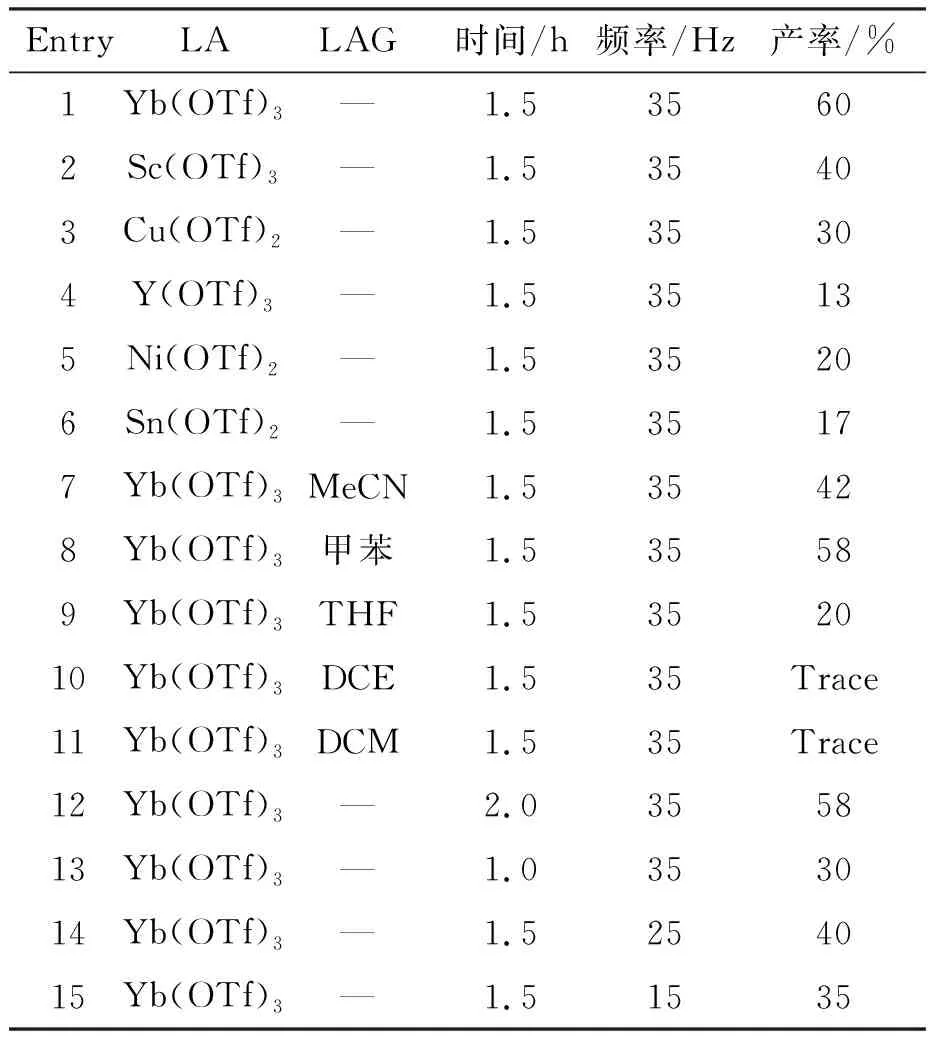
表1 供-受体环丙烷与苯并咪唑开环反应的条件优化*Table 1 Optimization of ring opening reaction conditions between donor and recipient cyclopropane and benzimidazole
2.2 底物拓展
在已经确立的最优条件下(表1, Entry 1),本课题组研究了反应底物的适应性。首先考察了供-受体环丙烷耐受性,发现环丙烷苯环上存在供电子基团的产率要略低于吸电子基团的产率(图3,3a~3d),且邻位取代基的供-受体环丙烷所得到的目标产物产率要略低于对位取代基的环丙烷。从电子效应角度考虑,苯环上连吸电子基团可增大苄基位置的正电荷,有利于苯并咪唑N的进攻;从位阻角度考虑,苯基上邻位取代基较对位取代基对苯并咪唑的亲核进攻位阻更大(图3,3b~3c)。最后又尝试了其它杂环环丙烷双酯与苯并咪唑进行开环反应,均能以中等产率得到苯并咪唑对环丙烷开环的产物(图3,3i~3g)。
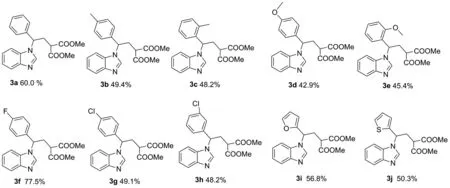
图3 供-受体环丙烷与苯并咪唑开环反应底物拓展图3 Substrate expansion of donor receptor cyclopropane and benzimidazole ring opening reaction
本文采用机械力化学法,以供-受体环丙烷二甲酯和苯并咪唑为原料,以路易斯酸三氟甲烷磺酸镱为催化剂,在机械力球磨振动频率为35 Hz下反应1.5 h,以42.9%~77.5%产率合成了10个β-苯并咪唑乙基丙二酸二甲酯类衍生物(3a~3j),其结构经核磁氢谱及高分子质谱进行了确定。该方法相与传统溶剂法相比,具有条件温和、操作简单、底物拓展性好且无溶剂等优点。

