冷缺血时间对不同疾病类型肝组织质量的影响
马婷婷,毕森盛,曹磊,印志琪,段可然,王政禄,郑虹
目的 高质量的肝脏组织样本对肝脏疾病的研究至关重要,冷缺血时间(CIT)是影响组织样本质量的关键因素,探讨冷缺血时间与不同疾病类型肝组织样本质量的相关性,为获得高质量肝组织样本提供标准。
方法 选取天津市第一中心医院进行手术治疗的肝癌(HCC)和胆道闭锁(BA)患者各 30 例,手术切除肝组织后,室温放置 0、0.25、0.5、1、2、3、5 和 6 h 后,分别从基因水平、蛋白水平及形态学水平对组织质量进行检测,提取总 RNA 及基因组 DNA,分别检测浓度、纯度及完整性(RIN/DIN 值),荧光定量 PCR 检测组织样本冷缺血 0、6 h 后 ALB 基因表达水平;免疫组化方法检测组织样本冷缺血 0、6 h 后 HepPar1、CK19、CD34、Vimentin 蛋白表达情况,Western blot 检测组织样本冷缺血 0、6 h 后ALB 蛋白表达水平;HE 染色观察组织样本冷缺血 0、6 h后组织及细胞形态学变化。
结果 DNA 产量、RNA 纯度和 RNA RIN 随时间变化,时间效应具有统计学意义。组间效应不显著,表明肝癌和胆道闭锁组间没有差异。DNA 产量和 RNA RIN 的交互效应有统计学意义,说明时间的影响随着组别不同而有所不同。与冷缺血 0 h 相比,肝癌、胆道闭锁组织样本冷缺血 6 h 后ALB 基因表达水平降低,差异具有统计学意义(P < 0.05);免疫组化方法检测组织样本冷缺血 0、6 h 后 HepPar1、CK19、CD34、Vimentin 蛋白表达情况均无变化,Western blot检测显示组织样本冷缺血 0、6 h 后 ALB 蛋白表达水平无显著变化;石蜡切片 HE 染色显示样本冷缺血 0、6 h 后组织及细胞形态学无变化。
结论 冷缺血时间对肝组织样本中核酸质量具有显著影响,缩短冷缺血时间可获得高质量肝组织样本。
人体组织样本是临床诊断和科学研究中应用最为广泛的生物样本资源之一,选择科学的采集和保存方法,可确保组织样本的质量。基因水平、蛋白水平及组织形态学是医学研究、个性化和靶向治疗中的重要研究内容[1-2]。近年来,世界上建立了越来越多的疾病组织样本库[3-6]。样本质量是样本库的核心,做好质量控制与管理可以尽量减少样本质量的变化,保持样本原有性质。目前分析前因素或变量对样本质量影响较大,在分析组织样本中的蛋白质、RNA 和 DNA 等不稳定大分子时,冷缺血时间被普遍认为是重要分析前变量。大量研究发现,手术中断血流后不稳定分子活性逐渐丧失[7],研究表明,缺血时间优先影响肝细胞,随着冷缺血时间的延长,肝细胞膜损坏,产生大量的代谢物,且肝内代谢物的增加与缺血时间相关[8]。冷缺血时间一直被认为是决定组织质量的关键因素[9],研究表明,延长冷缺血时间可影响多种组织样本中的RNA 的质量,且不同器官组织样本中 RNA 的质量也存在差异[10-16]。因此,在肝组织内确立标准化的缺血时间,以确保采集、处理及储存中分子成分与质量的稳定对于样本质量控制有着重要意义。肝脏疾病的研究已成为当今器质性疾病领域研究的热点与难点[17-19]。研究表明,不同疾病类型肝组织样本质量也不完全相同[20-22]。组织样本质量受手术方式、储存温度、缺血时间等外在条件的影响,疾病本身的临床特征或病理特征也可能会影响样本质量[10]。
本研究选取肝癌和胆道闭锁两种类型的肝病组织样本进行质量检测,探究冷缺血时间与不同疾病类型肝组织 DNA、RNA、蛋白质及形态学之间的关系,寻找不同疾病类型肝组织样本核酸、蛋白及形态学最适缺血时间。
1 材料和方法
1.1 材料
实时荧光定量 PCR 仪(LightCycler480 II)、全自动免疫组化染色仪(Benchmark XT)和 DAB试剂盒均为瑞士 Roche 公司产品;正置显微镜(DM750)为德国 Leica 公司产品;化学发光成像系统(Tanon-4800)为上海天能生命科学有限公司产品;Airstream® A2 型二级生物安全柜(AC2-4S1)为新加坡 Esco 公司产品;HHS-21-6 型电热恒温水浴锅为上海博迅实业有限公司医疗设备厂产品;台式高速冷冻离心机为德国 Sigma 公司产品;TP-24 组织快速破碎仪为杰灵仪器制备(天津)有限公司产品;GL-1900 干式恒温器为海门市其林贝尔仪器制造有限公司产品;ND5000 超微量紫外可见光分光光度计为北京百泰克生物技术有限公司产品;4200 TapeStation 生物分析仪、RNA ScreenTape、RNA ScreenTape Sample Buffer、Genomic DNA ScreenTape、Genomic DNA Sample Buffer 均为美国 Agilent 公司产品;RNAlater 为美国 Thermo Fisher 公司产品;RNA 提取试剂盒(DP431)、DNA 提取试剂盒(DP304)为天根生化科技(北京)有限公司产品。
RIPA 裂解物缓冲液(AQ521)为北京擎科生物科技股份有限公司产品;蛋白酶抑制剂 Cocktail(HY-K0010)为美国 MedChemexpress 生物科技公司产品;BCA 蛋白定量试剂盒(BD0028)为美国 Bioworld 公司产品;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF 膜,ISEQ00010)为美国 Millipore 公司产品;ALB 抗体(A1363,1:1000)、GAPDH 抗体(A19056,1:1000)、二抗Goat anti-IgG-HRP(AS003/AS014,1:10000)为武汉爱博泰克 ABclonal 生物科技有限公司产品;CK19 抗体、Vimentin 抗体、CD34 抗体、HepPar1抗体为美国 Santa Cruz Biotechnology 公司产品。
1.2 方法
1.2.1 组织样本采集 选取在天津市第一中心医院进行手术治疗的肝癌、胆道闭锁患者各 30 例。所有患者或家属均签署知情同意书,并通过医院伦理委员会批准。手术切除肝组织后收集患者样本,放入生物安全柜内,用无菌无酶的剪刀将样本平均分开(约 10 mg),分别放入无菌无酶的冻存管中,室温放置 0、0.25、0.5、1、2、3、5 和 6 h 后加入 RNAlater,放入 4 ℃ 过夜或加入福尔马林室温固定,弃去 RNAlater,储存于 -80 ℃ 冰箱。
1.2.2 核酸提取及检测 基因组 DNA 及总RNA 提取选择试剂盒提取法,提取步骤按说明书操作。生物分析仪检测核酸浓度及完整性,根据浓度计算出产量。分光光度计测定核酸纯度,读取吸光度比值。Real-time PCR 检测组织样本中 ALB基因的表达水平,引物序列如下,ALB 基因正向引物:5' GAGACCAGAGGTTGATGTGATG 3';ALB 基因反向引物 5' AGTTCCGGGGCATAAAA GTAAG 3';GAPDH 基因正向引物 5' GGAGCGA GATCCCTCCAAAAT 3';GAPDH 基因反向引物5' GGCTGTTGTCATACTTCTCATGG 3',引物由天津舍为斯生物技术有限公司设计合成。取 1 μg 总RNA,利用逆转录试剂盒将 RNA 逆转录为 cDNA备用,取 1 μl cDNA 为模板进行 PCR 反应,PCR扩增条件:95 ℃ 15 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,42 个循环。
1.2.3 蛋白提取及检测 将 RIPA 裂解物缓冲液和蛋白酶抑制剂 Cocktail 混合(100:1)加入组织样品中进行总蛋白提取,4 ℃ 摇床孵育 10 min,12 000 r/min 离心 15 min,收取蛋白立即使用。采用 BCA 蛋白定量法测定蛋白浓度,具体操作按说明书进行。
Western blot 检测组织样本中 ALB 蛋白表达水平,配置 SDS-PAGE 胶,蛋白上样量为每孔20 μg,转移到 0.22 μm 孔的 PVDF 膜。5% 脱脂奶粉进行封闭 1 h;ALB 抗体、GAPDH 抗体 4 ℃摇床孵育过夜;二抗 Goat anti-IgG-HRP 室温下摇床孵育 1 h;使用化学发光成像系统曝光,图片分析采用 Image J 软件。
免疫组化染色:按照罗氏全自动免疫组化染色仪说明书设置染色程序,将石蜡切片进行自动免疫组化染色。选用下列一抗:CK19、Vimentin、CD34、HepPar1,孵育 30 min,最后使用 ultraView 通用DAB 试剂盒进行显色。
结果判读:由病理医生进行评分,评分内容包括染色强度和染色阳性率,染色强度评分标准为:浅黄色为 1 分、棕黄色为 2 分、棕褐色为 3 分。染色阳性率的评分标准为:< 5% 记 0 分,5% ~25% 记 1 分,26% ~ 55% 记 2 分,56% ~ 85% 记3 分,> 85% 记 4 分。两者得分相加,1 ~ 2 分为弱阳性,3 ~ 4 分为中阳性,5 ~ 7 分为强阳性。
1.2.4 形态学检查 HE 染色:二甲苯脱蜡,梯度乙醇脱二甲苯。苏木素染液染色 10 min,1% 盐酸乙醇分色,自来水蓝化 5 min。伊红染液染细胞质5 min,梯度乙醇脱水、二甲苯透明、中性树胶封片。于高倍光镜下观察肿瘤细胞形态、分布及细胞核的病理改变。
1.3 统计学处理
Shapiro-Wilk 检验用于确定数据的分布。符合正态分布的连续变量用平均值和标准差值表示,并在各组之间进行独立的t检验。不符合正态分布的连续变量由中值和四分位间距表示,并在这些组之间进行 Mann-Whitney U 检验。使用符合正态分布和方差均匀性的项目进行方差重复测量分析(ANOVA)。如果数据符合 Mauchly 的球形假设检验,则使用双因素方差分析;如果数据不满足Mauchly 的球形假设,则使用 Greenhouse Geisser方法来校正数据。在重复测量方差分析结果中,如果时间和组之间没有交互作用,则直接使用主效应检验来评估组的效果;如果时间和群体之间存在交互作用,则应分析个体效应,即通过单因素重复方差测量来分析群体内效应。使用 Pearson 相关分析各组之间的相关性;使用 Bonferroni 方法校正测试水平 α = 0.05,然后分两对进行比较。数据采用SPSS 25.0 统计软件进行分析。
2 结果
2.1 冷缺血时间对 DNA/RNA 质量的影响
为了确定冷缺血时间对不同疾病类型肝组织质量的影响,收集了肝癌患者(n = 30)和胆道闭锁患者(n = 30)的肝组织,并在冷缺血后 0、0.25、0.5、1、2、3、5 和 6 h 提取了 DNA 和 RNA。采用重复测量方差分析比较不同时间 DNA 产量、DNA 纯度、DNA DIN、RNA 产量、RNA 纯度、RNA RIN 的差异。结果显示,DNA 产量、RNA 纯度和 RNA RIN 随时间变化,时间效应具有统计学意义(图 1 和图 2)。组间效应不显著,表明肝癌和胆道闭锁组间没有差异。DNA 产量和 RNA RIN的交互效应有统计学意义,说明时间的影响随着组别不同而有所不同(表 1 ~ 2)。肝癌、胆道闭锁组织样本分别在冷缺血 5、3 h 后 RNA RIN 值下降至 7 以下(图 2C),生物分析仪模拟电泳图显示组织样本冷缺血时间延长至 6 h 后,28 S 条带亮度明显低于 18 S,说明 RNA 已经发生了不同程度的降解,而某些实验如高通量测序等对 RNA 质量要求较高,往往要求 RNA RIN 值大于 7(图 2E)[23]。白蛋白由肝细胞合成,占血浆总蛋白的 50% ~60%,具有维持血浆胶体渗透压和免疫调节的功能。本研究进行了荧光定量 PCR 来评估不同疾病类型中 ALB 的 mRNA 水平。与冷缺血 0 h 相比,冷缺血 6 h 后 HCC 和 BA 组织中 ALB 基因的表达显著降低(P< 0.05)(图 2D)。
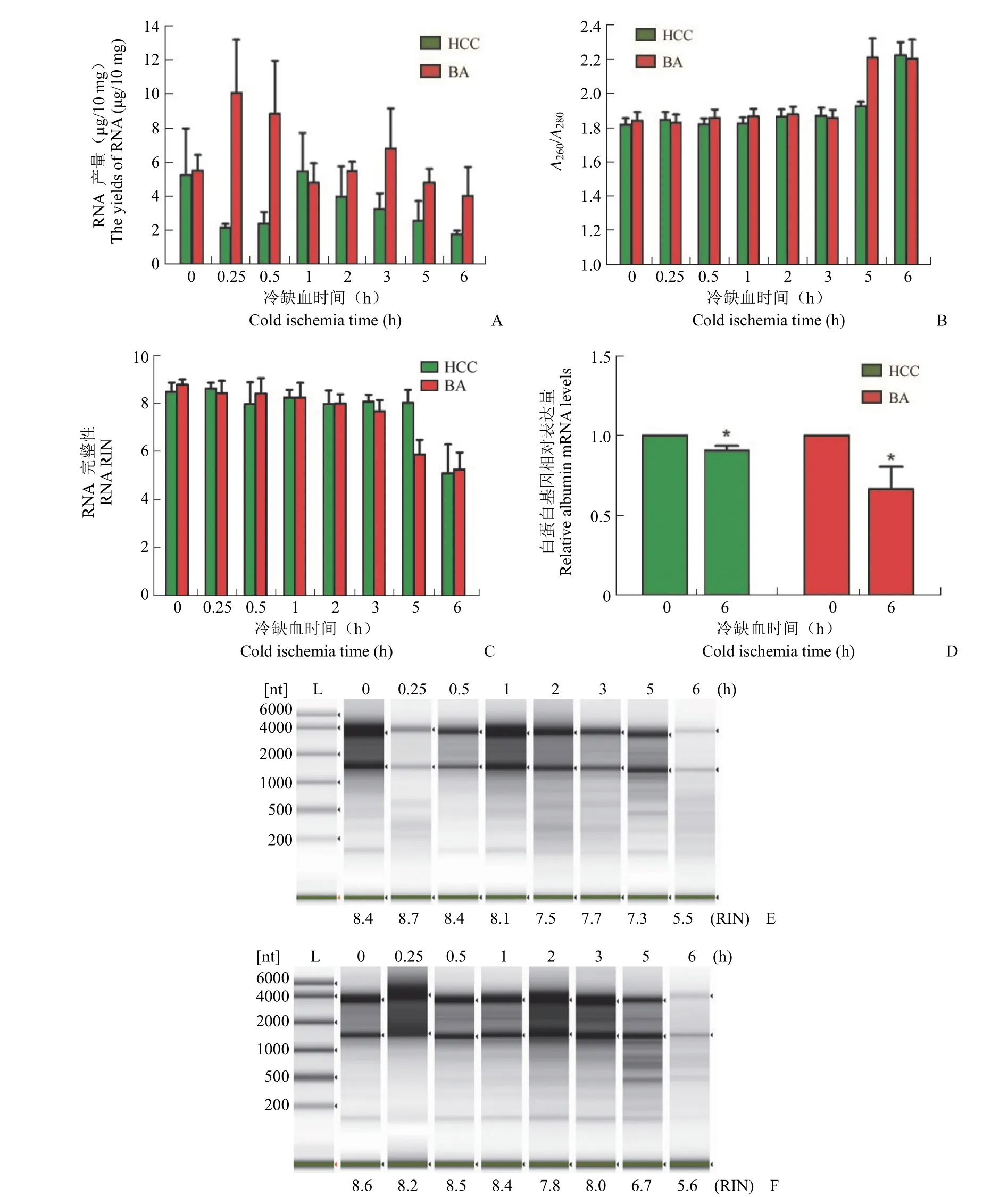
图2 冷缺血时间对不同疾病类型肝组织 RNA 质量的影响[A:RNA 产量;B:RNA 纯度;C:RNA RIN 值;D:ALB 基因表达量,*P < 0.05;E:生物分析仪模拟电泳图(肝癌);F:生物分析仪模拟电泳图(胆道闭锁)]Figure 2 Effect of CIT on RNA quality of liver tissue in different disease types [A: RNA yields; B: RNA purity; C: RNA RIN; D:ALB gene expression, *P < 0.05; E: Simulated electrophoretogram of bioanalyzer (HCC); F: Simulated electrophoretogram of bioanalyzer (BA)]
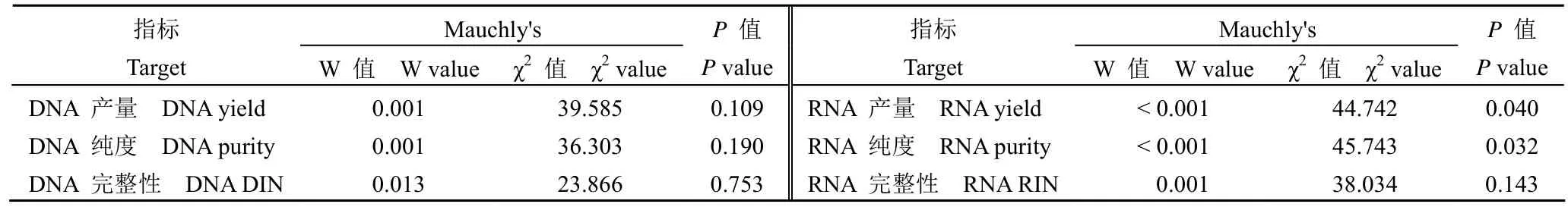
表1 Mauchly 球形检验结果Table 1 The results of Mauchly′s test of sphericity
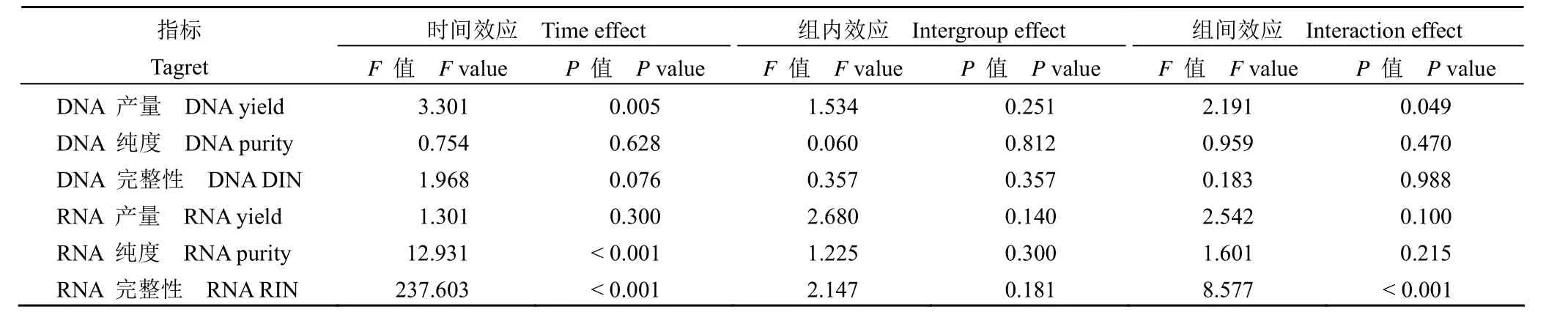
表2 重复测量方差分析结果Table 2 The repetitive measure ANOVA analysis results
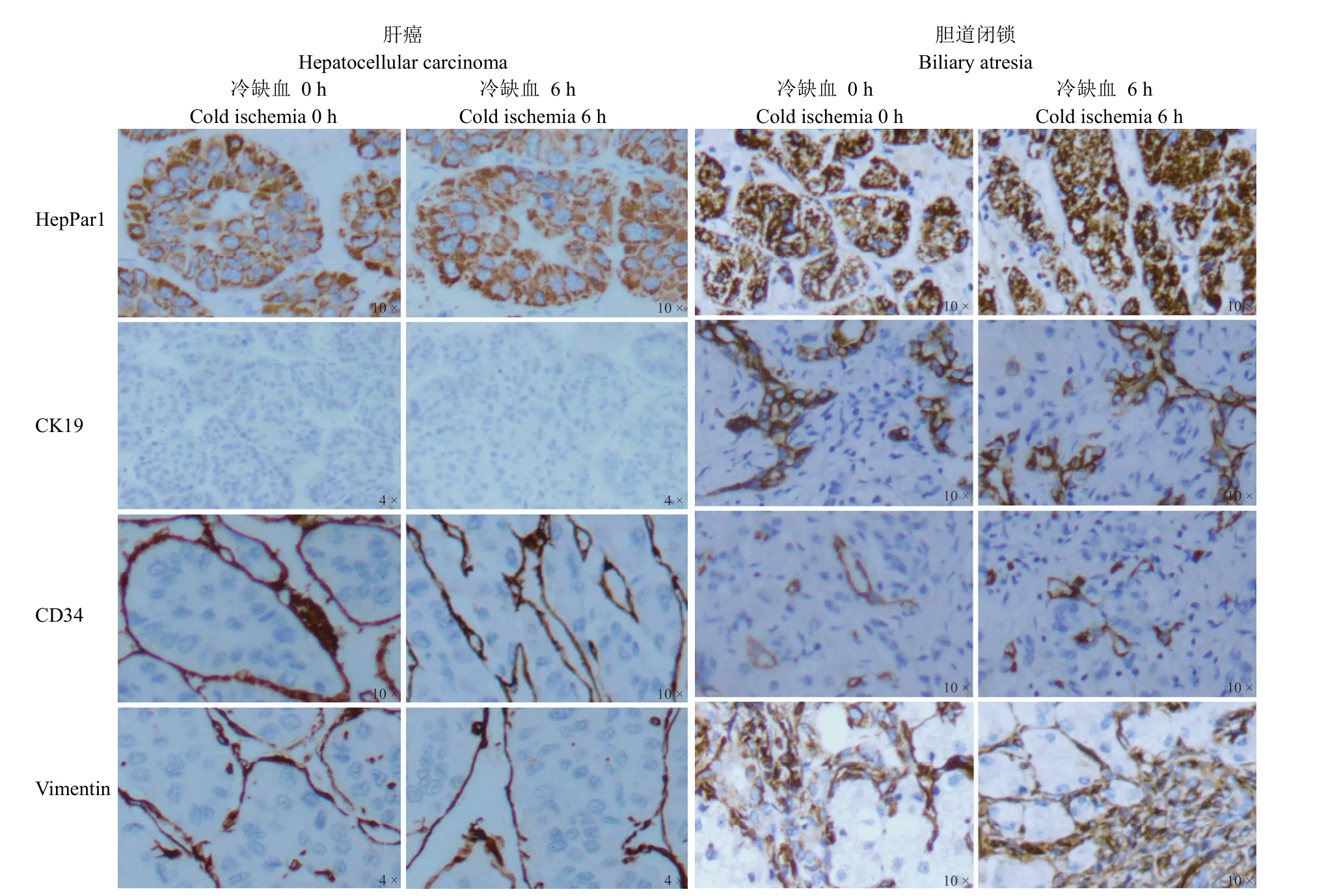
图3 冷缺血时间对肝组织蛋白质量的影响Figure 3 The effect of CIT on liver tissue protein quality
2.2 冷缺血时间对不同疾病类型肝组织蛋白质质量的影响
肝癌、胆道闭锁组织内 HepPar1、CD34、Vimentin 阳性表达,肝癌组织中 CK19 阴性表达、胆道闭锁组织中 CK19 阳性表达,与冷缺血 0 h相比,无论是肝癌还是胆道闭锁组织样本冷缺血6 h 后 HepPar1、CD34、Vimentin、CK19 蛋白表达均无差异(P> 0.05)(图 3、表 3)。与冷缺血0 h 相比,冷缺血 6 h 后肝癌、胆道闭锁组织样本ALB 蛋白表达水平无显著变化,而在冷缺血 0 h时,肝癌 ALB 蛋白表达量低于胆道闭锁,差异具有统计学意义(P< 0.05)(图 4)。
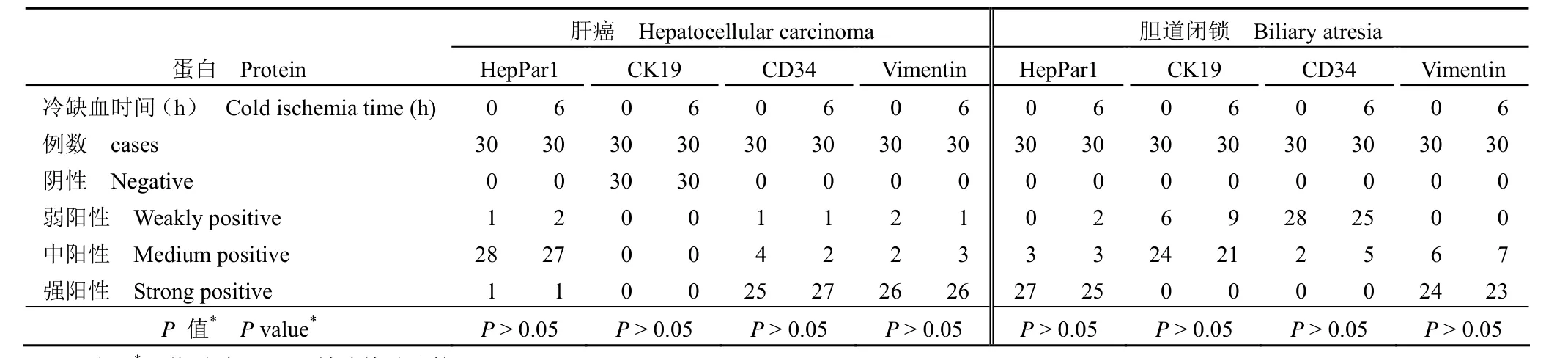
表3 不同冷缺血时间下肝组织蛋白质量分析Table 3 Analysis of liver tissue protein quality under different CIT
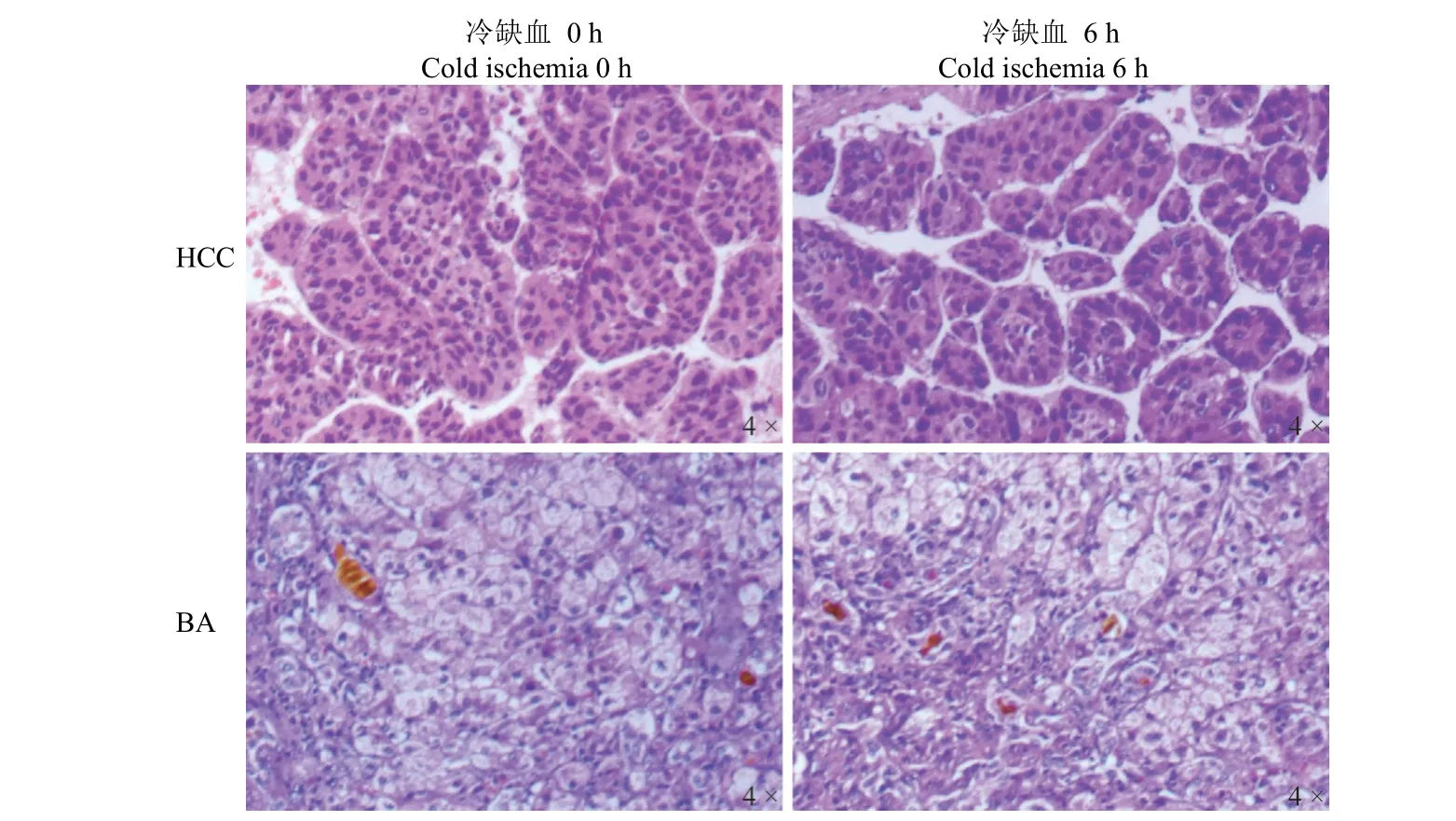
图5 冷缺血时间对不同疾病类型肝组织形态学特征的影响Figure 5 The effect of CIT on the morphological characteristics of liver tissue in different disease types
2.3 冷缺血时间对不同疾病类型肝组织形态学的影响
肝癌、胆道闭锁组织样本冷缺血 0 h 和 6 h后,HE 染色检测组织细胞形态。结果显示,与冷缺血 0 h 相比,冷缺血 6 h 后,肝癌组织样本细胞核形态、核浆比例及排列形式均无变化,胆道闭锁组织样本细胞形态和纤维化程度均无变化(图 5)。
3 讨论
组织样本是生物医学、临床和转化研究的宝贵资源。疾病组织中的分子质量或组学分析的结果在很大程度上取决于组织的收集、处理和储存条件。因此,拥有高质量的样本对于生物样本库的建设至关重要。本研究旨在分析冷缺血时间对肝癌和胆道闭锁两种不同良恶性程度的组织样本质量,发现不同疾病类型的肝脏样本对冷缺血时间的耐受程度存在一定的差异。以往研究也表明不同疾病类型肝脏组织样本质量存在差异且冷缺血时间是组织样本 RNA 完整性的关键因素[10,20-21,24],因此,本研究认为不同的致病因素和疾病类型可能会对组织质量产生不同的影响。
肝脏是机体中一个重要的实质性代谢器官,含有丰富的酶类系统。肝癌是位列第五最常见和第三最致命全球癌症[25],因此其死亡率也居高不下,且其具有代谢活跃以及肿瘤微环境等特殊的代谢特点,为此研究肝癌疾病的发生与发展至关重要。胆道闭锁是发生于婴幼儿时期的一种少见胆道疾病,往往伴有不同程度的胆汁淤积及纤维化,但其发病机制尚未明确,因此,阐明其发病机制、寻找其发病演进的生物标记物,从而进行早期诊断及控制胆道闭锁的进展至关重要。而高质量的样本可以最大限度保证实验研究的准确性及可重复性,因肝癌和胆道闭锁组织样本在疾病的良恶性程度、伴随症状及代谢特点等方面都存在差异,为此本研究认为,具有不同疾病类型的肝脏组织很有研究价值,为不同疾病类型的肝组织样本寻找更合适的冷缺血时间。本研究选取肝癌和胆道闭锁肝切或肝移植患者组织样本,由于肝移植的组织样本会经历肝脏全切、样本转运取材等复杂的手术及处理过程,很难保障短时间内进入液氮保存,因此,移植样本更应该关注样本冷缺血时间。本研究发现,肝癌和胆道闭锁组织样本可耐受的最长冷缺血时间分别为 5 h和 3 h,且 RNA 的稳定性与肝脏组织疾病类型具有一定的相关性。这可能由肝脏疾病的临床特征或病理特征决定。我们将在后期研究中进一步探究其发生机制。
目前,组织 RNA 的 RIN 值是评估组织质量的最佳方法。Caixeiro 等[26]进行了一项系统调查,结果显示 RNA RIN 值对评价组织质量尤为重要。在 Barretos 样本库中同样使用 RNA 的 RIN 值来评估长期低温保存样本的质量[1]。本研究分别从DNA、RNA、蛋白质及形态等方面对组织质量进行评估,发现组织经过冷缺血时间处理后只有 RNA的质量发生改变,RNA 由于其自身结构及核酸酶的存在使得 RNA 极不稳定,正是由于 RNA 的极不稳定性的特点,使其成为评估组织质量的关键因素[27]。本研究发现肝癌组织样本的初始 RNA RIN值要低于胆道闭锁,且随着冷缺血时间的延长,肝癌组织样本 RNA RIN 值比较稳定,直到冷缺血5 h 时 RIN 值才发生明显变化,而胆道闭锁组织样本 RIN 值随时间延长缓慢下降,直到冷缺血3 h 后陡然下降,存在这种现象可能是由于冷缺血时间可影响肝癌细胞新陈代谢产物的变化,而且肿瘤组织具有血供丰富、多克隆性以及微环境存在的特点,其代谢更加快速复杂,某些代谢产物的减少或者增加可能出现更适合 RNA 存在的环境,使RNA 更加稳定[13]。RNA 的质量直接决定下游分子表达变化,研究表明,对于具有一定程度 RNA 降解的样本,荧光定量 PCR 也可用于获得目标基因的相对表达,从而提高稀有样本的利用率。而另一些研究表明,RNA 完整性的微小差异可以影响基因表达,胎盘样本冷缺血 90 min 后,样本不能用于基因表达分析[28-31]。本研究选取肝脏中表达丰度较高的 ALB 进行基因水平检测,在 ALB 基因成熟 mRNA 的翻译区选取 114 bp 进行扩增,发现冷缺血 6 h 后,肝癌、胆道闭锁组织样本 ALB 基因表达水平均下降,可能因为 RNA RIN 值的变化可以影响后续基因的表达水平[32],而 RIN 值的大小与基因片段长度之间的关系还需要进一步探究。
DNA、蛋白质及形态学也可用于组织样本质量的检测且检测方法多种多样[33-34],为了保障实验的准确性,我们选取 4200 生物分析仪、免疫组化、Western blot 及 HE 对组织质量进行检测。在以往研究中,DNA、蛋白质及形态学评估生物样本的质量往往不敏感,可能是因为 DNA、蛋白质及形态学比 RNA 更稳定[31,35]。以往研究发现,从胰腺组织样本中分离高质量的分子非常困难,因为其组织内部含有大量的蛋白酶、DNA 酶和 RNA 酶,这些酶的存在使离体组织立即启动自溶,从而破坏组织样本质量[36-37]。本研究发现组织样本冷缺血 6 h后,肝癌和胆道闭锁组织样本 DIN 值、蛋白质及形态学均未发生变化,相比于胰腺组织来说,肝脏组织具有更加稳定的微环境。本研究发现胆道闭锁组织中 ALB 蛋白表达水平高于肝癌组织样本,ALB 蛋白由肝细胞分泌产生,而肝细胞的生理状态受冷热缺血时间、疾病类型、年龄、性别及药物等因素的影响,导致 ALB 蛋白在不同疾病中的表达差异[38],具体机制还需进一步研究。
冷缺血时间对肝组织样本中核酸质量具有显著影响,肝癌和胆道闭锁组织分别在冷缺血 5 h 和3 h 可获得高质量的 RNA,缩短冷缺血时间可获得高质量肝组织样本,冷缺血时间与组织中蛋白水平及形态学水平均无相关性。

