利用Knoevenagel缩合反应合成聚集诱导发光型丙烯腈衍生物
尹昱婷,张博轩,刘欣怡,苏小龙,齐春轩,冯海涛
宝鸡文理学院化学化工学院,AIE (聚集诱导发光)研究中心,陕西 宝鸡 721000
1 引言
发光材料被广泛应用于人类社会的各个领域,对人类社会的发展至关重要,与无机发光材料相比,有机发光材料具有光色易调、发光效率高、功耗低、响应速度快、易加工、成膜性好等优点。但传统有机发光材料由于聚集诱导荧光淬灭(Aggregation-caused Quenching,ACQ)效应,严重限制了其实际应用[1]。传统荧光化合物通常在单分子或稀溶液中有强烈的荧光发射,但当分子发生聚集或在固体状态时荧光淬灭,引起该现象的主要原因是相邻的发光分子间容易形成π–π堆积,使激发态分子以非辐射方式回到基态,导致荧光淬灭。聚集诱导发光现象则与之完全相反,该类分子在溶解状态下发光微弱,而在聚集状态下或固态、薄膜中荧光急剧增强[1,2]。自2001年首例AIE分子(1-甲基-1,2,3,4,5-五苯基噻咯)被报道以来[3],AIE分子由于其良好的光物理性能,被广泛应用于固态发光器件、有机光电、生物成像、光动力治疗、化学/生物传感等前沿领域[2,4,5]。掌握AIE材料的发光机理对该类材料的设计有很大的指导意义,经过大量研究,目前最为广泛接受的机理是由唐本忠教授等人提出的分子内运动受限(restriction of intramolecular motion,RIM)[2],包括分子内旋转受限(restriction of intramolecular rotation,RIR)和分子内振动受限(restriction of intramolecular vibration,RIV)两种。AIE分子在聚集或固体状态下限制了分子内的运动导致激发态能量以辐射跃迁的方式被释放,直观表现为强烈荧光。因此,我们希望在有机实验课堂上,通过利用经典有机合成方法构筑AIE化合物,让学生在掌握有机合成反应机理及实验操作的同时,初步了解AIE荧光分子的分子结构特点及AIE材料发光机理,进一步增强有机实验课程趣味性。
Knoevenagel缩合反应是经典的有机人名反应之一,目前在《有机化学实验》中已有所涉及[6]。该类反应通常是将一种羰基化合物与活性亚甲基脱水缩合,用于碳碳双键的构建,是制备取代烯烃类化合物的一种重要且常用的方法。利用该反应合成的α,β-不饱和化合物是一类重要的有机化合物及反应中间体,在精细化工品、医药中间体、生命科学制备等领域发挥着重要作用[7,8]。因此,我们期望在有机实验课程中引入Knoevenagel缩合反应,使学生掌握Knoevenagel缩合反应的机理、实验操作及其应用。
本实验利用Knoevenagel缩合反应,将4-氰基苯乙腈与芳香醛在碱性条件下,通过分子间脱水,制备同时含供电子基和吸电子基的丙烯腈衍生物。该实验具有原料易得、条件温和、反应时间短、操作简便、高产率和易重复的特点,极其适用于本科生实验教学。同时,还可以采用核磁共振谱(NMR)确定化合物结构,利用紫外-可见吸收光谱、荧光发射光谱研究目标化合物的光物理性质,为本科生初步了解有机化合物结构与性能表征提供案例,有利于激发学生对有机化学、有机化学实验、材料化学的学习兴趣,同时也能使学生对AIE的相关研究有初步了解。
2 实验部分
2.1 实验原理
Knoevenagel缩合反应是指具有活性亚甲基的化合物(例如:丙二酸酯、β-酮酸酯、氰乙酸酯、硝基乙酸酯等)在弱碱的催化作用下,与醛、酮发生脱水缩合反应,得到α,β-不饱和化合物的反应。反应机理是羰基化合物在伯胺、仲胺或铵盐的催化下形成亚胺过渡态,然后与活性亚甲基化合物所形成的碳负离子加成。利用Knoevenagel缩合反应制备丙烯腈衍生物,其制备反应式如图1所示,反应机理如图2所示[6]。
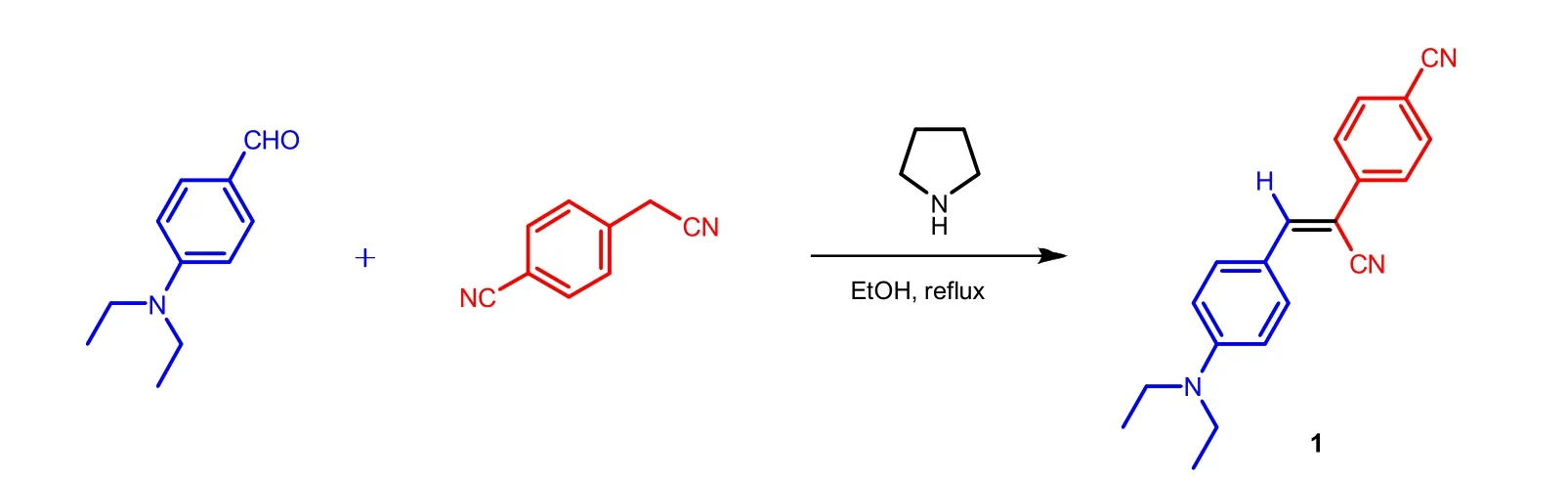
图1 丙烯腈衍生物的制备反应式

图2 丙烯腈衍生物合成机理
2.2 实验试剂或材料
4-氰基苯乙腈、N,N-二乙基-4-氨基苯甲醛、苯甲醛、4-溴苯甲醛、4-硝基苯乙腈、4-甲酰基苯甲醛、苯乙腈、糠醛、2-萘甲醛、乙醇、四氢吡咯(该实验所用试剂均为分析纯)。
2.3 仪器和表征方法
实验仪器:25 mL圆底烧瓶、球形冷凝管、干燥管、抽滤装置、便携式紫外灯、分析天平(赛多利斯GL224-1SCN)、核磁共振仪(德国布鲁克Agilent-400 MHz)、磁力加热搅拌器(北京大龙MS7-H550-S)、紫外-可见吸收光谱仪(日本岛津UV-2550)、稳态-瞬态荧光光谱仪(法国Horiba FluoroMax-4)。
表征方法:采用核磁共振谱(NMR)确定化合物结构,通过紫外-可见吸收光谱、荧光发射光谱研究目标化合物的光学性质。
2.4 实验步骤
(1) 制备:在干燥的25 mL圆底烧瓶中依次加入用分析天平称量的4-氰基苯乙腈(0.2843 g,2 mmol)、N,N-二乙基-4-氨基苯甲醛(0.3545 g,2 mmol),依次量取15 mL乙醇和40 μL四氢吡咯,注入反应瓶中,安装球形冷凝管及干燥管,连接回流水。在90 °C下加热回流30 min。
(2) 纯化:冷却,待固体析出完全后,减压抽滤,滤饼用冷乙醇(10 mL)洗涤3次,随后将其转移至圆底烧瓶中,加6 mL二氯甲烷,加热使固体完全溶解,随后逐滴加入乙醇,待溶液中有固体物质开始出现时(约12 mL),停止滴加,随后,缓慢冷却至室温,冰浴使其结晶完全,待晶体析出完全后抽滤。将滤饼真空干燥2–3 h。得到0.5593 g橙黄色粉末,即化合物1,产率约为93%。熔点为:192 °C。1H NMR (400 MHz, CDCl3)δ7.87 (d,J= 9.2 Hz, 2 H), 7.71 (d,J= 8.8 Hz, 2 H), 7.66 (d,J= 8.8 Hz, 2 H),7.46 (s, 1 H), 6.70 (d,J= 9.2 Hz, 2 H), 3.45 (q,J= 7.2 Hz, 4 H), 1.23 (t,J= 7.2 Hz, 6 H)。13C NMR (100 MHz, CDCl3)δ150.15, 144.64, 140.28, 132.55, 132.35, 125.55, 120.13, 118.83, 118.63, 111.17, 110.74,101.22, 44.57, 12.55。
(3) 测试溶液的配制:用分析天平称取3.0 mg化合物1,将其溶解在10 mL四氢呋喃中,得1 mmol·L−1的溶液,随后,取1 mL该溶液,将其定容至10 mL,得0.1 mmol·L−1的母液,随后取10支比色管并编号,依次按照表1加入不同体积的相应物质,以配制不同水体积分数的待测溶液。
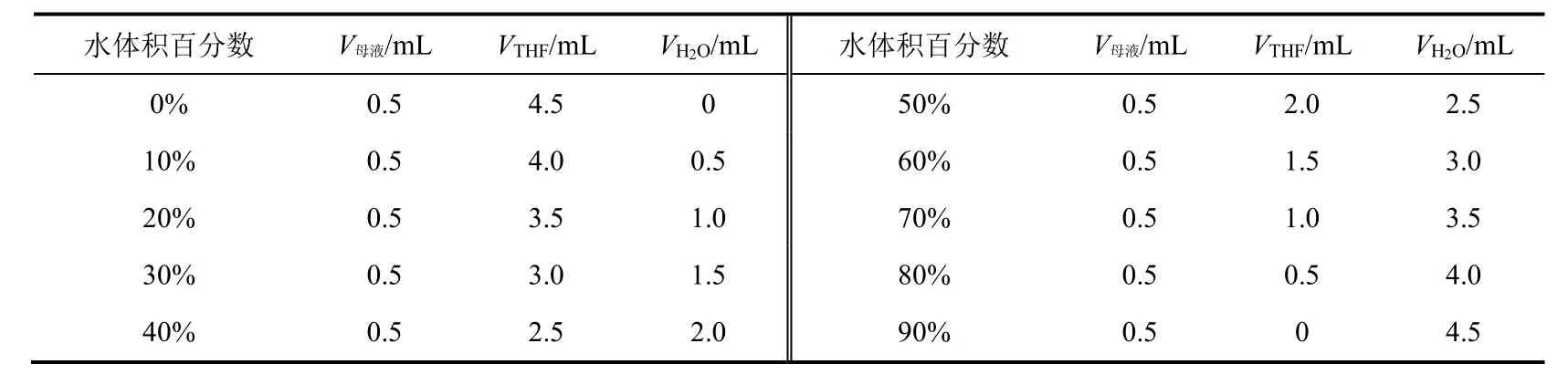
表1 不同水体积分数下化合物1的配制
3 结果与讨论
3.1 1H NMR和13C NMR表征
核磁是验证有机物结构最常用的方法之一。称取10 mg干燥后的产物装入核磁管中,加入0.5 mL氘代氯仿溶解,进行核磁测试,结果如图3、图4所示。通过核磁共振氢谱及碳谱分析,说明我们成功的获得了目标化合物。本部分实验成本预计80元。
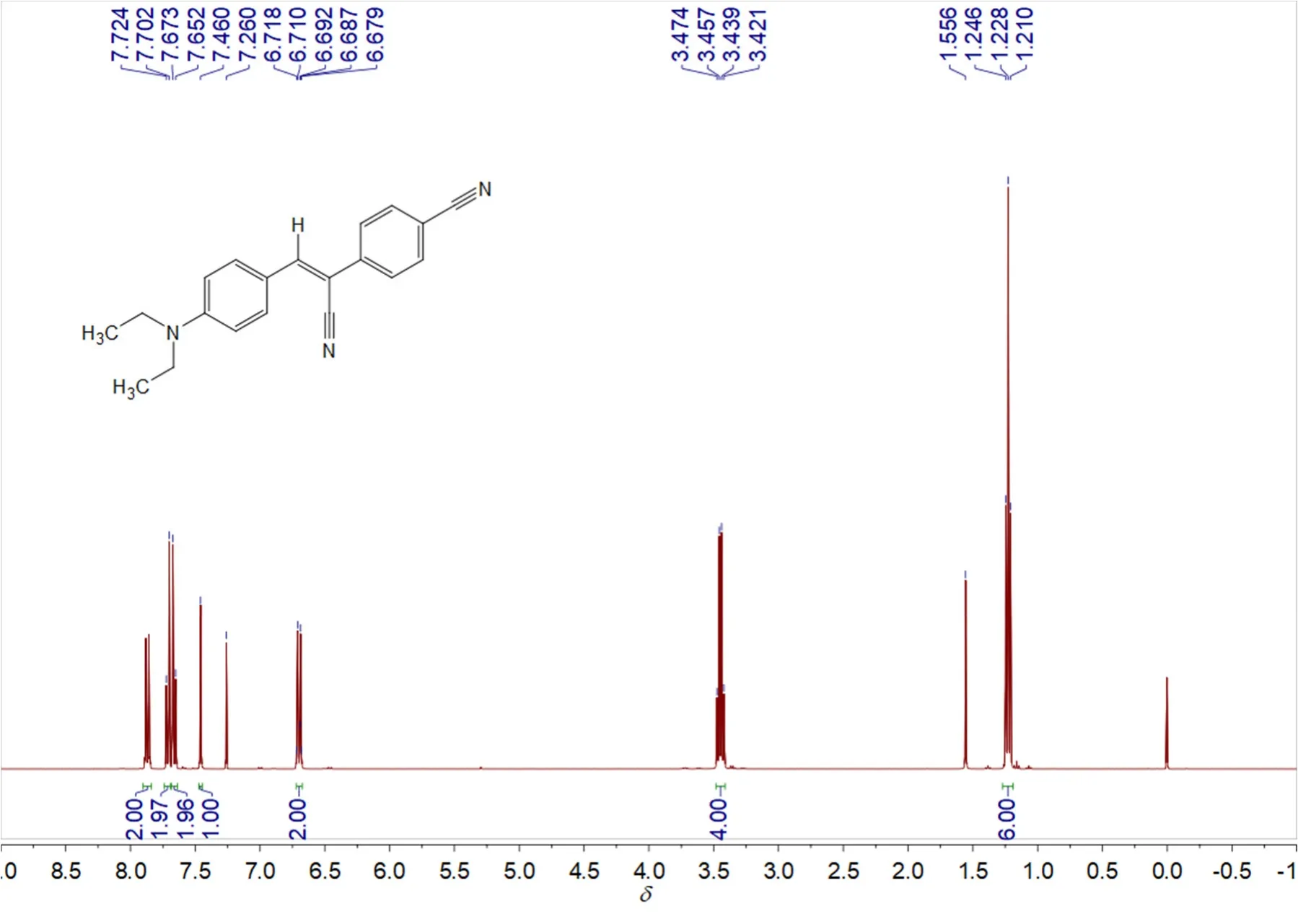
图3 化合物1的1H NMR
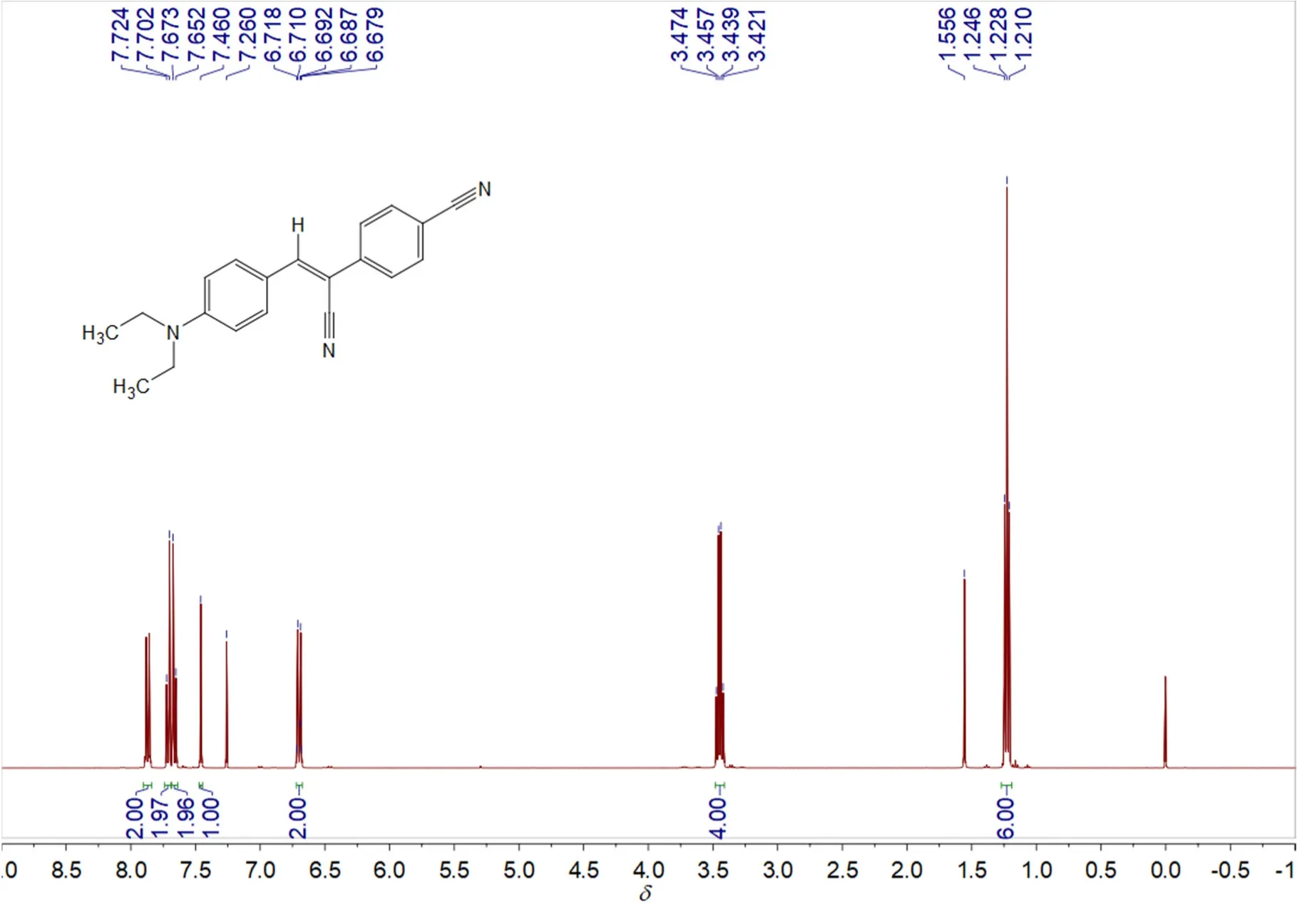
图4 化合物1的13C NMR
3.2 化合物1的光物理性质
为探究化合物1的紫外-可见吸收光谱及AIE特性,我们将化合物1溶解在四氢呋喃(THF)中,按照表1配制不同水体积分数的溶液。随后,以紫外-可见吸收光谱仪及荧光光谱仪收集了其相关数据,结果如图5A所示,由于供体–受体效应,化合物在425 nm出现明显的紫外吸收,这主要是由于分子内电荷转移所致。为验证化合物1的AIE活性,我们收集了其在不同水体积分数下的荧光光谱,结果如图5B、5C所示,在水体积分数由0%增加到90%时,发光波长逐渐红移,这可能是随着水体积分数的增加,溶剂极性逐渐增大,由于溶剂化效应,溶液的发光波长逐渐红移。此外,当水体积分数小于70%时,溶液的荧光发生轻微增强,而当水体积分数大于70%时,其荧光发生明显敏化。在水体积分数达到90%时,化合物1在混合溶液的荧光强度(I)是在纯THF(I0)中的6.6倍。进一步,化合物1在365 nm紫外灯照射下的实物照片(如图5C插图)表明,化合物1在水体积分数为0%时,荧光微弱,而当水体积分数达到90%时,混合溶液发出强烈的黄色荧光。以上结果表明,化合物1具有典型的AIE特性。本部分实验成本预计30元(仪器服务费)。

图5 (A) 化合物1在THF中的紫外吸收光谱;(B) 化合物1在THF和水混合溶剂中,不同水体积分数fw (vol%)下的荧光光谱图;(C) 化合物1在521 nm处,不同水体积分数下的荧光强度(I)与纯THF中的荧光强度(I0)比值
3.3 SEM
为说明水体积分数在90%下荧光曲线与其他荧光曲线不同的原因,我们分别收集了化合物1在水体积分数为70%和90%下的扫描电镜图片。结果如图6所示,在水体积分数为70%时,化合物1主要以无定形颗粒存在,而水体积分数达到90%时,出现明显块状晶体,说明化合物1的形貌与发光波长和强度密切相关。当水体积分数为90%时,荧光曲线出现肩峰,这主要是由于化合物1在水体积分数为90%下形成了微晶,使其发生了分子间相互作用所致。本部分实验成本预计200元。

图6 化合物1在是体积分数分别为70%和90%时的扫描电镜图片
3.4 单晶
为进一步理解结构特点,我们在四氢呋喃和甲醇的体系中,采用挥发法成功获得了化合物1(CCDC号:2284359)的单晶。单晶结果表明(图7),化合物1存在多个分子间氢键(距离分别为2.589、2.940、3.104、3.255和3.373 Å (1 Å = 0.1 nm))。本部分实验成本预计300元。
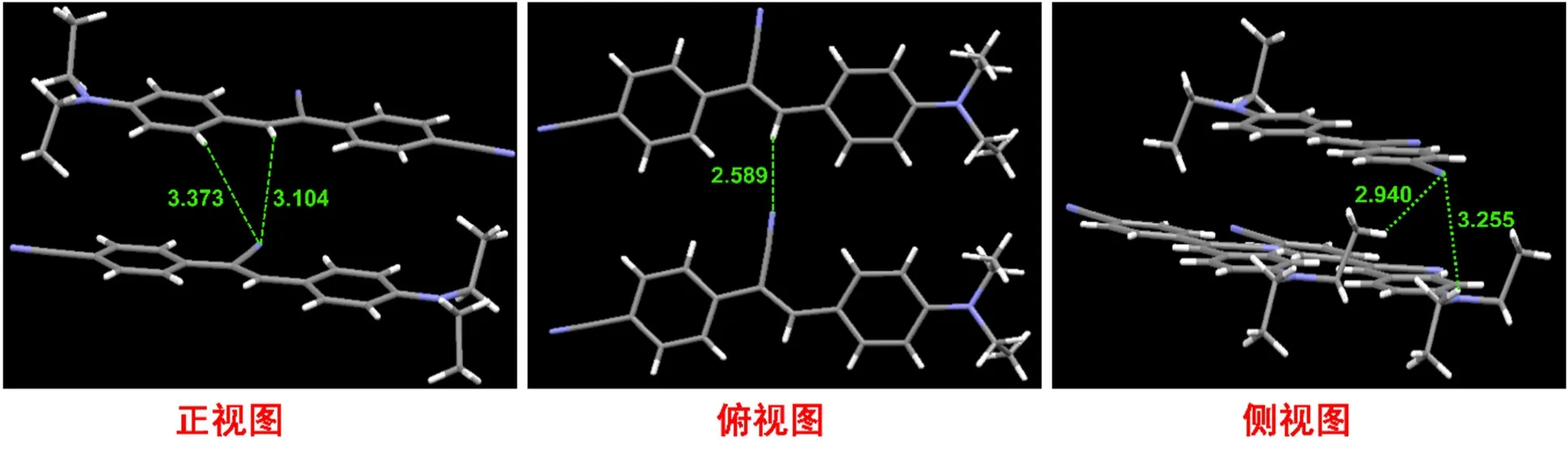
图7 化合物1的单晶结构
3.5 酸碱响应测试
为探究目标化合物的应用,我们将0.0100 g的化合物1用四氢呋喃溶解,并用其浸润薄层层析硅胶板,待溶剂挥发干后,将硅胶板先后放置于盐酸和三乙胺瓶口,分别记录其在可见光和365 nm紫外光照射下的荧光颜色变化(图8)。结果如图8所示,化合物1在可见光和紫外光下时呈现出明显的黄色(图8左),而置于盐酸瓶口时,颜色和荧光均消失(图8中),随后将其放置于三乙胺瓶口,化合物1的可见光下及紫外光下颜色在1 min内均恢复(图8右),说明该化合物具有很好的酸碱响应性能。发生荧光变化的主要原因可能是在酸性情况下,N,N-二乙基的氮原子可以结合氢离子,并形成铵盐,破坏了化合的供体-受体(D-A)作用,导致荧光消失;而在三乙胺熏蒸后,三乙胺可以夺取氢离子,使铵盐恢复为化合物1,从而荧光恢复(图9)。本部分实验成本预计7元(盐酸和三乙胺均按10mL计算)。
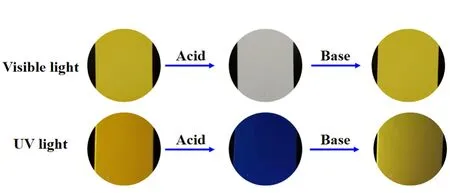
图8 化合物1的酸碱响应性能
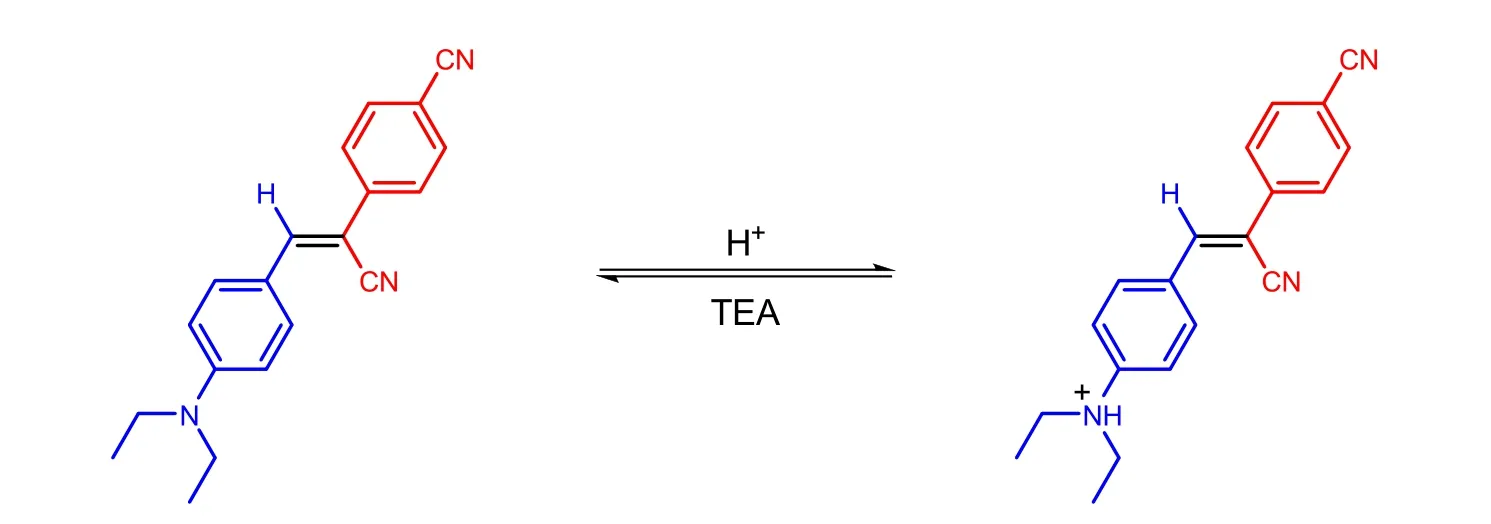
图9 化合物1的酸碱响应机理
3.6 底物普适性研究
为探究不同取代基对该反应及其产物光物理性质的影响,我们分别探索了吸电子基、给电子基、重原子、杂环等因素对该反应及发光性质的影响,结果如图10所示。无论与芳环键连的取代基是吸电子基还是给电子基,目标化合物均能高产率地制备,且目标化合物均具有AIE活性,且具有比较良好的发光效率。此外,我们收集了化合物2–7在可见光(左)和紫外光(右)下的实物照片。为了更清晰地理解其发光光谱,我们收集了化合物在固体下的紫外吸收与荧光发射光谱,结果如图11所示,所制备的化合物发光波长介于蓝光和黄光之间。
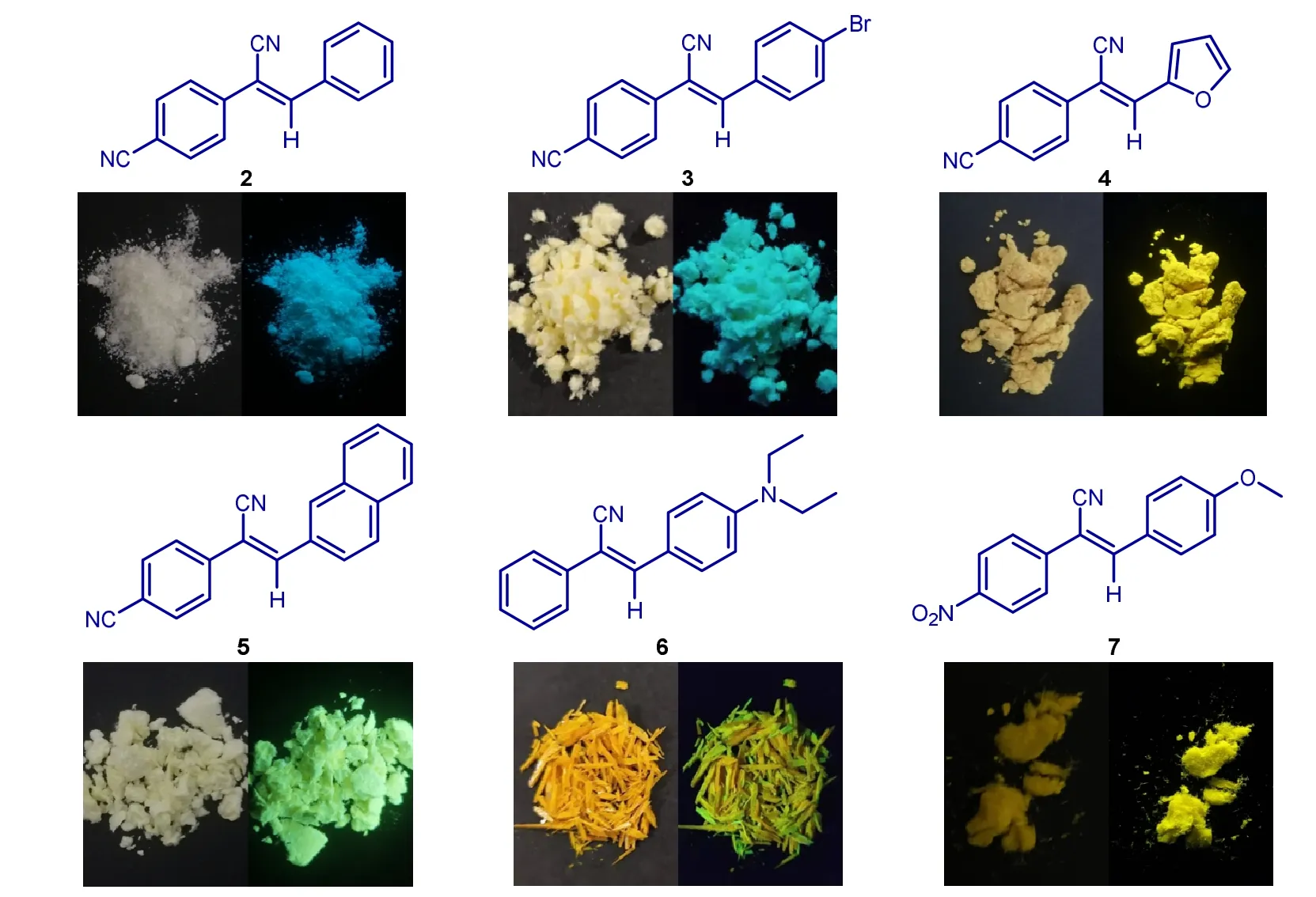
图10 不同取代基对反应及发光的影响,激发波长均为365 nm

图11 不同产物的归一化紫外-可见吸收光谱(虚线)与荧光发射光谱图(实线)
其中化合物2产率约为81%,熔点为:148 °C。在可见光下为白色粉末,紫外照射下发出蓝色荧光。1H NMR (400 MHz, CDCl3)δ7.94–7.91 (m, 2 H), 7.81–7.78 (m, 2 H), 7.76–7.73 (m, 2 H), 7.63 (s, 1 H), 7.51–7.48 (m, 3 H)。13C NMR (100 MHz, CDCl3)δ145.03, 138.94, 133.12, 132.97, 131.68, 129.79,129.31, 126.69, 118.31, 117.28, 112.89, 110.10。
化合物3产率约为92%,熔点为198 °C。在可见光下为浅黄色粉末,紫外照射下发出青色荧光。
1H NMR (400 MHz, CDCl3)δ7.80–7.77 (m, 4 H), 7.76–7.73 (m, 2 H), 7.65–7.61 (m, 2 H), 7.56 (s, 1 H)。13C NMR (100 MHz, CDCl3)δ143.50, 138.58, 133.02, 132.62, 131.94, 131.07, 126.70, 126.21, 118.21,117.03, 113.13, 110.77。
化合物4产率约为80%,熔点为192 °C。在可见光下为黄色粉末,紫外照射下发出强烈的黄色荧光。1H NMR (400 MHz, CDCl3)δ7.76–7.73 (m, 2H), 7.72–7.69 (m, 2H), 7.66 (dd,J= 1.6, 0.4 Hz, 1H),7.47 (s, 1H), 7.29 (d,J= 3.6 Hz, 1H), 6.64–6.61 (m, 1H)。13C NMR (100 MHz, CDCl3)δ149.78, 146.2,138.21, 132.96, 130.22, 126.16, 118.34, 117.4, 117.04, 113.4, 112.51, 105.7。
化合物5产率约为94%,熔点为188 °C。在可见光下为淡黄色粉末,紫外照射下具有明显的黄绿色荧光。1H NMR (400 MHz, CDCl3)δ8.33 (s, 1 H), 8.12–8.10 (dd,J= 8.8, 2.0 Hz, 1 H), 7.95–7.92 (d,J= 9.2 Hz, 2 H), 7.89–7.87 (m, 1 H), 7.84–7.81 (m, 2 H), 7.77 (s, 1 H), 7.76–7.73 (m, 2 H), 7.62–7.54 (m, 2 H)。13C NMR (100 MHz, CDCl3)δ144.97, 139.07, 134.69, 133.15, 132.96, 131.57, 130.63, 129.15, 129.09,128.41, 127.98, 127.23, 126.65, 125.19, 118.34, 117.50, 112.80, 109.87。
化合物6产率约为80%,熔点为95 °C。可见光下为黄色针状固体,紫外照射下呈现出较弱的黄绿色荧光。1H NMR (400 MHz, CDCl3)δ= 7.85 (d,J= 9.2 Hz, 2 H), 7.65–7.62 (m, 2 H), 7.43–7.40 (m, 3 H), 7.33–7.29 (m, 1 H), 6.70 (d,J= 9.2 Hz, 2 H), 3.43 (q,J= 7.2 Hz, 4 H), 1.22 (t,J= 8.2 Hz 6 H)。13C NMR (100 MHz, CDCl3)δ149.50, 142.65, 135.85, 131.74, 128.98, 127.93, 125.53, 120.99, 119.72, 111.24,103.90, 44.64, 12.74。
化合物7产率约为97%,熔点为168 °C。可见光下为黄色粉末,紫外照射下呈现强烈的黄色荧光。1H NMR (400 MHz, CDCl3)δ8.28 (d,J= 8.8 Hz, 2 H), 7.94 (d,J= 8.8 Hz, 2 H), 7.81 (d,J= 8.8 Hz, 2 H),7.60 (s, 1 H), 7.01 (d,J= 8.8 Hz, 2 H), 3.89 (s, 3 H)。13C NMR (100 MHz, CDCl3)δ162.56, 147.66, 145.14,141.23, 132.07, 126.47, 125.83, 124.44, 117.85, 114.80, 106.33, 55.68。
合成上述化合物的实验成本分别为:化合物2:12元;化合物3:11.9元;化合物4:11.6元;化合物5:11.7元;化合物6:7元;化合物7:9.3元。
4 结语
本实验通过经典的Knoevenagel缩合反应将商业可得的芳香醛与苯乙腈衍生物反应,制备了典型的AIE型丙烯腈衍生物。对化合物结构和荧光性能的研究,使学生对Knoevenagel缩合反应机理和AIE现象有直观的认识,激发学生对有机化学、有机实验、AIE类化合物的学习兴趣。该实验还可让学生将书本知识灵活运用于实际操作中,提高学生实验操作技能。此外该实验具有反应时间快、产率高等特点,可收到较为良好的课堂效果,可以作为4学时的本科生综合实验对其进行推广。进一步,将经典有机人名反应——Knoevenagel缩合反应与我国科学家首次提出且在全球范围内被广泛研究的前沿科学领域之一——AIE相结合,不仅可以促进学生了解AIE的发展史,而且还可以增强学生民族自信心,提升责任感与使命感,有利于有机化学、有机实验课程思政建设。

