肝癌消融术后局部复发与早期复发危险因素的Meta 分析
李妹玲
(重庆医科大学附属永川医院放射科,重庆 402160)
肝细胞癌(hepatocellular carcinoma,HCC)是我国癌症相关死亡的第二大原因,对于早期HCC,手术切除和消融术已成为主要治疗方法。目前,临床对早期肝癌患者可以选择消融术(RFA)治疗,以缓解患者症状,提高生活质量[1,2]。然而,有研究表明消融术后有较高的复发风险[3]。肝癌复发指影像学或病理学发现的肝内复发、远处转移或因肝癌所致的死亡,首次RFA 治疗后12 个月内的HCC复发被定义为早期复发[4];若原消融病灶出现对比剂增强、体积增大或与原始病灶相连的新病灶定义为肿瘤局部复发(local tumor progression,LTP)[5]。因此,分析潜在的早期及局部复发因素尤为重要。本文就肝癌消融术后早期复发及局部复发的临床与影像学危险因素进行Meta 分析,以期为临床提供早期预测指标,监测肝癌复发,指导临床诊疗工作。
1 资料与方法
1.1 纳入与排除标准 纳入标准:①研究类型:病例对照和队列研究;②研究对象:肝癌(转移瘤除外)射频和微波消融术后患者;③暴露因素:可能导致肝癌消融术后复发的临床及影像学危险因素;④结局指标:经临床或影像学确诊为肝癌消融术后局部复发及早期复发。排除标准:①重复发表的研究、综述、Meta 分析;②非中、英文文献;③研究内容不吻合、无法获取全文、质量差的文献;④缺原始数据,无法进行Meta 分析。
1.2 文献检索 计算机检索CNKI、WanFang Data、VIP、Web of science、PubMed、EMbase、SinoMed、The Cochrane Library 数据库,搜集有关肝癌消融术后复发影响因素的文献,检索时限均为建库至2022 年5月。同时检索纳入文献的参考文献,以补充获取相关资料。中文检索词包括:肝肿瘤、肝癌、肝恶性肿瘤、原发性肝细胞癌、肝脏恶性肿瘤、肝细胞癌、肝腺癌、消融术、射频、消融、Rfa、rfca、RFTA、危险因素、影响因素、相关因素、病因、病例对照研究、病例对照、队列研究、回顾性研究。英文检索词包括:Liver Neoplasms、Neoplasms、Hepatic、Neoplasms,Liver、Liver Neoplasm、Neoplasm,Liver、Hepatic Neoplasms、Hepatic Neoplasm、Neoplasm,Hepatic、Cancer of Liver、Hepatocellular Cancer、Cancers、Hepatocellular、Hepatocellular Cancers、Radiofrequency Ablation、Ablation、Radiofrequency、Radio Frequency Ablation、Ablation、Radio Frequency、Radio-Frequency Ablation、Ablation、Radio-Frequency 等。
1.3 文献筛选与资料提取 由2 名研究者独立进行文献筛选、数据提取,如有分歧,则通过讨论或与第3 方协商解决。根据文献题目和摘要对所有检索到的文献进行初步筛选,进一步阅读全文以确定是否纳入。资料提取内容包括:第一作者、文献发表年份、研究地区、病例数、肝癌纳入标准、平均年龄、平均随访时间、肝癌消融术后复发危险因素和具体数据等。
1.4 纳入研究的偏倚风险评价 由2 名研究者独立评价纳入研究的偏倚风险,并交叉核对结果。病例-对照研究和队列研究的偏倚风险评价采用纽卡斯尔-渥太华量表(New Castle-Ottawa Scale,NOS)[6],NOS 由3 个维度8 个条目组成,满分为9 分。评价内容包括研究人群选择4 个条目(4 分)、组间可比性1 个条目(2 分)、结果/暴露因素测量3 个条目(3分),总分越高文献质量越好。
1.5 统计学方法 采用RevMan 5.3 软件进行统计分析,采用相对危险度(relative risk,RR)、风险比(hazard ratio,HR)和比值比(odd ratio,OR)为效应量分析统计,并提供其95%CI。采用χ2检验对各研究间异质性进行分析,若各研究结果间无统计学异质性(I2≤50%,P≥0.05),则采用固定效应模型进行Meta 分析,若各研究结果间存在统计学异质性(I2>50%,P<0.05),则行敏感性分析异质性来源,在排除明显临床异质性的影响后,采用随机效应模型进行Meta 分析,明显的异质性只行描述性分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选流程及结果 初检共获得相关文献1729 篇,经逐层筛选,最终获得22 个研究[1,2,4,5,7-23,32],其中15 篇研究的是肝癌消融术后局部复发影响因素,7 篇研究的是肝癌消融术后早期复发影响因素。文献筛选流程及结果见图1。

图1 文献检索流程及结果
2.2 文献基本特征及偏倚风险评价结果 以至少2 篇文献研究同一影响因素为标准,进行数据提取。为减少异质性,对于研究局部复发因素的文献统一了纳入标准,14 篇以研究小肝癌(≤5 cm)为主,删除了1篇研究大肝癌(>5 cm)的文献[2],对于研究早期复发因素的6 篇文献均定义的为消融术后1 年内复发,删除了1 篇定义早期复发为术后2 年的文献[32],最终20 篇纳入研究,其中选择射频消融术17 篇,微波消融3 篇,队列研究共8 篇,病例-对照研究共12 篇;最终确定分析局部复发危险因素包括:肿瘤大小;靠近大血管;靠近横膈膜;消融安全边界不足;ADC 图低信号;研究早期复发危险因素包括:肿瘤大小;AFP>400 ng/ml;多发肿瘤(≥2 个);ALB≤35 g/L。纳入的所有文献质量评价均为6 分及以上,纳入研究的基本特征及偏倚风险评价结果见表1、表2。

表1 纳入局部复发研究的基本特征及偏倚风险评价
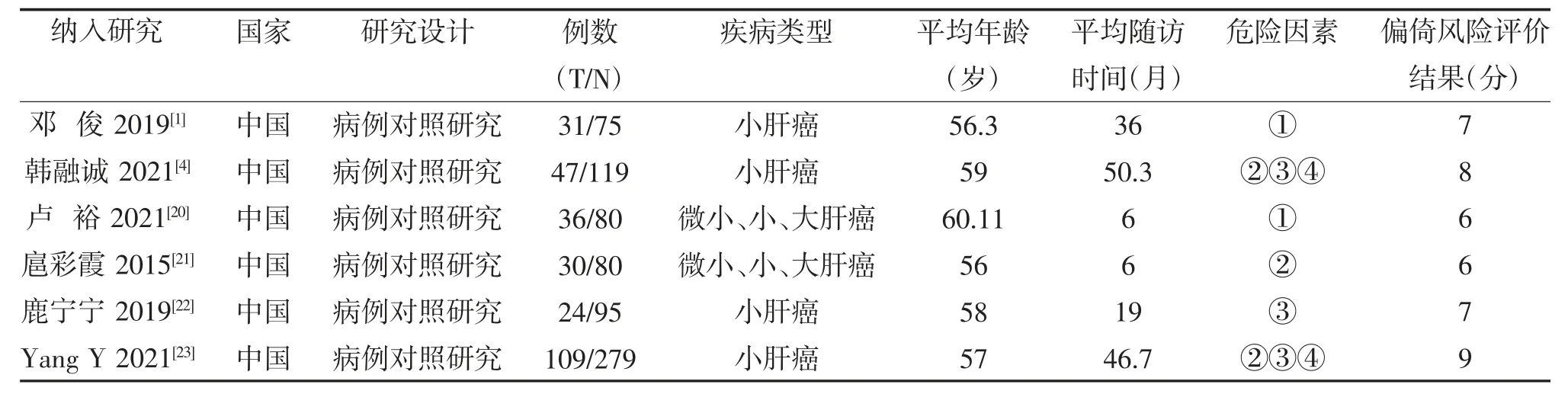
表2 纳入早期复发研究的基本特征及偏倚风险评价
2.3 Meta 分析结果
2.3.1 局部复发危险因素 肿瘤大小:纳入5 篇队列研究[7-9,11,13],异质性检验结果显示各研究之间无异质性(P=0.77,I2=0),故采用固定效应模型进行Meta分析,结果显示肿瘤>2 cm 者消融术后局部复发的风险高于微小肝癌者,差异有统计学意义(RR=1.92,95%CI:1.54~2.38,P<0.000 01),见图2。

图2 肿瘤>2 cm 与肝癌消融术后局部复发关系的森林图
肿瘤特殊位置:纳入3 篇队列研究[7,9,11],均研究的是肿瘤位置靠近大血管,1 篇定义的是当HCC 至少与门静脉、下腔静脉、肝主静脉或其它主要分支血管(>3 mm)接触;1 篇研究的是肿瘤靠近门静脉;1 篇分别研究了肿瘤靠近门静脉主干及肝静脉,基于以上4 组数据,异质性检验结果显示,各研究之间无异质性(P=0.67,I2=0),故采用固定效应模型进行Meta 分析,结果显示肿瘤位置靠近大血管者消融术后局部复发的风险增高(RR=2.36,95%CI:1.79~3.11,P<0.000 01),见图3。

图3 肿瘤靠近大血管与肝癌消融术后局部复发关系的森林图(队列研究)
纳入4 篇病例对照研究[5,16,18,19],其中3 篇研究的是肿瘤靠近大血管[5,16,19],异质性检验结果显示各研究之间无异质性(P=0.41,I2=0),故采用固定效应模型进行Meta 分析,结果显示肿瘤靠近大血管是消融术后局部复发危险因素(OR=4.25,95%CI:2.40~7.54,P<0.000 01),见图4。1 篇[18]研究的是肿瘤位于特殊区域(靠近膈肌、胆囊、肝包膜、大血管)是局部复发的危险因素,仅作阐述。
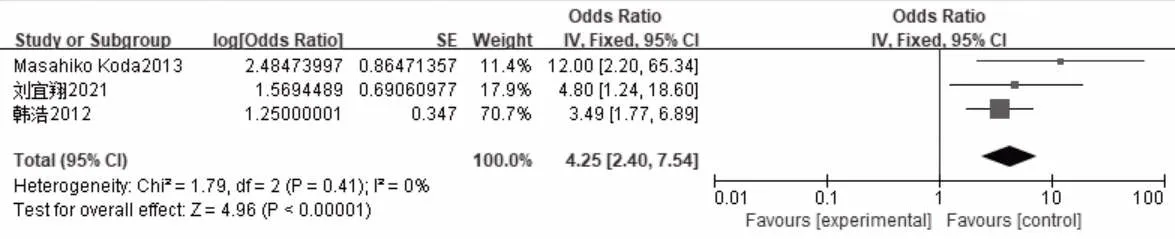
图4 肿瘤靠近大血管与肝癌消融术后局部复发关系的森林图(对照研究)
纳入2 篇队列研究[7,9],均研究的是肿瘤位置接近横膈膜,异质性检验结果显示各研究之间无异质性(P=0.49,I2=0),故采用固定效应模型进行Meta 分析,结果显示肿瘤位置靠近横膈膜术后局部复发的风险增高(RR=2.50,95%CI:1.61~3.87,P<0.0001),见图5。
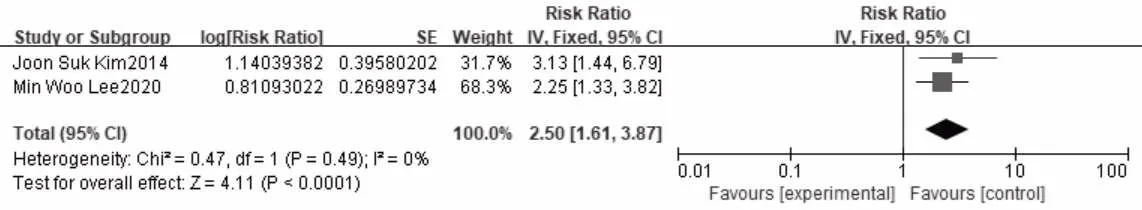
图5 肿瘤靠近横膈膜与肝癌消融术后局部复发关系的森林图
消融安全边界不足:纳入2 篇队列研究[10,11],其中1 篇研究的是消融安全边界<5 mm 是危险因素,1 篇研究的是消融安全边界<3 mm,无法合并,仅作阐述;纳入3 篇病例对照研究[15,17,18],各研究之间异质性极强(I2=96%),1 篇[18]研究的是无消融安全边界是危险因素,未具体说明数值,另外2 篇研究的是消融安全边界<5 mm,这2 篇研究之间的异质性较强(I2=77%),因此无法合并分析,仅作阐述。
其它因素:纳入2 篇队列研究[12,14],研究得出术前ADC 图低信号为危险因素,2 篇研究至今异质性极强(I2=93%),无法合并分析,仅作阐述。
2.3.2 早期复发(术后1 年内)危险因素 肿瘤数量:纳入4 篇病例对照[4,21-23],研究多发肿瘤(≥2 个)为早期复发危险因素,各研究之间存在明显异质性(I2=87%),因此进行敏感性分析减少异质性。分析得出扈彩霞等[21]的研究文献是造成异质性的主要原因,删除后,对剩余3 篇[4,22,23]再次进行Meta 分析,异质性检验显示各研究之间无异质性(P=0.42,I2=0%),故采用固定效应模型进行Meta 分析,结果显示消融术后早期复发组多发肿瘤比例高于无复发组,差异有统计学意义(OR=4.02,95%CI:2.25~7.17,P<0.000 01),见图6。

图6 肿瘤数量与肝癌消融术后早期复发关系的森林图
其它因素纳入2 篇病例对照研究[1,20],分别研究的是肿瘤>3 cm 和肿瘤>5 cm 为早期复发危险因素,不进行Meta 分析,仅作阐述;纳入2 篇病例对照研究[4,23],均研究得出AFP>400 ng/ml 为危险因素,异质性检验显示各研究间异质性较大(P=0.15,I2=52%),故采用随机效应模型进行Meta 分析,结果显示AFP >400 ng/ml 者早期复发风险增高(OR=4.19,95%CI:1.47~11.93,P=0.007),见图7。纳入2篇病例对照研究[4,23],均研究得出ALB≤35 g/L 为危险因素,异质性检验显示各研究之间无异质性(P=0.64,I2=0),故采用固定效应模型进行Meta 分析,结果显示ALB≤35 g/L 者早期复发风险增高(OR=0.36,95%CI:0.16~0.79,P=0.01),见图8。

图7 AFP>400 ng/ml 与肝癌消融术后早期复发关系的森林图

图8 ALB≤35 g/L 与肝癌消融术后早期复发关系的森林图
3 讨论
3.1 局部复发 与其他类型的肿瘤复发相比,LTP 与消融技术直接相关,消融成功需要彻底消灭存活的肿瘤细胞[9]。消融后局部复发的准确风险分层对于个体化治疗决策至关重要。本研究发现局部复发主要危险因素包括肿瘤直径>2 cm、肿瘤靠近大血管、肿瘤靠近横膈,其它危险因素包括消融安全边界不足、ADC 图低信号,即肝癌大小和高风险位置直接影响消融术后局部复发,因较大肿瘤消融后残留增殖和存活的肿瘤细胞可能性更大,且肿瘤大小与显微血管侵犯的发生率相关[24]。当肿瘤位于大血管附近时,由于“热沉效应”,射频消融的效果可能会降低,即热能从肿瘤流失到血流中。但是也有部分学者[25]研究发现肿瘤靠近大血管不会显著影响消融疗效,与本Meta 分析结果不符,可能因为界定的范围不同,其定义的靠近大血管不是紧贴血管。可见,肿瘤离大血管越近,消融疗效越差。
另外,当肿瘤位于膈肌或者腹部其它脏器附近时,消融技术更具难度,因为较难获得足够的消融边缘,特殊部位的肿瘤也容易出现肝包膜下出血、血气胸、胆汁瘤以及胃肠道甚至心脏损伤等并发症[26]。对膈肌、肝包膜下的肿瘤或邻近胆囊、胃肠道等重要脏器的高风险位置肿瘤需制定个体化治疗方案[7]。本Meta 研究分析也发现,消融边缘不足(AM)是消融后LTP 的一个重要危险因素[15,17,18],充足的消融边缘是为了消除潜在的瘤周卫星结节和微血管侵犯,是治愈HCC 所必需的。虽然肝脏肿瘤消融通常采用0.5~1.0 cm 的消融边缘[27],但是目前尚缺乏标准化的AM 测量方法[8],可能导致部分研究异质性大。
Hu Z 等[14]发现基于MRI 表现(包括边缘增强和ADC 值)的初步预测模型可用于术前评估RFA 治疗后发生LTP 的风险。有学者[28]研究发现,肝细胞癌射频消融术后短期侵袭性复发与病灶ADC 值呈正相关,与本次研究均相符,即肝癌ADC 图上的信号强度与其预后密切相关。因HCC 的ADC 值与组织学分级有关,随着HCC 组织学分级的增加,HCC 的细胞异型性,包括有丝分裂活性和核/细胞质比率的增加,这可能会减少水分子在细胞内空间的扩散,并进一步导致ADC 值降低。因此即使是小肝癌,当其在ADC 图上信号很低时,在治疗策略的选择上也应谨慎对待。
3.2 早期复发 复发可分为早期复发和晚期复发,大多数研究定义的早期复发时间为消融术后12 月内,有研究[4]根据射频消融患者复发后PRS(复发后生存率)的差异,采用最小P 值法来定义早期复发和晚期复发,结果显示射频消融后12 个月是区分肝癌消融后早期复发与晚期复发的最佳界值,晚期复发的患者有更好的生存率。区分早期复发和晚期复发对于疾病的预测、治疗计划和监测策略非常重要,因为两者的病理生理机制和风险因素是不同的[23]。本研究发现早期复发的危险因素主要包括肿瘤数≥2个、甲胎蛋白AFP>400 ng/ml、ALB≤35 g/L;说明肿瘤高侵袭性与高肿瘤负荷与早期复发相关,这支持了早期复发可能是原发肿瘤微转移的假设[29]。
多发肿瘤是HCC 消融后早期复发的独立影响因素,因多个肿瘤增加了消融的难度[8],且提示高肿瘤负荷和侵袭性,并可能会通过门静脉转移到其他器官,导致复发风险增加[30]。高AFP 水平与高血管侵袭率、包膜侵犯、低分化有关,高AFP 水平不仅提示射频消融后早期复发风险高,而且长期预后不佳,治疗效果差[23,31]。早期复发很可能是原发肿瘤隐匿性转移的结果,存在早期复发的危险因素提示肿瘤的侵袭性较高。本研究也发现低ALB 水平与射频消融治疗后早期复发有关;因ALB 是反映肝脏合成功能的重要指标,肝癌的发生或复发与慢性肝炎环境下肝细胞反复的破坏和再生有关,这一过程导致肝细胞合成ALB 的水平不断下降[4]。因此,存在这些危险因素的肝癌患者应接受严格的监测和辅助治疗。
综上所述,对于HCC 患者,消融术是一种较好的治疗选择。肝癌消融术后局部复发与早期复发危险因素有所不同,熟悉相关危险因素,有助于消融术作为一线治疗的HCC 患者术后个体风险分层;复发往往是多种因素相互作用的结果,术前术后评估需综合多方面因素,对于肿瘤数量多、直径大、高风险位置、肿瘤标志物高、结合影像学高危征象,可行联合治疗,以减少肝癌术后复发率。目前,预测肝癌消融术后疗效及复发风险还需要大样本和多中心前瞻性研究;有复发风险的患者应密切监测,并提供早期干预以改善预后。

