小熊猫紫色色杆菌PCR检测方法的建立及应用
刘 蓓,罗伟铭,王隆柏,徐素慧,周伦江,林 琳,何晓聪,修云芳*
(1.海峡(福州)大熊猫研究交流中心,福建福州 350025;2.福建省农业科学院畜牧兽医研究所,福建福州 350013)
紫色色杆菌(Chromobacteriumviolaceum)是一种兼性厌氧革兰氏阴性菌,主要存活于热带和亚热带地区水和土壤中,适宜生长温度为30~35℃,菌落呈中等大小、圆形、光滑湿润的紫罗兰色,但有粗糙及无色变种[1]。紫色色杆菌是一种条件致病菌,虽然人类和动物感染较为少见,但一旦感染,病情进展迅速,常引起败血症和肝、肺等内脏脓肿,如不及时诊断治疗,结果往往是致命的[2]。2020年7月因饲养环境变动,海峡(福州)大熊猫研究交流中心有6只小熊猫感染该菌,病情发展迅速,以呼吸衰竭为主要特征,来不及诊断和治疗就已发展为败血症而亡[3]。2021年8月南京紫清湖野生动物世界有6只小熊猫因打斗出现外伤后感染紫色色杆菌,最终有5只脏器衰竭死亡,经细菌分离鉴定确定病因后及时调整治疗方案,成功治愈1只[4]。因此,建立快速有效的检测方法,能够对紫色色杆菌病早期诊断,及时采取治疗措施,控制该疫病的进一步发展。
目前,对于致病菌检测主要为分子生物学和免疫学等方法,分子生物学技术尤其是PCR技术简单快速、特异性强、灵敏度高,在疾病检测方面有十分重要的地位[5]。本试验用常规PCR技术,设计出紫色色杆菌的特异性引物,扩增出相应的目的片段,成功建立起小熊猫紫色色杆菌的PCR检测方法,为防控小熊猫紫色色杆菌病疫情的发生奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及病料 紫色色杆菌菌株(CV20)为2020年因紫色色杆菌病死亡的小熊猫体内分离[3],紫色色杆菌模式株ATCC 12472购自广东省微生物菌种保藏中心;其他非目标菌株为小熊猫饲养场所收集到的常见环境菌和从死亡小熊猫体内分离到的其他病菌,与2020年因紫色色杆菌病死亡的小熊猫病料一起保存于福建省农科院畜牧兽医研究所。
1.1.2 试剂 细菌DNA提取试剂盒、土壤DNA小提试剂盒、水体DNA小提试剂盒,广州美基生物科技有限公司产品;琼脂糖凝胶DNA回收试剂盒,天根生化科技(北京)有限公司产品;血琼脂平板,广东环凯微生物科技有限公司产品;GoTaq®Green Master Mix,普洛麦格(北京)生物技术有限公司产品;DNA Marker DL 2 000、核酸染料、琼脂糖,北京全式金生物科技有限公司产品;微孔滤膜,上海半岛实业有限公司产品。
1.1.3 主要仪器 隔水式恒温培养箱(GNP-9070),上海精宏实验设备有限公司产品;梯度PCR仪(VeritiPro),赛默飞世尔科技公司产品;核酸电泳仪(DYY-6C),北京六一生物科技有限公司产品;凝胶成像仪(G:BOX),Syngene公司产品;微量紫外分光光度计(Nanodrop 2000),赛默飞世尔科技公司产品。
1.2 方法
1.2.1 DNA提取 取出保存的CV20菌种于37℃水浴解冻,划线接种于血琼脂平板,恒温培养箱培养24 h后取出,挑取单菌落接种于TSB液体培养基,置于恒温摇床过夜培养。取出培养好的菌液3 000 r/min离心10 min,弃上清,取其沉淀用生理盐水洗涤3次后按照细菌DNA提取试剂盒说明书提取DNA,用微量分光光度计测量其浓度,重复测定3次,计算取其平均值,分装后保存于-20℃备用。紫色色杆菌模式株及其他杂菌接种于血琼脂平板,恒温培养箱过夜培养,挑取几个菌落于无菌水中混匀,沸水中煮10 min,12 000 r/min离心5 min,取上清保存于-20℃备用。
1.2.2 引物设计 根据与紫色色杆菌毒力相关的Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)效应因子OspC家族蛋白的基因序列(RefSeq:GCF-000007705.1,selected region:from 2221396 to 2222859)[6-7],应用Primer Premier 5.0软件设计特异性引物,用NCBI的Blast检验引物特异性后,筛选出的引物上、下游序列分别为5′-ATTTCCGCCACCAGTCCAAT-3′和5′-GATCGGTCAGCGTCAGGTAG-3′,可扩增的片段长度约291 bp,引物由福州尚亚生物技术有限公司合成。
1.2.3 PCR反应条件优化 根据Promega的GoTaq®Green master mix使用说明,初步建立PCR反应体系:2×GoTaq®Green master mix 12.5 μL,上、下引物(10 μmol/L)各1 μL,DNA模板1 μL,加无核酸酶水至25 μL。在冰盒上将该反应体系各成分加入到离心管中并混匀。
反应程序:95℃ 5 min;95℃ 30 s,退火温度50℃、52℃、54℃、56℃、58℃、60.0℃、62℃、64℃、66℃,9个梯度30 s,72℃延伸40 s,循环次数设25、30、35、40、45次5个梯度;最后72℃延伸10 min,4℃保存结束反应。
反应结束后,取5 μL PCR扩增产物用添加了核酸染料的1.2%琼脂糖凝胶进行电泳检测,DNA Marker DL 2 000作为对照,120 V电压下电泳20 min,凝胶成像系统下紫外观察,并拍照保存。
1.2.4 特异性试验 紫色色杆菌模式株ATCC 12472作为阳性对照,无核酸酶水作为阴性对照,以小熊猫饲养场所和从死亡小熊猫体内分离到的醋酸钙不动杆菌、粪肠球菌、停乳链球菌、葡萄球菌、奇异变形杆菌、大肠埃希氏菌、魏斯氏乳酸菌、嗜水气单胞菌、霍氏肠杆菌、微小杆菌、吉氏库特菌、蜡样芽孢杆菌和苏云金芽孢杆菌这13株菌作为特异性对照,在之前已建立的最佳反应体系下,对小熊猫紫色色杆菌CV20进行特异性检测。
1.2.5 灵敏度及其重复性 将CV20的DNA样本用无菌水进行10倍梯度稀释(10-1~10-10),稀释好的DNA溶液保存在-20℃备用。用无核酸酶水作为阴性对照,在已建立的最佳反应程序下,对不同浓度的DNA样本进行PCR扩增,1.2%琼脂糖凝胶电泳检测,检验引物的灵敏度。根据灵敏度试验所能检测到的最低样本浓度稀释10份CV20样品,在最佳反应程序下进行PCR扩增,1.2%琼脂糖凝胶电泳检测,观察灵敏度在最低检测浓度下是否稳定。
1.2.6 环境样本检测 采集小熊猫兽舍内部3处水源和3个排水口的水样,在兽舍外围随机选取4处采集土壤样品,这10处采集的样品分别使用两种不同的方法进行检测,即分离培养法和直接PCR检测法。
①分离培养法:每份水样取100 mL加入80 μL灭菌后的10%硫代硫酸钠溶液[8],以中和水样中可能存在的氯气及其他氧化性杀菌剂;每份土壤样品取10 g,加入到90 mL无菌水中混匀,将其悬浮液吸出。处理后的水样和土壤悬浮液均以倍比稀释法进行梯度稀释,取3个适宜浓度的稀释液,各吸取100 μL均匀涂布于血琼脂平板上,重复两次。于恒温培养箱过夜培养后,挑取平板上形态类似紫色色杆菌及其无色株的单菌落进行分离纯化。纯化后的菌株以1.2.1中水煮法提取模板进行PCR扩增,紫色色杆菌模式株作为阳性对照,无核酸酶水作阴性对照,电泳检测。同时对分离纯化的菌落作革兰氏染色镜检和生化试验鉴定,判定其结果。
②直接PCR检测法:用0.45 μm滤膜过滤水样,之后用无菌镊子取下滤膜,剪碎放入离心管中,按照水体DNA小提试剂盒的说明书提取DNA;土壤样品按照土壤DNA小提试剂盒说明书提取DNA。提取的DNA样品根据已建立的PCR体系进行扩增和电泳检测。
1.2.7 病料检验 取保存于-70℃的2020年因紫色色杆菌病死亡的小熊猫病料,剪取部分组织样品,加入生理盐水充分匀浆,按照细菌DNA提取试剂盒说明书从组织样品中提取细菌DNA,以优化后的条件对其进行PCR扩增和凝胶电泳检测。
2 结果
2.1 PCR扩增的优化结果
以相同的DNA样本为模板,设定退火温度在50~66℃之间,重复试验3次(图1),50~62℃条带均较为明亮,最终选取58℃为最佳退火温度。在最佳退火温度条件下,分别进行25、30、35、40、45个循环的PCR扩增,重复试验3次。从图2可以看出,5个循环次数时均可扩增出明亮的条带,而以40和45个循环时扩增出的条带最为清晰,为减少非特异性条带的产生,本试验选取次数较少的40个循环设定为PCR反应的最佳循环参数。最终确定反应程序为:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 40 s,40个循环;72℃延伸10 min。

M.DNA 标准DL 2 000;1.50℃;2.52℃;3.54℃;4.56℃;5.58℃;6.60℃;7.62℃;8.64℃;9.66℃
2.2 特异性试验结果
13个非目标菌株和阴性对照均未扩增出条带,仅有CV20和紫色色杆菌模式株可扩增出清晰明亮的条带,大小与预期(291 bp)相符(图3),用胶回收试剂盒回收该PCR产物,并送至铂尚生物技术有限公司测序,结果在GenBank上Blast确定为紫色色杆菌,由此可见该引物对小熊猫紫色色杆菌的特异性较强。

M.DNA标准DL 2 000;1.紫色色杆菌菌株;P.阳性对照;N.阴性对照;2.醋酸钙不动杆菌;3.粪肠球菌;4.停乳链球菌;5.金黄色葡萄球菌;6.奇异变形杆菌;7.大肠埃希氏菌;8.魏斯氏乳酸菌;9.嗜水气单胞菌;10.霍氏肠杆菌;11.微小杆菌;12.吉氏库特菌;13.蜡样芽孢杆菌;14.苏云金芽孢杆菌
2.3 灵敏度及重复性试验结果
用微量紫外分光光度计对CV20的DNA样本浓度进行检测,重复测定3次,其浓度均值为98.4 ng/μL,在已优化的PCR反应条件下,用其进行引物的灵敏度试验。从图4可以看出,阳性样品从100到10-5稀释均可扩增出条带,且条带亮度依次减弱,10-5稀释下条带最弱,而阴性对照无目的条带。因此可知所建立的PCR检测方法,其灵敏度可达到10-5的模板稀释度,对应于原检测样本的浓度为98.4 ng/μL,所以该PCR方法的检测灵敏度为0.98 pg/μL。
因本试验建立的PCR检测方法最低检测浓度为10-5,且条带较弱,为验证其可靠性,取10份CV20的DNA样品稀释到该浓度作为模板,进行最低检测浓度的重复性试验。由图5可见,泳道1~10均可见目的条带,说明该PCR方法重复性良好,其最低检测浓度重复率为100%。
2.4 环境样本的检测
小熊猫饲养场所水源、排水口的水样及兽舍外土壤样本,经处理后分离培养出的菌株进行PCR检测筛查,结果均为阴性,与革兰氏染色和生化鉴定结果一致(图6)。另一份水样和土壤样本直接进行DNA提取和PCR检测(图7),在兽舍外土壤样品中扩增出了条带,大小与目的条带一致,经切胶回收和送样测序后,得到的序列经比对为紫色色杆菌。
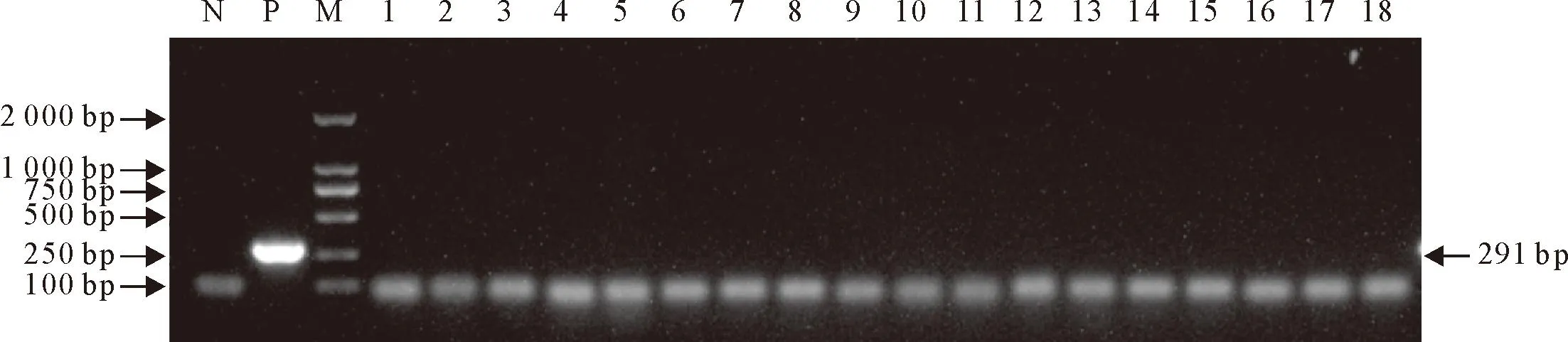
M.DNA标准DL 2 000;N.阴性对照;P.阳性对照;1~12.水样分离菌;13~18.土壤样品分离菌
2.5 小熊猫病料的PCR检验
因保存时间较久,3份病料已无法分离出紫色色杆菌,但提取病料DNA后,均可检测到条带,大小和目的条带一致,经切胶回收和送样测序,比对结果显示均为紫色色杆菌(图8)。
3 讨论
本文所建立的PCR检测方法特异性较强,能准确的扩增紫色色杆菌,与其他常见菌无反应,对目的菌株的最低检测浓度为0.98 pg/μL。本文建立的PCR检测方法可特异性检测小熊猫紫色色杆菌,对小熊猫紫色色杆菌的早期诊断具有重要意义。紫色色杆菌是环境常见菌,多存在于热带和亚热带地区的水和土壤中,且其无色变种与大肠埃希氏菌等常见菌形态相似,传统的分离培养方式较难分辨,多起群体事件表明,紫色色杆菌多通过伤口感染到圈养小熊猫种群,且小熊猫毛发浓密,外伤不易发现,亟需快速准确的早期诊断方法。对于紫色色杆菌病的诊断,临床上常用的实验室诊断方法多为采集血液、尿液或病灶处脓液等进行致病菌的分离培养和生化鉴定[9-12],操作繁琐且检测时间较长,不能快速检测出致病菌;通过穿刺病灶进行分离培养,以通用引物对16S rRNA区域进行测序证实紫色色杆菌,需要时间较长[13];NGS技术不用经过分离培养就可直接测定病原微生物的核酸序列[14],但与PCR技术相比需要更专业的设备和对大量数据的深入分析,成本高不易普及。
本文对2020年保存的小熊猫病料进行了DNA提取和PCR检测,全程只需要数小时就可得到检测结果,如有疑似紫色色杆菌病时,可采集小熊猫的分泌物或血液等样本,用细菌DNA试剂盒从组织/液体样品中提取细菌DNA进行PCR检测,即可进行临床病例的快速诊断,及时采取有效防控措施。因2020年群体感染事件暴发后,海峡(福州)大熊猫研究交流中心对小熊猫兽舍内的不流动水池进行了硬化处理,清除了积水,并进行了全面消毒,加强了饲养管理,此次试验中采集了小熊猫现有饲养环境中的水样和兽舍外土壤样品,经分离培养后用该PCR方法对其进行测定,且与常规生化鉴定方法进行了对比,均未检测到紫色色杆菌;但以水体DNA小提试剂盒和土壤DNA小提试剂盒直接从水样和土壤样品中提取DNA后,从兽舍外土壤样品扩增出了条带,测序鉴定为紫色色杆菌,但此份样品中无法分离出紫色色杆菌,可能是因为检测出的是死亡的紫色色杆菌,或因此时气温较低,紫色色杆菌处于活的非可培养状态(viable but non-culturable state,VBNC),以平板培养法无法进行分离培养,待条件适宜时,可能会复苏具有一定的致病性,在小熊猫个体出现创伤或免疫力低下时,仍有可能对其造成威胁。

