基于转录组学分析PI3K/AKT通路对冷却滩羊肉贮藏期间肌肉代谢稳态的影响
张 倩,杨 波,罗瑞明,胡晓磊,毕永昭,陈雪妍,王金霞,李 荣,胡丽筠
(宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)是磷酸化细胞内磷脂酰肌醇的酶,根据它们的结构可分为3 类:I类PI3K、II类PI3K和III类PI3K[1]。其中,I类PI3K(PI3KI)调节内分泌反应,如细胞内胰岛素和生长因子,并激活蛋白激酶B(protein kinase B,AKT),增强细胞葡萄糖摄取和刺激肌肉细胞合成糖原[2]。另外,AKT也能刺激蛋白质合成并抑制肌肉中蛋白质的降解[3]。由于PI3KI作为营养代谢的关键调控因子,并参与动物和人类的肌肉生理过程,因此它与肌肉稳态和生长之间的关系已有较多的研究。PI3KI在肌肉萎缩中也具有重要作用,特别是与人类疾病相关的高脂血症[4]。最近的研究表明,其他类的PI3K也会影响葡萄糖和蛋白质代谢,并与人体的某些肌肉疾病有关[5-6]。PI3K/AKT信号通路利用多种调节因子调控细胞的生长、增殖以及代谢等生物过程维持细胞和生物体的稳态,如胰岛素样生长因子(insulin like growth factor,IGF)[7]。PI3K/AKT信号通过激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)调节葡萄糖稳态、脂质代谢、蛋白质合成等过程,这也受能量状态和营养物的调节。伴随其在刺激蛋白质合成和肌肉生长中的重要合成代谢作用,PI3K/AKT途径也可能在抑制动物的蛋白质降解中发挥作用[8]。
滩羊是宁夏重点特色养殖的经济动物,以其肉质鲜嫩、无膻味、含脂率低、营养含量丰富的独特品质而深受大众喜爱[9]。截止到2021年,宁夏“盐池滩羊”品牌价值已高达88.17亿 元[10]。肌肉纤维内蛋白质合成和降解之间的平衡影响肌肉质量和纤维大小,这两个过程对营养状况和激素平衡等因素都有影响。在脊椎动物中,当蛋白质降解速率大于蛋白质合成速率时,肌肉就会发生萎缩,导致质量下降[11-12]。反之,会发生肥大,导致肌肉质量增加。由于PI3K/AKT信号通路在刺激蛋白质合成和肌肉生长中的重要合成代谢作用,并调控肌肉生长发育、代谢调控及稳态维持等重要生物学过程,在抗肌萎缩蛋白缺陷型肌肉等疾病中均能检测到PI3K/AKT信号通路相关基因的异常表达或蛋白的异常磷酸化[13]。近些年来,人们对PI3K/AKT信号通路的调控和功能有了深入的了解。然而,PI3K/AKT途径仍然很复杂,特别在冷却滩羊肉中,对PI3K/AKT信号通路的功能和代谢稳态动态调节的分子机制仍不清楚。因此,研究冷却贮藏期间滩羊肉中PI3K/AKT信号通路的分子调控机制具有重要的意义。
随着组学技术的兴起,转录组学从RNA层次研究基因表达的情况,探索特定时期下生物体组织或器官的全部基因组转录情况及规律[14]。其中包含微阵列技术、基因表达序列分析、大规模平行测序和高通量测序等转录组测序技术[15]。而高通量测序以其检测通量高、数字信号精确等优势被广泛应用[16-17]。近年来,中国盐池滩羊基因组组装已经完成,并通过大规模全基因组重测序研发出了鉴别技术,为滩羊肉品质改良和产地溯源提供了坚实的技术保障[18-19]。本研究旨在分析经PI3K抑制剂(LY294002)注射处理后冷却滩羊肉贮藏期间转录组的信息,揭示PI3K/AKT信号通路在滩羊肉代谢调控中的作用,有助于研究PI3K/AKT信号通路在冷却滩羊中的复杂功能,为冷却滩羊肉贮藏期间肉品质量控制技术研发提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
滩羊右后腿肉由宁夏盐池县大夏牧场食品有限公司提供。选取9 只体质量相近的6 月龄阉割公滩羊,屠宰前统一管理。依据GB 12694—2016《食品安全国家标准 畜禽屠宰加工卫生规范》要求屠宰,屠宰前无电刺激,屠宰后立即放入-20 ℃冰箱1 h,使其中心温度降至0 ℃,密封托盘包装后将其转移至0~4 ℃冰箱贮藏。
HY-10108 LY294002溶液 美国MedChemExpress公司;TRIzol试剂盒 美国ThermoFisher Scientific公司;GeneReadTM 试剂盒德国Qiagen 公司;NEB fragmentation buffer 美国NEB公司;dNTPs 美国Thermo公司;DNA聚合酶I、RNase H 美国TaKaRa生物公司;AMPure XP beads 美国Beckman Coultier公司。
1.2 仪器与设备
NanoPhotometer纳米光度计 德国Implen公司;2100生物分析仪 美国Agilent公司;Qubit 2.0荧光计上海Life Technologies公司;Illumina高通量测序仪中国Novogene公司;SW-CJ-1G超净工作台 上海博迅实业公司;ScanSpeed MiniVac Alpha冷冻离心机 美国Scan Speed公司;Thermo Scientific Forma 994 -80 ℃超低温冰箱 美国Thermo公司;GeneAmp PCR system 9700普通聚合酶链式反应(polymerase chain reaction,PCR)仪美国Life公司;BA-200 Digital数码三目摄像显微镜麦克奥迪实业集团有限公司。
1.3 方法
1.3.1 样品采集
选用宁夏盐池县大夏牧区的滩羊作为实验材料,采集在0~4 ℃条件贮藏的冷却滩羊右后腿肉(从腰椎与荐椎连接处斩下的右后腿部位肌肉)。将取下的滩羊右后腿剔除可见脂肪及结缔组织后迅速取约50 g 样本作为0 d 样品。其余样品切成大小均一的块状,每块约50 g,随机分为对照组(命名为C)和LY294002组,共18 组。对照组不做任何处理,LY294002组以料液比10∶1注射10 μmol/L LY294002溶液。置0~4 ℃、相对湿度85%条件下,分别采集贮藏0、4、8 d后样品各6 g封装于灭菌冷冻管中,用液氮速冻后置于-80 ℃冰箱中用于转录组测序。对于不便立即测定的指标,在采样点取下样品后迅速置于液氮中冷冻并转移至-0 ℃冰箱保存待用。每组样本分别进行3 个生物学重复。
1.3.2 RNA提取、cDNA文库构建和测序
LY294002注射组和对照组的样品按照制造商的说明使用TRIzol试剂盒进行RNA提取[20]。使用NanoPhotometer纳米光度计和2100生物分析仪检测RNA样品的数量和质量。样品检测合格后,通过GeneReadTM试剂盒去除rRNA。随后加入NEB fragmentation buffer将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物合成一链cDNA,然后加入缓冲液、dNTPs和DNA聚合酶I和RNase H合成二链cDNA,再用AMPure XP beads纯化双链cDNA。纯化的双链cDNA先进行末端修复、加A尾并连接测序接头,再用AMPure XP beads进行片段大小选择。最后进行PCR扩增,并用AMPure XP beads纯化PCR产物,得到最终的文库[21]。文库构建完成后,先使用Qubit2.0荧光计进行初步定量,稀释文库至1.5 ng/μL,随后使用2100生物分析仪对文库的insert size进行检测,insert size符合预期后,使用实时PCR(real-time PCR)方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol/L),以保证文库质量。文库制备物在Illumina HiSeq平台上测序。
1.3.3 质量控制、转录组组装和基因功能注释
fastq格式的Raw reads首先通过内部perl脚本进行处理。在该步骤中,通过从Raw reads(原始序列)中去除接头序列、包含poly-N的读数和低质量读数,获得Clean reads(过滤序列)。同时,计算Q20、Q30、GC含量和过滤序列重复水平。所有下游分析都基于Clean reads。使用拼接软件Trinity(version: r20140413p1)基于left.fq和right.fq完成转录组组装,其中min_kmer_cov默认设置为2,所有其他参数默认设置。基因功能基于以下数据库进行注释:非冗余蛋白序列数据库(Non-redundant Protein Sequence Database,Nr)、核酸序列数据库(Nucleotide Sequence Database,Nt)、蛋白质序列数据库(Swiss-Prot)、蛋白质家族数据库(Protein Families,Pfam)、基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)。
1.3.4 差异表达基因(differential genes,DEGs)分析和功能富集
使用DESeq(2012)软件包对两个条件/组进行差异表达分析。使用Benjamini和Hochberg控制错误发现率的方法调整所得的P值。用基于负二项分布的DESeq进行差异分析,Padj<0.05和|log2FC|>1(FC表示差异倍数(fold chang))的基因被指定为差异表达[22]。通过微生信数据可视化网站(http://www.bioinformatics.com.cn/)实施DEGs的GO富集分析和KEGG途径分析。0 d对比4 d组记为0/4 d组,4 d对比8 d组记为4/8 d组。
1.3.5 real-time PCR验证
real-time PCR用于验证RNA-Seq结果。随机选取FC>2或<0.5且P<0.01的6 个DEGs进行real-time PCR,GAPDH基因用作内部参考基因。使用Primer Premier 5.0设计用于real-time PCR的引物,列于表1中。扩增程序根据以前的方法:95 ℃,30 s;95 ℃,10 s;60 ℃,30 s,40 个循环[23]。通过2-ΔΔCt计算目标mRNA的相对表达率。使用独立样本t检验比较对照组和LY294002处理组。当P<0.05时,差异被认为具有统计学意义。

表1 real-time PCR引物序列Table 1 Primer sequences used for quantitative real-time PCR
1.3.6 肌纤维直径和间距测定
每组的肌肉组织用4%多聚甲醛固定液固定样本,随后进行脱水、修剪、包埋、切片、染色、镜检[24];采用数码三目摄像显微镜观察切片,测量肌纤维直径和肌纤维间距,每个样本共测量5 组数据,取平均值分别记为该样本的肌纤维直径和间距[25]。
1.4 数据处理
2 结果与分析
2.1 转录组测序和de novo组装
对来自对照组的9 个cDNA文库和来自LY294002组的9 个cDNA文库进行测序[26]。共获得115.50 Gb的序列,包括254941108 个Raw reads和248253912 个Clean reads。其中,96525684 个和151728228 个过滤序列分别来自对照组和LY294002组。对照组和LY294002组的碱基测序错误率分别为0.03%和0.02%。详细信息如表2所示。18 个文库过滤序列的从头组装产生62215 个单基因,总长度为183401678 bp,其中N50为1562 bp。从头组装详细信息如表3所示。
2.2 基因功能注释
对Nr、Nt、Swiss-Prot、Pfam、GO、KEGG数据库进一步搜索,共组装62215 个单基因。其中,获得功能注释信息的单基因分别为25459(26.48%)、42157(58.14%)、18908(19.15%)、24130(24.87%)、25067 个(31.15%)和11487 个(14.52%)。总共4863 个(6.42%)单基因可以与所有数据库匹配,48129 个(58.41%)单基因至少与一个数据库匹配(表4)。
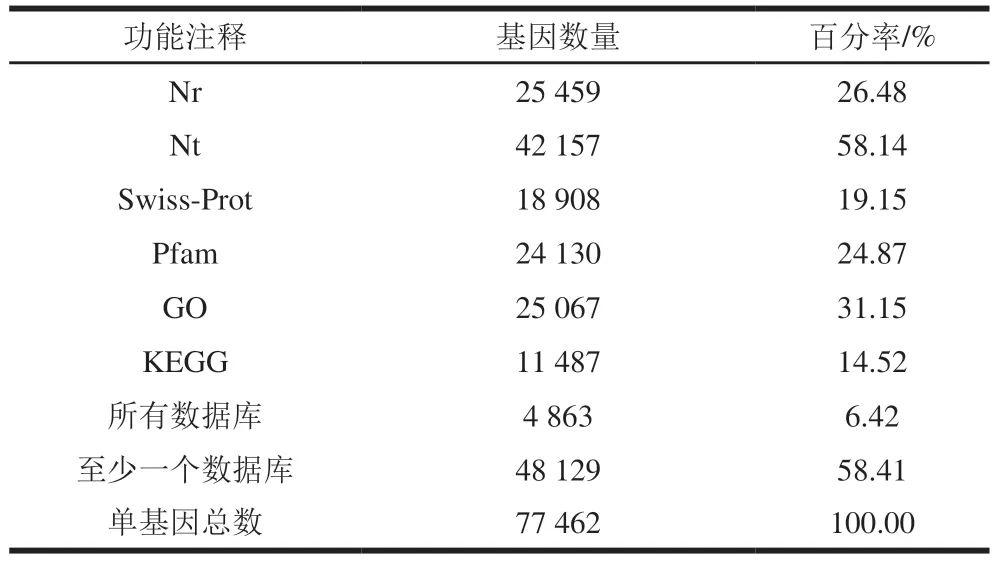
表4 滩羊肉转录组功能注释结果Table 4 Results of function annotation of Tan mutton transcriptome
根据GO分析,25067 个单基因被分为3 个功能类别:生物过程、细胞成分和分子功能类别。0/4 d组这3 个功能类别中最主要的分别是单一生物代谢过程、细胞外隙和结构分子活动(图1A),4/8 d组这3 个功能类别中最主要的分别是线粒体转运、MHC II类蛋白复合体和氧化还原酶活性(图1B)。表明0~4 d期间,位于细胞外隙的基因参与单一生物代谢过程等,这些基因编码的蛋白质具备结构分子活性等功能。4~8 d期间,位于MHC II类蛋白复合体的基因参与调控线粒体转运等过程,这些基因编码的蛋白质具备氧化还原酶活性等功能。此外,KEGG分析显示,10049 个单基因被映射到27 个通路上,这些通路可分为新陈代谢、遗传信息处理、环境信息处理、细胞过程和生物体系统五大类。其中,0/4 d组富集DEGs较多的是信号转导、能量代谢、碳水化合物代谢(图2A);4/8 d组富集DEGs较多的是信号转导、翻译(图2B)。在所有途径中,信号转导是富集到DEGs最多的途径。通过进一步对通路筛选后,发现PI3K/AKT信号通路、氧化磷酸化通路、叉头框蛋白O(forkhead box O,FOXO)信号通路以及mTOR信号通路在两组DEGs中显著富集。

图1 单基因的GO分类Fig.1 GO classification of unigenes
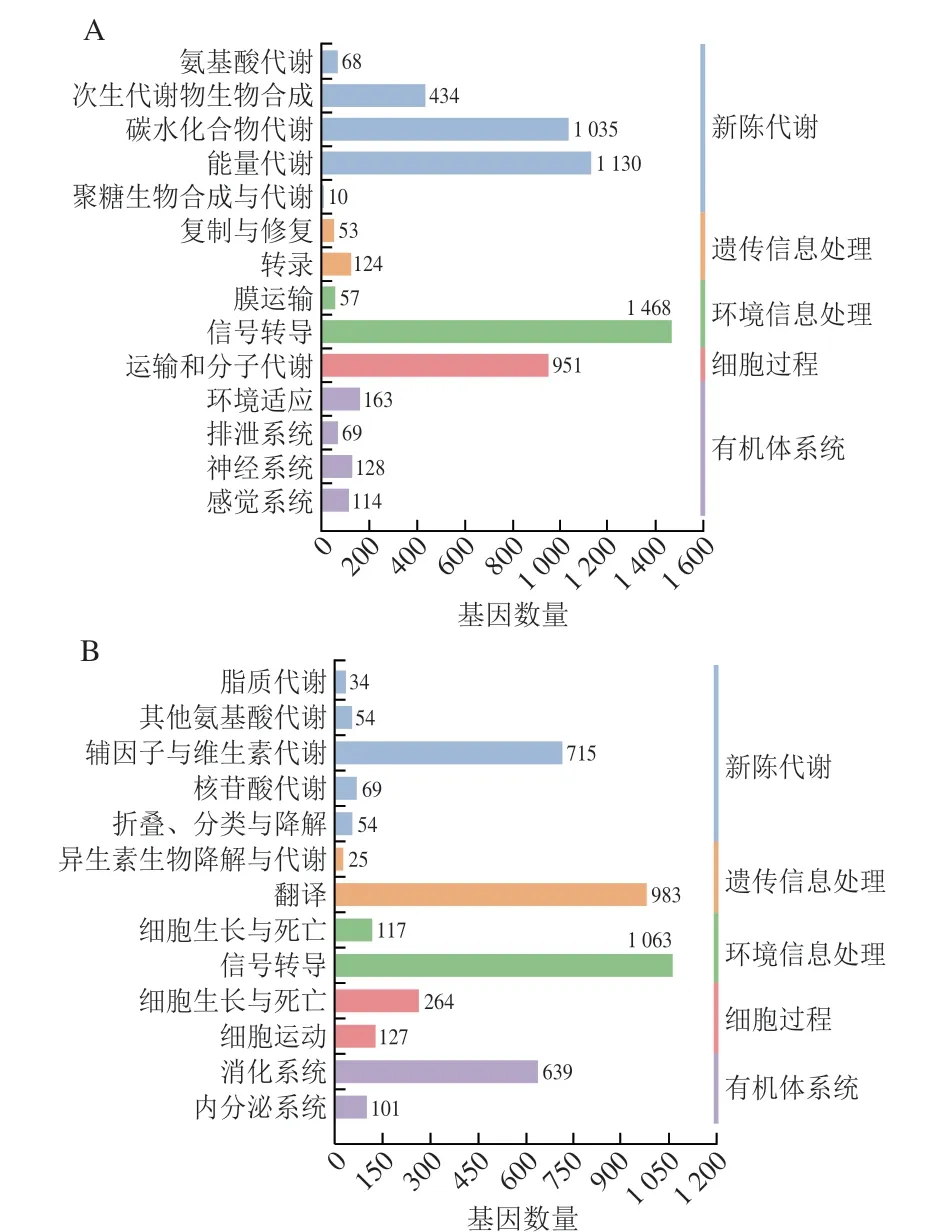
图2 KEGG分类Fig.2 KEGG classification
2.3 差异表达分析和富集分析
为了比较0、4、8 d对照组和LY294002组之间的差异表达,使用DESeq(2012)软件包识别DEGs,以Padj<0.05、log2FC>1或log2FC<-1为筛选条件,共发现583 个DEGs。其中,0 d对照组和LY294002组中发现474 个DEGs,包括320 个上调基因和154 个下调基因(图3A),BAD基因极显著上调可能是由于AKT活性受到抑制而促进B淋巴细胞瘤-2基因相关启动子(Bcl-2asociated death promoter,BAD)与Bcl-2基因的结合,从而减弱Bcl-2基因抑制凋亡的作用。另外,Caspase-9蛋白水解酶被激活,促使Caspase-9降解肌肉结构蛋白并影响肌肉嫩度;4 d对照组和LY294002组中发现96 个DEGs,包括44 个上调基因和52 个下调基因(图3B),AS160表达显著下调会使下游葡萄糖转运体(glucose transporter,GLUT)4蛋白降解,诱发骨骼肌摄取葡萄糖能力降低,进而导致葡萄糖代谢紊乱。CHI3L1基因表达下调可能是PI3K/AKT通路受到抑制后,激活了下游与碳水化合物分解代谢和蛋白质磷酸化酶等有关;8 d对照组和LY294002组中发现13 个DEGs,包括2 个上调基因和11 个下调基因(图3C),上调基因与肌肉组织结构有关,包括肌球蛋白重链7B和肌钙蛋白C1基因,下调的基因MYH7B、MYOZ2、RRAD与糖酵解受到抑制和钙通道调节有关。

图3 对照组和LY294002组DEGs分布趋势火山图Fig.3 Volcano maps of the distribution trends of DEGs between the control and LY294002 groups
为深入了解LY294002注射组可能差异调节的生物学过程,选用0/4 d LY294002组进行GO注释分析。发现上调基因主要富集在30 个GO条目中,信号转导、胞外区和受体结合分别是生物过程、细胞成分和分子功能类别中富集最多的亚类(图4A)。下调基因也主要富集在30 个GO项,氨基聚糖代谢、胞外区和受体结合分别是生物过程、细胞成分和分子功能中富集最多的亚类(图4B)。
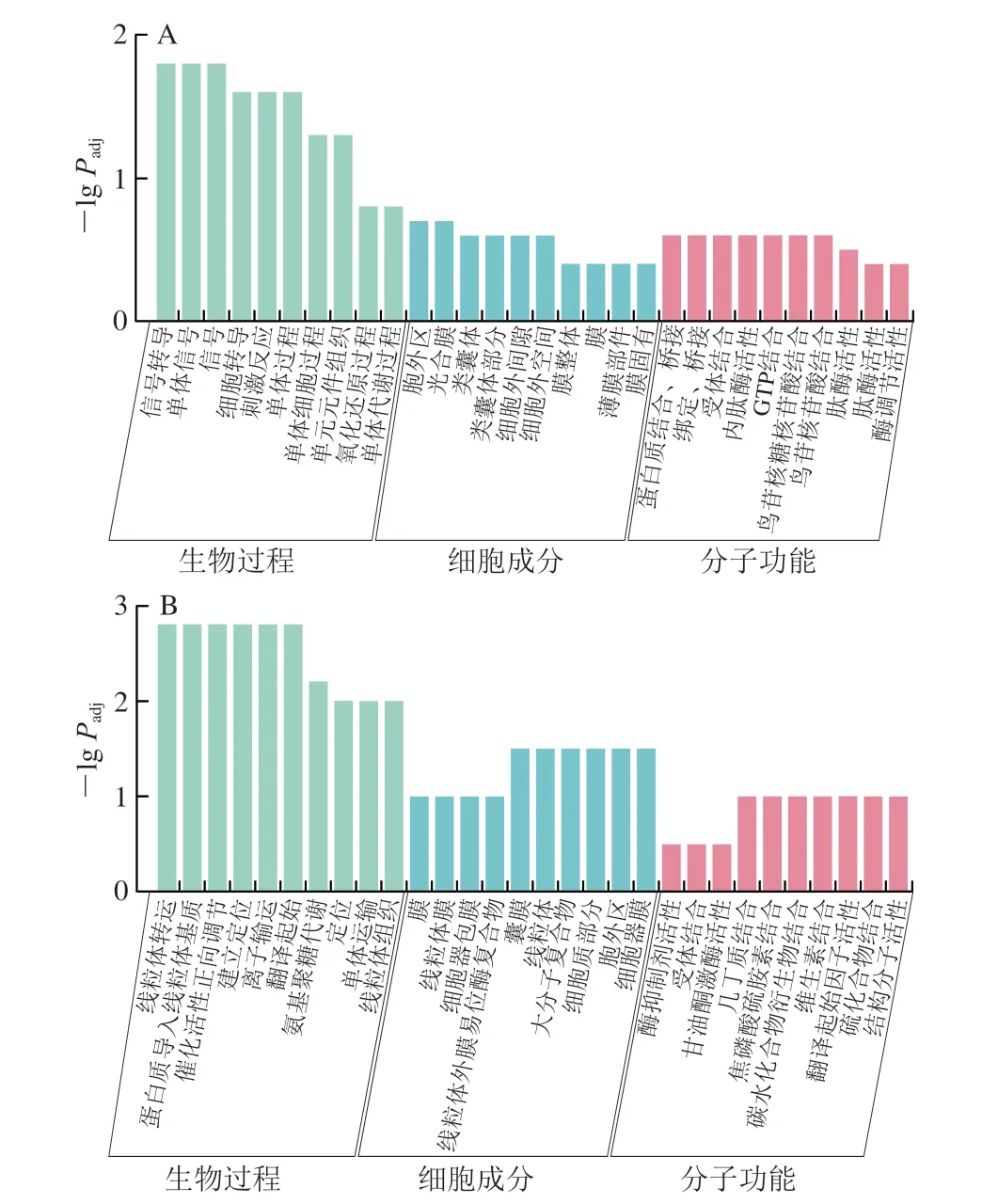
图4 0/4 d LY294002组DEGs的GO注释结果Fig.4 GO annotation results of DEGs in LY294002 group on days 0 versus 4
为进一步探索DEGs可能参与哪些信号通路,使用微生信在线软件(http://www.bioinformatics.com.cn/)进行了KEGG通路富集分析,FDR≤0.05被视为富集通路,结果见图5。

图5 前20 DEGs的KEGG分类Fig.5 KEGG classification of top 20 DEGs
图5A显示了关于0/4 d LY294002组上调基因的最重要的前20 条途径。在前20 条途径中,精氨酸和脯氨酸代谢、ECM受体交互作用、PPAR信号通路、黏附斑激酶信号通路和甘油脂类代谢受到LY294002处理的影响。下调的基因在细胞衰老、糖酵解/糖异生、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、氨基酸的生物合成和自噬途径中显著富集(图5B)。KEGG分析结果表明,PI3K/AKT途径在肌肉的氨基酸、葡萄糖和脂类代谢以及细胞命运中起着重要作用。
2.4 real-time PCR验证
为证实RNA-Seq的结果,选择涉及cAMP信号通路、转运和分解代谢、精氨酸和脯氨酸代谢、细胞凋亡、甘油脂类代谢和MAPK信号通路的6 个代表性DEGs(表5),并应用real-time PCR测定这些基因的相对表达水平。结果显示,这些基因的表达与来自RNA-Seq结果的FPKM值一致(图6),这表明转录组测序数据可靠。
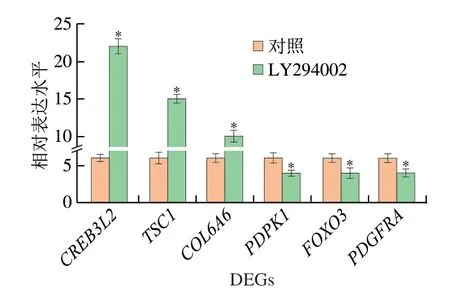
图6 6 个DEGs的相对表达水平Fig.6 Relative expression levels of six DEGs

表5 6 个代表性DEGsTable 5 Six representative DEGs
2.5 组织切片分析
为了研究LY294002抑制剂对肌纤维的影响,石蜡切片观察贮藏0 d时对照组和LY294002注射组的肌纤维。结果显示,与对照组相比,LY294002注射组的肌纤维直径显著减小,肌纤维之间的间距显著增加(表6)。此外,与对照组相比,LY294002注射组的细胞间隙变大,细胞质内容物明显减少(图7),和肌肉萎缩的特征相似。结合转录组测序的结果,表明LY294002抑制PI3K/AKT信号通路会导致肌肉细胞代谢失衡,进而影响肌肉细胞的生长,最终导致肌肉发生萎缩。

图7 贮藏0 d对照组和LY294002组的滩羊肉组织切片Fig.7 Tissue sections of Tan mutton in the control and LY294002 groups

表6 0 d对照组和LY294002组肌纤维对比Table 6 Comparison of muscle fibers between the control and LY294002 groups on day 0
3 讨论
PI3K/AKT信号通路作为细胞内的信号转导通路,对细胞生长、存活和代谢控制等生物学功能产生影响[27]。为揭示PI3K/AKT信号通路对冷却滩羊肉贮藏过程中的作用,采用高通量测序技术研究LY294002处理后冷却贮藏期间滩羊肉转录组的变化。通过转录组分析,总共组装了62215 个单基因,N50为1562 bp,其中62.57%可以被注释。为进一步研究PI3K抑制剂(LY294002)对冷却滩羊肉的影响,采用GO和KEGG富集分析对583 个基因进行了分类。GO分析表明DEGs主要富集于信号转导过程和胞外区。KEGG富集分析表明,PI3K-AKT信号通路、氧化磷酸化通路、FOXO信号通路及mTOR信号通路为不同贮藏期间DEGs共同注释到的代谢通路,这些途径是肌肉细胞功能的关键部分。其中,胰岛素受体通过参与PI3K-AKT途径作用,发动细胞内信号转导作用的多效级联反应,刺激葡萄糖的吸收、增殖和蛋白质合成,并通过招募大量PI3K相关蛋白与肌动蛋白细胞骨架连接。因此,对滩羊肉品质特性如保水性及嫩度具有十分重要的调节作用。氧化磷酸化是肌肉运动时产生ATP的有效途径,Jiang Shengwang等[28]研究表明,氧化磷酸化与糖酵解、脂肪酸代谢、细胞凋亡和肌肉收缩有关,对宰后肉品质形成具有重要的影响。FOXO信号通路在肌肉中的部分作用是调节转录,通过响应胰岛素或IGF-1激活AKT诱导FoxO转录因子磷酸化,从而抑制其转录活性。此外,FoxO控制着肌肉中萎缩相关基因,包括Fbxo32和Trim63以及自噬基因,FoxO的缺失可以防止肌肉萎缩,贮藏期间肌肉能量代谢的差异可能与该通路变化有关。mTOR信号通路受到抑制时,肌肉代谢发生变化,包括氧化代谢受损,线粒体调节改变以及与AKT过度激活相关的糖原积累。Risson等[29]研究也表明,骨骼肌中的mTOR缺乏会导致代谢变化,从而导致糖原积累。因此,宰后肌肉代谢的转换和肉品质变化均与贮藏期间肌肉转录水平的变化密切相关。
肌纤维是由蛋白质合成和蛋白质降解维持动态平衡的调节过程[30]。PI3K/AKT途径不仅在蛋白质合成和肌肉生长中起重要作用,而且在抑制蛋白质降解中也发挥着作用[31]。Dong Jun等[32]研究发现PI3K信号通路能显著促进肌肉的生长,通过其下游的β-连环蛋白调节成骨细胞并加快骨折愈合。PI3K/AKT也受分泌型糖蛋白(Wnt配体)调控,参与Wnt配体诱导的成骨细胞功能。该研究阐明了Wnt/PI3K/AKT/β-连环蛋白在成骨细胞中的功能联系,突出了PI3K/AKT和Wnt/β-连环蛋白之间复杂的相互作用,它们在骨折愈合中起着至关重要的作用。王欣悦等[33]研究绵羊胚胎骨骼肌蛋白质组学数据发现,具有调控绵羊胚胎骨骼肌纤维生长发育作用的PI3K/AKT信号通路在骨骼肌纤维直径增大的第105天显著富集,AKT2是调控该信号通路的重要候选蛋白,并对骨骼肌纤维发育及分化产生影响。PI3K和mTOR的抑制剂对瘦素诱导的蛋白质分解显著的抑制作用,这说明PI3K-AKTmTOR信号通路活化是瘦素调节蛋白质分解所必需的[8]。PI3K/AKT信号可以使FOXO转录因子磷酸化抑制蛋白质分解,FOXO转录因子通过调节参与肌肉萎缩基因的表达降低肌肉质量。同时发现当PI3K信号被LY294002抑制时,FOXO的表达显著增加,这表明肌纤维中的蛋白质降解水平提高。组织学分析的结果显示,肌纤维直径减少和肌纤维之间的间距显著增加,这与肌肉萎缩的特征相似[34]。Ang II能够通过抑制PI3K/AKT/FOXO1信号通路的磷酸化,抑制蛋白的合成,诱导骨骼肌细胞萎缩[34]。Liu Lingyu等[35]研究发现福莫诺汀(formononetin,FMN)显著抑制了大鼠肌肉生长抑制素α的表达。另外,FMN显著增加了PI3K、AKT和FOXO3a的磷酸化以及CKD大鼠和C2C12肌管肌肉中肌源性增殖和分化标志物,促进了肌源性分化因子D和肌生成蛋白的表达。这些结果表明,PI3K/AKT/FOXO途径调节蛋白质降解和合成之间的平衡,从而介导肌肉萎缩和维持骨骼肌质量。从刺激到细胞过程调节的信号转导,包括参与葡萄糖稳态的过程,PI3K/AKT信号通路通过促进葡萄糖转运、糖原合成介导肌肉代谢[12]。在本研究中,DEGs的KEGG途径富集分析表明糖酵解/糖异生、碳水化合物代谢过程、甘油脂类代谢和脂类途径的反应均受到影响。这些结果表明,PI3K/AKT通路的正向功能对于冷却滩羊肉代谢控制是必不可少的,其功能障碍可能导致糖和脂质稳态受损。
PI3K/AKT信号传导通过在生物体生长和关键细胞过程(如细胞周期进程、细胞生长和存活)期间介导生长因子信号,在细胞生理学中发挥重要作用[36]。MAPK也是关键信号通路,其激活对于肌肉细胞增殖是不可或缺的[37]。由于PI3K/AKT途径的功能与Ras/MAPK途径相似,所以发现这两种途径之间存在一定程度的相互作用[38]。在对这两种转导途径相互作用的初步研究中,发现PI3K抑制剂可以降低MAPK的活性。Mano等[39]研究表明小鼠中的p38 MAPK信号通路被激活,导致泛素-蛋白酶体系统和自噬的激活。p38激活剂通过p38 MAPK信号通路的激活导致肌肉结构发生改变,PI3K活性对Ras/MAPK通路活性有非常重要的诱导作用。鉴于相互作用的复杂性,肌肉中PI3K/AKT途径和Ras/MAPK途径之间的真实关系尚未完全揭示。转录组数据显示,一些上调基因富集在MAPK信号通路中,表明PI3K/AKT通路可能对MAPK信号通路有抑制作用。而汤崇辉等[40]发现作为PI3K/AKT抑制剂的渥曼青霉素对大鼠脑细胞中MAPK的活化有抑制作用。这些结果表明PI3K/AKT途径和MAPK途径之间的相互作用在不同的细胞类型和细胞分化的不同阶段可能是不同的。
4 结论
本研究利用PI3K抑制剂LY294002对贮藏期间冷却滩羊肉处理后进行高通量测序,转录组信息鉴定了583 个DEGs。0~4 d,DEGs富集较多的途径是信号转导、能量代谢及碳水化合物代谢;4~8 d富集DEGs较多的是信号转导和翻译过程。不同贮藏时间DEGs对肌肉代谢存在不同程度的调控作用,转录水平的变化主要通过氨基酸的生物合成、糖酵解/糖异生能力、甘油脂类代谢、MAPK信号通路的激活等过程参与调控肌肉代谢的转换,为进一步阐明冷却滩羊肉肌肉中PI3K/AKT代谢稳态的分子机制提供了方向。从应用的角度来看,建议控制PI3K活性在适当水平以维持冷却滩羊肉的代谢稳态。

