乌鳢水泡病毒(SHVV)巢式PCR 检测方法的建立与应用
娄剑锋,公翠萍,肖自东,刘晓丹,胡大雁,劳顺健
(1.湖州市南浔区农业技术推广服务中心,浙江 南浔 313009;2.湖州市农业科学研究院,浙江 湖州313000;3.湖州市农业种质资源创新与应用重点实验室,浙江 湖州 313000;4.扬州大学,动物科学与技术学院,江苏 扬州 225000)
巢式PCR 是建立在普通PCR 方法基础之上的一种改进型方案,广泛用于病毒基因的检测。但是,目前还没有建立巢式PCR检测乌鳢水泡病毒的报道。本研究通过获取感染乌鳢水泡病毒的杂交鳢组织,获得病毒的相关基因,利用巢式PCR相关技术,通过体系的建立和反应程序的优化,建立一种检测乌鳢水泡病毒的方法,为及时发现并快速诊断乌鳢水泡病毒提供一项重要的技术手段。
一、材料与方法
1.实验样品 乌鳢水泡病毒由实验室保存,患病鱼样本采自广东省顺德市杂交鳢养殖场。
2.实验试剂及仪器 实验试剂:TRIpure Reagent、异丙醇、氯仿、75%乙醇;DEPC 水、50×TAE 缓冲液、10×EX Taq Buffer (Mg2+plus)、反转录酶、DL2000 DNA Marker、DNA 凝胶回收试剂盒、琼脂糖凝胶(Biowest Agarose)。
实验仪器:PCR 扩增仪、移液器、高速离心机、无菌操作台、电泳仪、凝胶成像分析系统。
3.引物的设计 本实验引物的设计根据NCBI已发表乌鳢水泡病毒相关的基因序列,使用Clone Manager 软件, 根据基因组的序列进行比对,寻找到乌鳢水泡病毒(SHVV)核衣壳蛋白基因的保守区域。通过Primerprimer 软件,设计并合成内外两对乌鳢水泡病毒的PCR 引物(SHVV-1F、SHVV-1R;SHVV-2F、SHVV-2R),引物详情见表1。引物通过南京擎科生物公司制作,经PAGE纯化后,通过ddH2O 配成浓度20 微摩尔/升,-20℃保存备用。
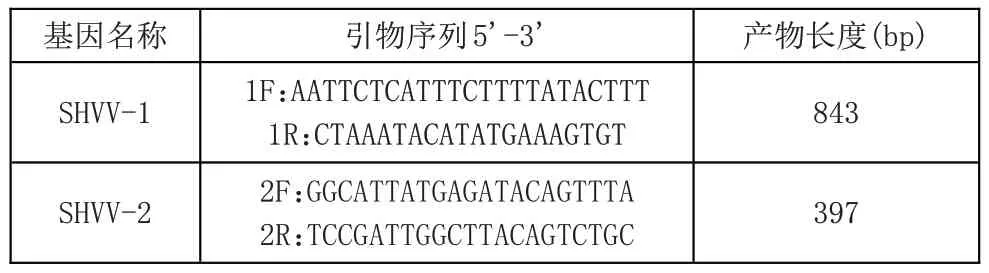
表1 SHVV巢式PCR引物
4.RNA 提取和反转录 RNA 的提取,取实验室保存的乌鳢水泡病毒阳性病料的肝、肾组织。在无菌操作台中,根据RNA 提取说明操作(Trizol法),提取待检测样品病毒总RNA。提取的RNA很容易降解,需要立即进行反转录或者-20℃保存。
RNA 反转录,取0.2 毫升无酶离心管,配置以下混合液(10 微升):RNA 模板×5 微升、Oligo Dt Primer(50 微摩尔)×1 微升、dNTP Mixture(10Mm each)×1微升、ddH2O×3微升,在PCR仪中65℃恒温保持5 分钟,迅速插入冰中冷却;通过以上操作步骤,使RNA变性,提高反转录反转效率。反转录体 系: 变 性 后 的 反 应 物× 10 微 升、 5 ×PrimeScript Ⅱ Buffer × 4 微 升 、 RNase Inhibitor (40 单 位/微 升) × 0.5 微 升、PrimeScript Ⅱ RTase (200 单 位/微 升) ×1 微升、RNase Free dH2O×4.5 微升,轻轻吹打摇匀。反转录反应:45℃,50 分钟合成cDNA、95℃5 分钟使酶失去活性,随后立即放入冰盒冷却3 分钟,即为cDNA模板,-20℃保存备用。
5.巢式PCR方法的建立 巢式PCR需要两对引物通过两轮反应完成,配置的反应体系为20微升。
第一轮反应体系:上述反转录的cDNA 模板×1微升、SHVV-1F×1微升、SHVV-1R×1微升、10×EX Taq Buffer (Mg2+plus)×10 微升、ddH20×7 微升。PCR 反应程序:95℃预变性5 分钟;95℃变性0.5 分钟, 56℃退火0.5 分钟,72℃延伸1 分钟, 30 个循环;然后72℃延伸5 分钟, 最后12℃降温,4℃保存。
随即进行第2 次PCR 扩增,以第1 次的PCR 扩增产物为模板,模板要相应减少,用第2对引物配置PCR 体系。第2 轮体系:PCR 扩增产物×1 微升、SHVV-2F×1 微升、SHVV-2R×1 微升、10×EX Taq Buffer (Mg2+plus)×10 微升、ddH20×7 微升。PCR 反应程序:95℃预变性5 分钟;95℃变性0.5 分钟,56℃退火0.5 分钟, 72℃延伸1 分钟,循环30 次接着72℃延伸5 分钟,最后12℃降温,4℃保存备用。
琼脂糖凝胶电泳检测,配置1×TAE 缓冲液和1.0%琼脂糖凝胶;取5微升扩增样品置于1.0%琼脂糖凝胶孔内,同时DL2000 DNA Marker×6 微升作为参照,使用凝胶电泳仪120 伏电泳30 分钟。电泳完成后,把琼脂糖凝胶放在成像分析系统中观察结果,拍照留存图像。为保证PCR 反应的准确性、特异性,需要做凝胶回收并做相关测序检测。使用琼脂凝胶DNA 回收试剂盒回收DNA,操作步骤参见其使用说明书。凝胶回收完成后,将其回收产物送往南京擎科生物科技有限公司测定序列。
6.特异性检测 本实验以鲤春病毒血症病毒、真鲷虹彩病毒、传染性脾肾坏死病毒的DNA或cDNA为检测样品,同时以ddH2O作为阴性对照,用外引物SHVV -1F、SHVV-1R 进行PCR 扩增;以得到的扩增产物为模板,再用内引物SHVV-2F、SHVV-2R 进行二次扩增。配置1.0%琼脂糖凝胶,电泳30分钟,成像。观察相对应条带,分析其特异性。
7.灵敏性检测 利用本研究建立的检测方法,对1×104TCID50/毫升的病毒液进行10 倍倍比稀 释(100,10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8),随后提取RNA,反转录合成cDNA。以cDNA为PCR模板,以相应体系和程序(同上),分别进行巢式PCR 扩增。同时需设置一组阴性对照组,以ddH2O 为模板对照。分别取不同浓度PCR 模板的扩增产物5 微升进行1.0%琼脂糖凝胶电泳,同时DL2000 DNA Marker×6微升作为参照,120伏电泳30 分钟,观察成像结果,保存图片,评估本实验建立的方法灵敏性。
8.临床样品检测 选择16 个患病杂交鳢肝组织临床样品,提取RNA,之后反转录cDNA。以此为DNA模板,用水作为阴性对照模板,利用上述实验建立的乌鳢水泡病毒巢式PCR检测方法,对所采集的临床样品进行检测,做好结果记录。将阳性结果进行凝胶回收,回收产物送南京擎科生物科技有限公司测定序列,并分析结果。
二、结果与分析
1.巢式PCR结果分析 组织样品经过RNA提取步骤获得相关RNA,之后反转录得到cDNA 模板,第一轮以外引物SHVV-1F、SHVV-1R 扩增,成像结果显示(图1),条带较暗淡,特异性不明显,扩增产物长度在843 bp。以此PCR产物为模板,用第二对内引物SHVV-2F、SHVV-2R 再次进行PCR 扩增,结果显示,扩增单一条带明亮,特异性强,扩增产物长度在397 bp。本次实验病毒样品通过巢式PCR扩增,成像结果显示,单一目的条带明亮,特异性强,实验方法适合于SHVV的特异性检测。
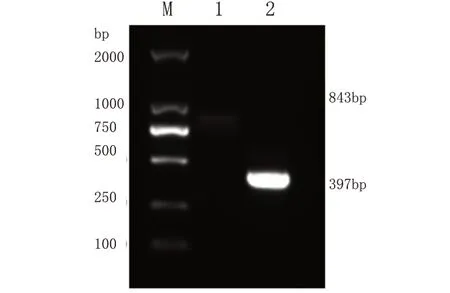
图1 SHVV巢式PCR检测
2.PCR 产物测序结果分析 将巢式PCR 扩增产物胶回收后,送往相关公司测序,得到的结果与NCBI 已发表乌鳢水泡病毒(SHVV)相关的基因序列数据进行比对。结果显示,样品基因序列与乌鳢水泡病毒基因序列相对应的片段相一致,从而确定了该检测方法的准确性。
3.特异性检测结果分析 通过以上实验建立的乌鳢水泡病毒巢式PCR检测对不同种病毒样品进行检测,结果显示SHVV 呈阳性(图2),扩增出了397 bp 单一目的条带,实验对照样品鲤春病毒血症病毒(SVCV)、真鲷虹彩病毒(RSIV)、传染性脾肾坏死病毒(ISKNV)以及ddH2O,均无任何条带,呈阴性。以上实验表明,乌鳢水泡病毒巢式PCR检测方法特异性强,准确性高。
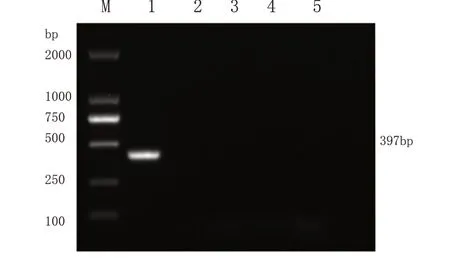
图2 SHVV巢式PCR特异性检测
4.灵敏性检测结果分析 根据凝胶成像的结果显示(图3),当检测样品病毒液稀释浓度为1×10-6倍以内,可观察到明亮的单一条带。当样品病毒液稀释浓度达到1×10-7倍以上,则无法扩增出特异性条带。表明本实验建立的巢式PCR方法对乌鳢水泡病毒最低检测浓度为1×0.01TCID50/毫升。
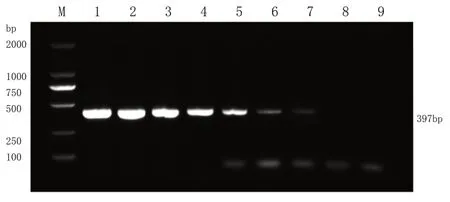
图3 SHVV巢式PCR灵敏性检测
5.临床样品检测结果分析 16 个临床样品通过SHVV巢式PCR检测,其结果显示(图4),13个样品扩增出了特异性条带,呈阳性;3个临床样品以及阴性对照ddH2O 无条带,呈阴性。将检测出来的阳性临床样品进行凝胶回收,回收产物进行基因测序。检测出的基因序列同乌鳢水泡病毒(SHVV)相关的基因序列比对。结果显示,呈阳性的检测样品基因序列与SHVV 基因序列一致,表明本实验建立的SHVV 巢式PCR 方法特异性强、灵敏度高,能够准确、快速地检测出患病鱼是否感染乌鳢水泡病毒,可运用于临床样品的检测。
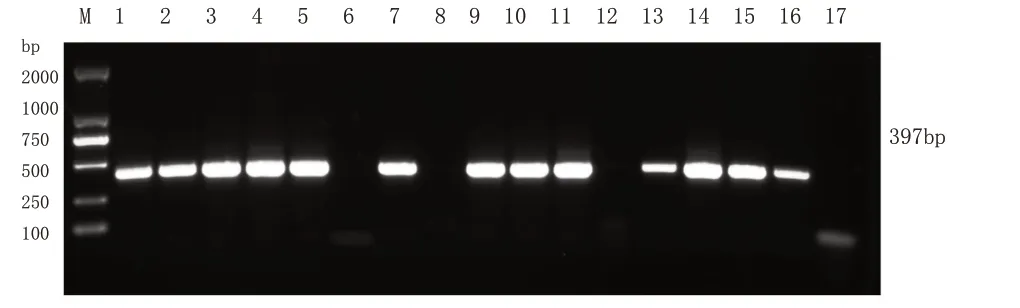
图4 SHVV巢式PCR特异性检测
三、结论
本实验方法的建立为乌鳢水泡病毒的临床诊断与预防提供了一项重要的技术手段,对实施乌鳢水泡病毒的鉴定、分离等研究提供了技术方案。
——白乌鳢

