磁微粒化学发光法测定VEGF的性能验证和临床应用效果评估
屠竞扬,周 琰,邵文琦△,潘柏申,王蓓丽,郭 玮,2,3,4
1.复旦大学附属中山医院检验科,上海 200032;2.上海市老年医学中心检验科,上海 201104;3.上海市宝山区吴淞中心医院检验科,上海 200940;4.复旦大学附属中山医院厦门医院检验科,福建厦门 361015
近年来,肺癌、结直肠癌、胰腺癌、胃癌等恶性肿瘤的发病率和病死率呈逐年上升趋势,这对于人们的身心健康和生活质量产生了巨大的影响。很多恶性肿瘤患者由于初期症状不明显,而耽误了最佳治疗时机。因此,临床需要更多的早期肿瘤标志物对于各种恶性肿瘤患者进行早期筛查。血管内皮生长因子(VEGF)是一种相对分子质量为34~46×103的高度糖基化的二聚体可溶性碱性糖蛋白,具有很强的促进血管内皮细胞分裂、繁殖及增强毛细血管通透性的能力,并且在许多病理生理过程中都有表达。在众多血管生成因子当中,VEGF是公认的主要诱导血管生成的物质,是肿瘤血管生成的最有效的刺激因子,与肿瘤的发生、发展具有密切的关系。VEGF虽作为一种新型肿瘤标志物备受临床关注,但目前国内对恶性肿瘤患者血清VEGF水平的检测尚处于初级阶段,临床普及率仍较低。使用磁微粒化学发光法检测VEGF水平相较于目前临床上常用的直接化学发光法,其能通过磁场分离出VEGF,使检测的准确率更高。本研究拟对VEGF测定试剂盒(磁微粒化学发光法)做性能分析和初步临床应用效果评估。
1 资料与方法
1.1一般资料 选取2023年8月于复旦大学附属中山医院(以下简称本院)确诊为实体恶性肿瘤患者80例作为癌症组,其中肺部、结直肠、胰腺、胃部肿瘤患者各20例,良性病变患者80例作为良性疾病组,其中肺部、结直肠、胰腺、胃部疾病患者各20例。癌症组及良性疾病组入组排除并发风湿、类风湿关节炎、心肌梗死及其他心脏疾病、血管炎、系统性红斑狼疮、严重感染及严重内科疾病的患者。另选取于本院体检的表观健康者20例作为健康对照组。健康对照组平均(40.90±12.14)岁,良性疾病组平均(56.25±13.44)岁,癌症组平均(61.59±12.69)岁,3组年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究获得本院医学伦理委员会审核批准(B2018-099),所有研究对象均签署知情同意书。
1.2样本采集与检测 采用黄头采血管(含促凝剂惰性分离胶)采集所有研究对象静脉血5 mL,室温静置30 min,再置于4 ℃环境下以 1 007×g离心10 min,分离血清后置于-20 ℃冰箱中保存待测。排除有明显溶血、脂血、黄疸的样本。检测仪器为Aurora-1000i全自动化学发光免疫分析仪,购自山东康华生物医疗科技股份有限公司。VEGF测定试剂盒内含试剂1、试剂2及配套校准品和质控品。
1.3方法学评价
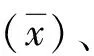
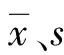

1.3.4线性范围验证 选用VEGF低浓度(L)样本(40 pg/mL)和高浓度(H)样本(3 200 pg/mL)各1份,1份取2 mL,并按5H、4H∶1L、3H∶2L、2H∶3L、1H∶4L、5L的比例混合成6个10 mL的混合样本,编号分别为L6、L5、L4、L3、L2、L1,每个浓度样本重复检测2次。根据CNAS-GL037文件[2]规定,以实测值为Y,理论测定值为X,拟合线性回归方程Y=a×X+b,线性相关系数r≥0.99为符合要求。

1.3.6参考范围验证 厂家声明的VEGF参考范围为<160 pg/mL。本实验室抽取20例表观健康人群。根据WS/T 402-2012:《临床实验室检验项目参考区间的制定》[3]中小样本验证的规定,所选取的20例样本落在参考限外的测定值不超过两个,可认为引用的参考区间适合本实验室。
春节回家,看到老家父母的房子已经破旧到冬天漏风,夏天漏雨的程度,老人住了几十年,舍不得拆,想进行维修,他果断的说“拆了翻盖吧,这事我定了”。
1.3.7干扰验证 选取低值样本(VEGF水平为145 pg/mL)和高值样本(VEGF水平为1 000 pg/mL),各取200 μL,分别加入10 μL干扰物质(30 mg/mL甘油三酯、2 mg/mL血红蛋白、350 μmol/L胆红素)为实验组,空白样本为对照组。同时测定对照组和实验组VEGF水平,依据产品说明书,加入干扰物质后低值样本阴阳性不变,高值样本测值偏差在15%以内为符合要求。
1.4临床评估 分别检测癌症组、良性疾病组、健康对照组VEGF水平,统计分析3组间水平差异,评估临床应用效果。
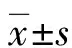
2 结 果
2.1重复性验证 低值样本重复检测20次的结果为(133.381±5.849)pg/mL,CV为4.38%;高值样本重复检测20次的结果为(972.146±12.868)pg/mL,CV为1.32%,均满足目标CV(≤6.25%),重复性验证通过。见表1。
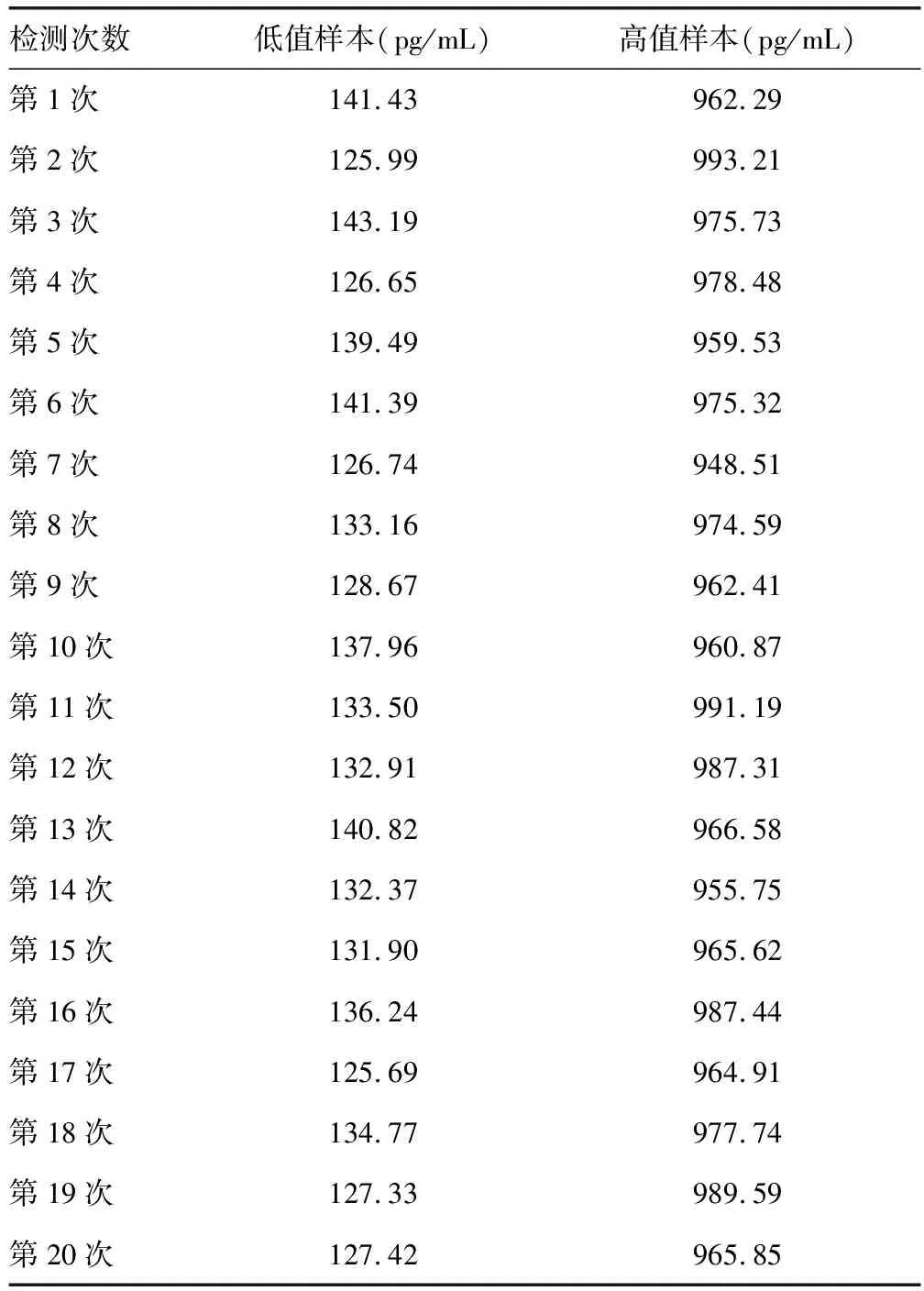
表1 重复性验证结果
2.2中间精密度验证 低值样本测量10次的结果为(128.914±3.062)pg/mL,CV为2.38%;高值样本测量10次的结果为(960.202±18.142)pg/mL,CV为1.92%。均满足目标CV(≤8.33%)。可判断中间精密度验证通过。见表2。
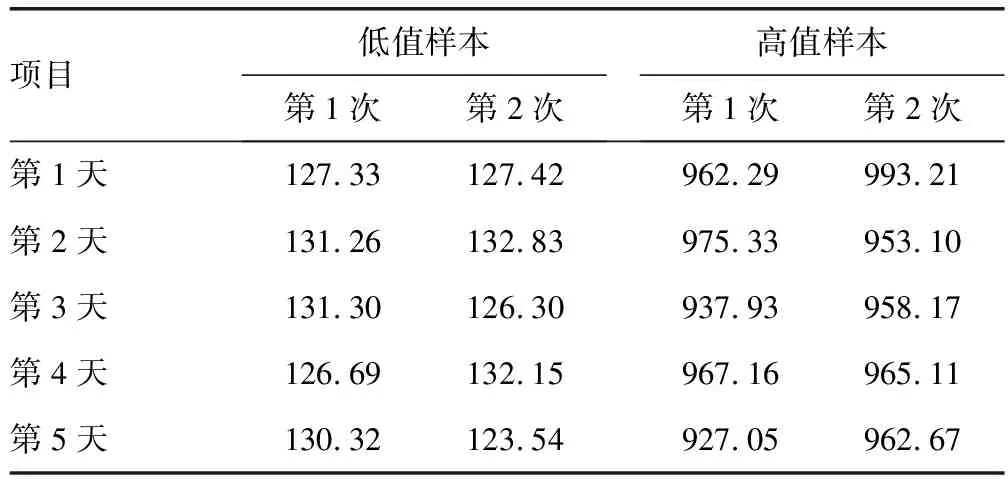
表2 中间精密度验证结果(pg/mL)


表3 正确度验证结果(pg/mL)

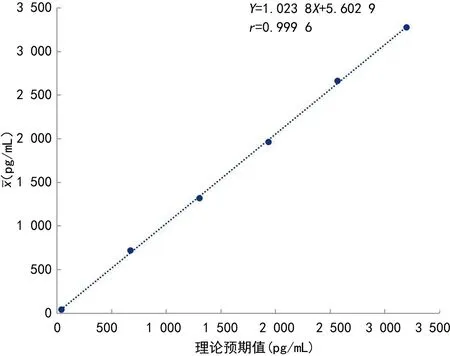
图1 线性相关分析图

表4 线性范围验证(pg/mL)
2.5可报告范围验证 稀释比为1.0∶5.0样本的偏差为-3.17%,是偏差绝对值<12.5%的样本中稀释倍数最大的,因此,VEGF测定试剂盒的最大可信稀释比为1.0∶5.0,可报告范围为40~16 000 pg/mL。见表5。
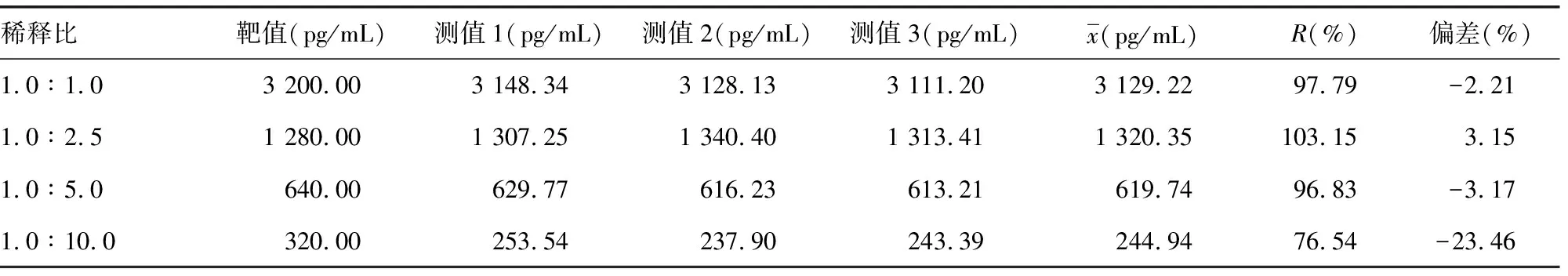
表5 不同稀释比下可报告范围验证
2.7干扰验证 干扰验证后,低值样本的VEGF水平均仍呈阴性结果(<160 pg/mL),胆红素、血红蛋白、甘油三酯干扰物高值实验组的偏差分别为5.34%、2.59%、3.08%,小于产品说明书声明的15.0%,对检测结果未产生影响,干扰验证通过。见表6。
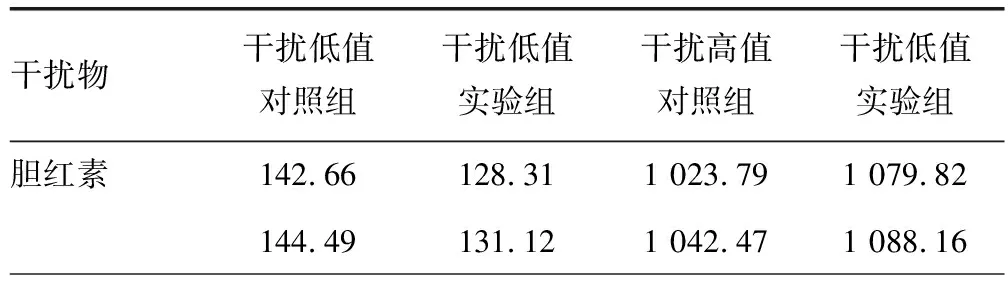
表6 在不同干扰物干扰下VEGF的测定结果(pg/mL)


图2 VEGF诊断恶性肿瘤的ROC曲线
3 讨 论
VEGF是一种具有血管通透性的同型二聚体糖蛋白[4],在调控血管形成和发育中起关键作用[5]。人类VEGF家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F、胎盘生长因子(PLGF)及内分泌腺衍生的VEGF (EG-VEGF)。临床上通常所说的VEGF往往指VEGF-A,其在新生血管生成中发挥重要作用,可引起细胞增殖、抑制细胞凋亡、血管通透性增加、血管舒张、炎症细胞向损伤部位募集等[6]。而恶性肿瘤不断进展,生长到超出预先存在的脉管系统范围的器官组织,就会诱导新生血管形成以促进其进一步发生、发展。因此,血管异常被认为是恶性肿瘤的标志之一[7]。已有部分研究显示血清VEGF可作为恶性肿瘤的诊断和预测预后的指标[8-9],乳腺癌[10]、宫颈癌[11]、原发性肝癌[12]等恶性肿瘤患者均有VEGF水平升高的现象。
目前对于VEGF的检测一般采用酶联免疫吸附实验、荧光层析法、化学发光法等,但这些方法都存在一定不足,如检测时间长、灵敏度低等问题。 本研究采用磁微粒化学发光法检测VEGF水平,将双抗体夹心法免疫测定原理与超顺磁性纳米微球标记技术和化学发光免疫分析相结合,定量检测人血清样本中的VEGF水平。结果显示,磁微粒化学发光法检测血清VEGF的重复性、中间精密度、正确度、线性范围、可报告范围、参考区间、干扰物质影响下准确度均通过了验证。
已有部分研究证明,血清VEGF诊断肺鳞癌[13]、结直肠癌[14]的灵敏度较高。本研究结果显示,相比于良性病变患者及健康人群,恶性肿瘤患者血清VEGF水平显著升高,VEGF诊断恶性肿瘤的灵敏度为0.69,特异度为0.95,AUC为0.90,提示血清VEGF对于恶性肿瘤有着较高的筛查价值。CHIN等[15]在2003年就提出血清VEGF水平升高是结直肠癌患者术后复发的独立危险因素,并且TKACZ等[16]也提出在恶性肿瘤早期,VEGF水平在患者血清中升高。本研究结果也发现,癌症组患者VEGF水平显著高于健康对照组和良性疾病组(P<0.05),这初步提示可以将血清VEGF作为诊断恶性肿瘤的辅助指标,结合患者影像学及其他肿瘤标志物,将有助于进一步提高诊断恶性肿瘤的特异度和灵敏度。
本研究也存在一定局限性。(1)入组样本数较少,尚需进一步入组更多临床样本,探讨VEGF在恶性肿瘤鉴别诊断中的价值;(2)未收集患者随访数据,在后续研究中笔者将补充癌症组临床资料,评价VEGF在预测疾病预后中的价值。
综上所述,本研究所采用的磁微粒化学发光法检测VEGF水平不仅成本低、操作简单,且灵敏度高、稳定性好,适合临床常规工作,对于协助恶性肿瘤的诊断有一定价值。