安胃汤抑制CAG大鼠PD-1/PD-L1信号轴免疫逃逸机制研究
陈 丽,宋泓燕,谭程匀,蒋婳影,甘秀凤,卜 磊,韦 维,林寿宁
陈丽,宋泓燕,谭程匀,蒋婳影,甘秀凤,卜磊,韦维,广西中医药大学 广西壮族自治区南宁市 530200
林寿宁,广西中医药大学瑞康医院消化内科 广西壮族自治区南宁市 530011
0 引言
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是消化系统的常见病、难治病、多发病,发病率与年龄相关[1].“正常黏膜-浅表性胃炎-萎缩性胃炎-肠上皮化生-异型增生-胃癌”这一病理过程称为Correa级联反应[2],是目前广泛被接受的胃癌发病模式,其中肠上皮化生与异型增生均为CAG的病理表现,世界卫生组织于1978年将CAG列为癌前疾病.一项队列研究显示1/50的萎缩性胃炎、1/3的肠化生和1/19的异型增生患者会在20年内发展为胃癌[3].2020年全球36种癌症发病率和死亡率调查结果表明: 胃癌是发病率排名第五,死亡率排名第四的世界范围内的一种重要癌症,其中东亚为胃癌高发区[4].胃癌是我国常见的致死性恶性肿瘤,早期胃癌5年生存率超90%,进展期胃癌治疗后5年生存率低于30%,但基于我国国情,胃癌早诊率较低;手术切除是目前胃癌治疗的主流手段,据调查数据显示,仍存在预后差、患者生存率低的缺点[5].免疫逃逸是指肿瘤细胞通过对自身表面抗原的修饰及对肿瘤组织周围环境的改变来逃避机体免疫系统的识别与攻击[6],在肿瘤形成及免疫耐受过程中发挥重要作用,与宿主免疫功能关系密切,程序性死亡受体-1(programmed cell death protein 1,PD-1)、程序性死亡受体配体-1(programmed cell death ligand 1,PDL1)做为免疫检查点在免疫逃逸中扮演重要角色.
为降低胃癌发病率和死亡率,在癌前病变阶段使用药物尽早介入治疗防止癌前病变向胃癌发展显得尤为关键,中医药提倡“未病先防,既病防变”,在CAG治疗上有较好疗效,能实现癌前病变的逆转,值得深度挖掘后推广.安胃汤是在全国名老中医林沛湘教授治疗慢性胃病验方基础上组方而成,方中黄连、干姜为君,师法仲景《伤寒论》半夏泻心汤之辛开苦降之意,寒热并用,合半夏入胃,共奏和胃降逆、燥湿开结、通降气机之功;百合、乌药为臣,养津护胃、行气散寒;白芍、炙甘草为佐,酸甘化阴生津液、柔肝缓急止疼痛;薏苡仁健脾除湿,丹参、木香行气化瘀,共为使药[7].在科技部“十一五”农村适宜技术推广示范研究中,将林沛湘教授治疗馒险胃炎及合并癌前病变经验推广应用研究筛选为卫生适宜技术在广西壮族自治区部分地区进行培训推广,效果良好[8].为进一步研究安胃汤治疗CAG作用机制,本研究通过观察安胃汤干预对CAG模型大鼠PD-1/PD-L1通路关键因子PD-1、PD-L1、CD4+、CD8+因子的影响,分析安胃汤抗CAG,逆转胃癌癌前状态的作用机制.
1 材料和方法
1.1 材料
1.1.1 动物: 84只体质量(140-170) g健康清洁级雄性Wistar大鼠,动物生产许可证号: SCX(苏)2016-0010,购自常州卡文斯实验动物有限公司,使用标准鼠料及水饲养于室温为(23±2) ℃,相对湿度为(75±10)%环境中.研究通过广西中医药大学动物福利伦理委员会批准,审查证明号: DW20191215-035.
1.1.2 药物: 安胃汤中药免煎颗粒(主要成分为半夏、黄连、干姜、百合、白芍、薏苡仁、乌药、丹参、炙甘草,药物构成比为9:5:5:20:20:10:7:15:5)、维酶素片(产自北海阳光药业有限公司,批号: 070318)均由广西中医药大学瑞康医院提供.
1.1.3 主要试剂与仪器: N-甲基-N-硝基-N-亚硝基(MNNG),麦克林试剂有限公司;Trizol试剂,Invitrogen公司;反转录试剂盒,全式金公司;SYBR Green、7000型实时荧光定量PCR系统,ABI公司;TUNEL试剂盒、DAB显色剂,Servicebio公司;anti-PD-1、anti-PD-L1、anti-β-Actin内参抗体、BCA蛋白浓度测定试剂盒、HE染色套装,Solarbio公司;RIPA蛋白裂解液,碧云天;DU2640型紫外分光光度计,Beckman公司;3K220型低温高速离心机,Sigma公司;DF2C型恒压恒流电泳仪,北京六一仪器厂.
1.2 方法
1.2.1 造模方法: 84只大鼠取14只做为正常组常规喂养,剩余70只做为模型组参照文献[9]造模.模型组动物每日仅自由饮用150 μg/mL MNNG溶液联合饥饱失常喂养,另配合每周灌胃45%食用乙醇1 mL/只,持续造模14 wk.分别于8 wk、13 wk随机处死4只动物取材(正常组、模型组各2只)进行病理染色.病理染色确认造模成功后,选择10只正常组大鼠及50只模型组大鼠进行分组给药实验.
1.2.2 分组及给药方法: 60只动物分为正常组、模型组、安胃汤高剂量组、安胃汤中剂量组、安胃汤低剂量组、维酶素组6组,每组10只.14 wk开始,正常组、模型组大鼠每天每只按10 mL/kg标准灌胃生理盐水;安胃汤高、中、低剂量组每天每只分别予16 g/kg、8 g/kg、4 g/kg安胃汤混悬液灌胃;维酶素组每天每只0.4 g/kg维酶素混悬液灌胃,连续给药4 wk.
1.2.3 动物取材: 灌胃给药4 wk后(第18周末),禁食动物12 h处死取胃黏膜组织、采血.部分胃黏膜组织-80 ℃冻存;部分4%多聚甲醛固定,梯度乙醇脱水,石蜡包埋保存.腹主动脉取血分离血清,-20 ℃冻存.
1.2.4 HE染色观察胃黏膜病理学改变: 切取4 μm石蜡切片脱蜡至水,依次入苏木素染液3-5 min、伊红染液5 min,脱水封片进行显微镜镜检,采集图像.
1.2.5 免疫组织化学法检测胃黏膜PD-1、PD-L1表达:切取4 μm石蜡切片脱蜡至水,修复后加入3%双氧水室温避光孵育25 min,滴加3% BSA室温封闭30 min,加入一抗、二抗,DAB显色,细胞核复染,脱水封片后显微镜镜检,采集图像,对光密度值进行半定量分析.
1.2.6 ELISA法检测血清CD4+、CD8+表达: 加入标准品工作液覆膜37 ℃孵育90 min,弃液甩干加入生物素化抗体工作液混匀,37 ℃孵育1 h,洗板3次加酶结合工作液37 ℃孵育30 min,弃液甩干洗板5次加底物覆膜37℃避光孵育15 min左右,标志孔出现明显梯度终止反应,立即用酶标仪在450 nm波长测量各孔光密度值.
1.2.7 qPCR法检测胃黏膜PD-1mRNA、PD-L1mRNA表达: 提取部分冻存胃组织,采用Trizol总RNA试剂盒提取试剂盒提取胃组织总RNA,检测RNA含浓度与纯度(A260/A280=1.8-2.0);采用cDNA合成试剂盒合成cDNA进行逆转录反应,反应条件为: 25 ℃孵育10 min,42 ℃孵育15 min,85 ℃加热5 s灭活,-20 ℃保存;进行PCR反应,反应体系为20 μL,反应条件: 预变性94 ℃30 s,变性94 ℃ 5 s,退火61 ℃ 35 s共40个循环.PCR扩增后,实时荧光定量PCR仪自动分析结果,根据阴性对照调整阈值和基线以确定各个标本的Ct值,并根据熔解曲线确定该Ct值是否有效.以GAPDH作为内参基因,采用2-△△CT法计算各组间mRNA表达水平差异,实验重复3次.引物序列见表1.

表1 PCR引物序列
1.2.8 Western-blot法检测胃黏膜PD-1、PD-L1表达: 提取部分胃组织加入含1mM PMSF的RIPA裂解液,进行匀浆后冰上裂解30 min,4 ℃ 12000 rpm离心10 min取上清,BCA蛋白浓度测定试剂盒检测蛋白浓度,将制备好的目的蛋白进行SDS-PAGE电泳后转移到PVDF膜,封闭2 h后加入一抗β-Actin、PD-1、PD-L1鼠单抗(1:3000)4 ℃孵育过夜,TBST洗涤3次后加入二抗羊抗鼠IgG-HRP(1:3000)室温轻摇1 h,TBST洗涤5次后进行显色、曝光、拍照.以β-Actin为内参,测定目的蛋白及内参蛋白每个条带的灰度值.
统计学处理 所有数据使用SPSS 27.0进行统计分析,结果以mean±SD表示.数据呈正态分布且方差齐时,多组间比较采用ANOVA单因素方差分析,两两比较采用LSD检验;数据呈非正态分布或方差不齐时使用K-W检验;P<0.05或P<0.01均视为差异具有统计学意义.柱状图使用GraphPad Prism 9绘制.
2 结果
2.1 病理染色确认造模结果 光镜下可见胃组织黏膜层变薄,局部黏膜上皮细胞脱落,胃小凹变浅,黏膜肌层及黏膜下层结构紊乱,充血,局部黏膜下层水肿,结缔组织排列疏松,可见较多炎性细胞浸润,肌层大量肌纤维细胞肿胀,胞质疏松淡染,验证造模成功.见图1.

图1 病理染色确认造模结果(HE染色,×200).
2.2 安胃汤对CAG模型大鼠胃黏膜病理形态的影响 光镜下可见正常组胃固有层胃腺丰富,主细胞、壁细胞形态结构正常,未见明显炎症及水肿.模型组胃黏膜层底部胃腺数量减少,黏膜下层重度水肿,结缔组织排列疏松,伴炎性细胞浸润.安胃汤高剂量组胃黏膜各层结构清晰,黏膜上皮完整,胃腺排列紧密,上皮细胞形态正常,肌层结构完整,肌纤维排列规则,未见明显异常改变.安胃汤中、低剂量组和维酶素组可见黏膜层底部胃腺数量减少,结缔组织增生,组织少量出血,炎症反应明显.见图2.结果表明高剂量安胃汤可修复胃黏膜的病理性损伤,减轻炎症反应.

图2 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜病理形态的影响(HE染色,×200).A: 正常组;B: 模型组;C: 安胃汤高剂量组;D: 安胃汤中剂量组;E: 安胃汤低剂量组;F: 维酶素组.
2.3 安胃汤对CAG模型大鼠胃黏膜PD-1、PD-L1表达水平的影响 正常组及安胃汤高、低剂量组与模型组比较,PD-L1表达降低(aP<0.05,bP<0.01),差异有统计学意义.正常组及安胃汤高、低剂量组与维酶素组比较,PD-L1降低(dP<0.01),差异有统计学意义.见图3-5.

图3 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜PD-1表达水平的影响(免疫组化,×200).A: 正常组;B: 模型组;C: 安胃汤高剂量组;D: 安胃汤中剂量组;E: 安胃汤低剂量组;F: 维酶素组.PD-1: 程序性死亡受体-1.
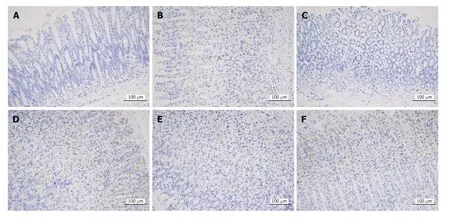
图4 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜PD-L1表达水平的影响(免疫组化,×200).A: 正常组;B: 模型组;C: 安胃汤高剂量组;D: 安胃汤中剂量组;E: 安胃汤低剂量组;F: 维酶素组.PD-L1: 程序性死亡受体配体-1.

图5 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜PD-1、PD-L1表达水平的影响.免疫组化数据表示为mean±SD,n=6,与模型组比较,aP<0.05,bP<0.01;与维酶素组比较,dP<0.01.PD-1: 程序性死亡受体-1;PD-L1: 程序性死亡受体配体-1.
2.4 安胃汤对CAG模型大鼠血清CD4+、CD8+、CD4+/CD8+表达水平的影响 正常组和安胃汤高剂量组与模型组比较,CD4+升高,CD8+表达降低,CD4+/CD8+比值升高(aP<0.05,bP<0.01);安胃汤中、低剂量组及维酶素组与模型组比较,CD8+表达降低(bP<0.01)差异有统计学意义.正常组与维酶素组比较,CD4+升高,CD8+表达降低(dP<0.01),差异有统计学意义.见图6.

图6 安胃汤对慢性萎缩性胃炎模型大鼠血清CD4+、CD8+、CD4+/CD8+表达水平的影响.ELISA数据表示为mean±SD,n=10,与模型组比较,bP<0.01;与维酶素组比较,cP<0.05,dP<0.01.CD4+: 表面有CD4+ T分子的T淋巴细胞;CD8+: 表面有CD8+ T分子的T淋巴细胞.
2.5 安胃汤对CAG模型大鼠胃黏膜PD-1mRNA、PDL1mRNA表达水平的影响 正常组、安胃汤高剂量组及维酶素组与模型组比较,PD-1mRNA表达下降(bP<0.01),正常组及安胃汤高、中剂量组与模型组比较,PDL1mRNA表达下降(aP<0.05,bP<0.01),差异有统计学意义.见图7.

图7 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜PD-1mRNA、PD-L1mRNA表达水平的影响.qPCR数据表示为mean±SD,n=9,与模型组比较,aP<0.05,bP<0.01;与维酶素组比较,cP<0.05.PD-1: 程序性死亡受体-1;PD-L1: 程序性死亡受体配体-1.
2.6 安胃汤对CAG模型大鼠胃黏膜PD-1/Actin、PDL1/Actin表达水平的影响 正常组及安胃汤高、中剂量组与模型组比较,PD-1/Actin、PD-L1/Actin表达下降(aP<0.05,bP<0.01),维酶素组与模型组比较,PD-1/Actin表达下降(aP<0.05);正常组、安胃汤高剂量组与维酶素组比较,PD-L1/Actin表达较低(cP<0.05,dP<0.01),差异有统计学意义.见图8和9.
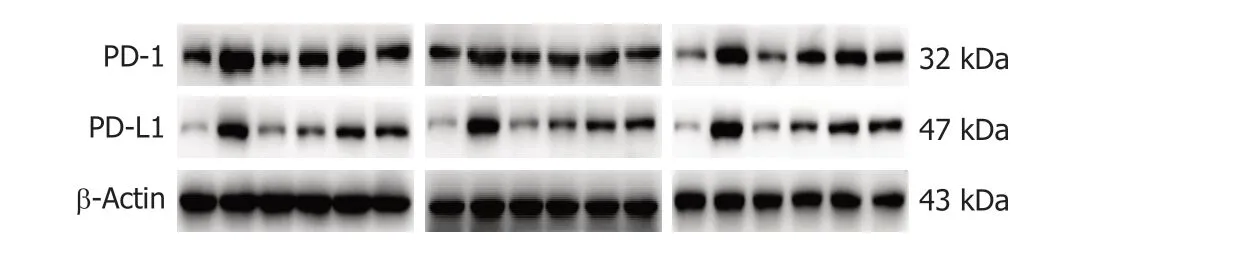
图8 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜PD-1/Actin、PD-L1/Actin表达水平的影响WB条带.条带为3次重复实验结果,条带顺序从左到右依次为正常组;模型组;安胃汤高剂量组;安胃汤中剂量组;安胃汤低剂量组;维酶素组.PD-1: 程序性死亡受体-1;PD-L1: 程序性死亡受体配体-1.

图9 安胃汤对慢性萎缩性胃炎模型大鼠胃黏膜PD-1/Actin、PD-L1/Actin表达水平的影响.Western-blot数据表示为mean±SD,n=10,与模型组比较,aP<0.05,bP<0.01;与维酶素组比较,cP<0.05,dP<0.01.PD-1: 程序性死亡受体-1;PD-L1: 程序性死亡受体配体-1.
3 讨论
CAG是指胃黏膜上皮遭受反复损害导致固有腺体萎缩,伴或不伴肠上皮化生和(或)异型增生的一种慢性炎症性胃部疾病[10].免疫编辑学说将肿瘤发展过程分为三个阶段: 清除期、平衡期、逃逸期,肿瘤细胞在清除期未被完全终止,进入平衡期后经过免疫相持,发生免疫重塑,免疫重塑后的肿瘤细胞避开机体免疫防御形成肿瘤,即肿瘤细胞发生了免疫逃逸,免疫逃逸是肿瘤细胞免疫重塑的结果[11].CAG是胃癌公认的癌前病变,该时期与肿瘤细胞发生免疫重塑及免疫逃逸密切相关,在此阶段尽早干预有利于减少临床肿瘤的发生.
PD-1、PD-L1是常用的免疫检查点,PD-1可表达在活化的T细胞中,通过抑制T细胞活化抑制人体免疫反应[12],在胃癌患者CD8+T表面表达较常人高,与胃癌分期正相关[13].PD-L1属于B7家族,与淋巴细胞凋亡及免疫抑制有关,抗PD-L1可改善机体免疫抑制[14].PD-L1是巨噬细胞在肿瘤组织中增殖、活化、抗肿瘤的负性信号分子[15],在肿瘤细胞中异常高表达,被认为是促进肿瘤免疫逃逸的主要因素[12].PD-L1与PD-1结合可引起T细胞凋亡、无能、耗竭和免疫抑制因子表达升高[16],从而抑制T细胞活性并抑制抗肿瘤免疫,是促进肿瘤细胞免疫逃逸的主要机制.PD-1/PD-L1通路在启动过程中即对T细胞发挥负调控作用,阻断通路激活将改善免疫抑制状态,促进T细胞发挥杀伤作用,延缓肿瘤进展、改善预后[17].T淋巴细胞是细胞免疫最重要的部分,通过各种T淋巴细胞亚群进行免疫调控,T淋巴细胞在免疫平衡期对肿瘤细胞发挥着有效的选择压力,多种免疫系统不足以清除的异变肿瘤细胞产生,当免疫功能受到抑制,平衡被打破时,肿瘤细胞将快速生长并进入逃逸期,进一步抑制免疫系统[18].CD4+T细胞与CD8+T细胞属于外周血T细胞亚群,CD8+T细胞是主要的杀伤性T细胞,同时也是抑制性T淋巴细胞,其含量与免疫抑制正相关;CD4+T细胞是主要的辅助性T细胞,可协助B细胞分泌抗体和调节其它T细胞的免疫应答,CD4+含量及CD4+/CD8+比值下降说明机体处于免疫抑制状态[19].肿瘤微环境中CD8+T的浸润程度与PD-L1、调节性T细胞的积累呈正相关[20],此时免疫抑制处于主导地位.胃癌肿瘤微环境中CD8+T细胞产生的γ-干扰素(interferon-γ,IFN-γ)可上调PD-L1的表达,CD8+T、IFN-γ水平与PD-L1表达呈显著正相关[21],IFN-γ通过诱导PD-1/PD-L1通路进行信号转导使CD8+T和CD4+T细胞耗竭[22],从而促进免疫逃逸.CD8+T上PD-1的表达与CD8+T功能受损和CD4+T计数降低相关[17].限制淋巴细胞功能,抑制机体免疫应答是免疫逃逸的重要策略,中药成分可通过保护淋巴细胞活性、加强抗肿瘤免疫反应抑制免疫逃逸[23].CAG是“炎-癌转化”过程中的关键环节,免疫力低下是其发病根本原因[24],大量研究表明中医药可通过修复胃黏膜组织、改善免疫功能防治甚至逆转CAG[25,26].炎症反应在慢性胃炎疾病进展过程中呈现先高后低,CAG时期炎症反应强烈,胃癌时期炎症反应明显下降,这可能与免疫功能受损致炎症反应减弱相关[27].
项目组前期临床疗效观察研究显示[28]安胃汤可改善患者胃黏膜的炎症反应,促进腺体再生,增加微循环血流,促进局部胃黏膜的修复;安胃汤可以明显改善患者胃黏膜萎缩、肠化生及不典型增生,促进细胞的迁移和损伤的修复[29];安胃汤能CAG患者的临床症状及降低复发率等[30].实验机理研究方面,项目组研究发现,安胃汤通过抑制JAK1/STAT3信号传导通路调节细胞凋亡[31],通过抑制PI3K/Akt信号通路的活性[32],促进CAG模型大鼠胃黏膜萎缩腺体上皮细胞凋亡,促进腺体再生及胃黏膜修复;通过上调CAG模型大鼠胃黏膜Fas、FasL蛋白的表达[33],下调Bcl-2蛋白的表达,对大鼠胃黏膜细胞Fas/FasL信号传导通路的激活进行调控,从而起到抗CAG的作用,其作用机制是否与Fas/FasL-PI3K/Akt-STAT3 细胞信号传导通路下游PD-1/PD-L1信号通路免疫逃逸相关?越来越多的证据表明,PD-L1通过多种机制进行调节,包括基因组改变、表观遗传修饰、转录调节、microRNAs、翻译后修饰和DNA损伤信号传导,以及调节癌症患者免疫抑制的PD-L1相互作用蛋白,其中对PI3K/Akt-STAT3-PD-L1通路的异常活化/失活影响及PD-L1蛋白的翻译后修饰[34].有报道[35]重组人Tripartite基序蛋白28(TRIM28)通过增加PD-L1丰度促进胃癌细胞逃避免疫监视.黄芪四君子汤调节 T 细胞 PD1 泛素化水平重塑肿瘤免疫微环境抑制胃癌增殖[36].本研究发现,经安胃汤干预治疗后,大鼠胃固有腺体数量减少、萎缩等CAG重要病理形态明显改善,炎性细胞浸润减轻,胃黏膜组织及功能得以修复;高剂量安胃汤干预可升高大鼠血清中CD4+的表达,降低血清中CD8+表达,升高CD4+/CD8+的比值水平,提示机体免疫抑制状态扭转,机体免疫应答增强;安胃汤及维酶素片干预均可调低胃组织中PD-1、PD-L1基因和蛋白水平,其中以高剂量安胃汤表现最佳,且在降低PD-L1蛋白水平上,安胃汤组总体表现优于维酶素组,提示PD-1、PD-L1结合减少,PD-1/PD-L1轴介导的细胞免疫逃逸受到抑制.
4 结论
综上,安胃汤抗CAG作用可能与抑制PD-1/PD-L1信号通路诱导的细胞免疫逃逸有关.由于胃黏膜发生癌变过程中各阶段病理状态差异,错综复杂,中药复方抑制PD-1/PD-L1信号轴免疫逃逸抗CAG的机制仍需做进一步探讨.
文章亮点
实验背景
安胃汤为全国名老中医林沛湘治疗慢性胃炎临床验方,多年临床经验显示安胃汤治疗慢性萎缩性胃炎疗效显著.现代药理研究证实安胃汤中的组成药物半夏、黄连及其有效成分均能改善慢性萎缩性胃炎模型动物炎症损伤,被认为是防治慢性萎缩性胃炎的核心药物.前期研究发现,安胃汤通过上调慢性萎缩性胃炎(chronic atrophic gastritis,CAG)模型大鼠胃黏膜Fas、FasL蛋白的表达,对大鼠胃黏膜细胞Fas/FasL信号传导通路的激活进行调控,从而起到抗CAG的作用.当前研究发现,阻断程序性死亡受体-1(programmed cell death protein 1,PD-1)/程序性死亡受体配体-1(programmed cell death ligand 1,PD-L1)信号通路,抑制肿瘤细胞免疫逃逸是治疗胃癌的潜在靶点,尽早使用药物干预治疗有利于实现CAG的逆转,但安胃汤治疗慢性萎缩性胃炎的作用机制是否与其调控PD-1/PD-L1信号通路相关,还有待进一步研究.
实验动机
本实验从免疫逃逸角度出发,探讨安胃汤治疗慢性萎缩性胃炎的作用机制,以期为临床更好地应用该方提供科学依据.
实验目标
本实验通过观察安胃汤对1-甲基-3-硝基-1-亚硝基胍(1-Methyl-3-nitro-1-nitrosoguanidine,MNNG)溶液诱导形成的CAG模型大鼠中PD-1/PD-L1信号通路及相关因子的影响,探究安胃汤治疗CAG的作用机制.
实验方法
本实验构建MNNG诱导的CAG大鼠模型,并给予不同剂量的安胃汤治疗,收集血清和胃黏膜组织,通过HE染色、TUNEL、免疫组化、ELISA、PCR、Western-blot检测评估安胃汤对CAG大鼠胃黏膜细胞形态学、血清中CD4+、CD8+水平以及胃黏膜组织中PD-1/PD-L1信号通路相关基因、蛋白表达水平的影响.
实验结果
安胃汤能降低CAG模型大鼠血清中CD8+表达及胃组织中PD-1、PD-L1基因和蛋白水平,升高大鼠血清中CD4+的表达,升高CD4+/CD8+的比值水平.
实验结论
安胃汤可能通过清除异变的CD8+T细胞,增强机体免疫应答和T细胞杀伤作用,继而降低PD-1、PD-L1表达,阻断因PD-1、PD-L1结合导致的T细胞耗竭,从而改善CAG大鼠症状,发挥治疗作用.
展望前景
本研究为安胃汤的临床应用提供了一定的实验依据.但由于胃黏膜癌变过程错综复杂、变化多端,且中药复方的治疗作用存在多靶点、多层次、多水平的特点,因此需要深入研究以进一步明确安胃汤做为中药复方发挥治疗作用的作用机制.

