泸州产区浓香型白酒酿造微环境-风味相关性分析
贺雨杰,唐雨润,蒋小清,郭晴艳,2*
(1.西华大学 食品与生物工程学院,四川 成都 610039;2.西华大学 食品微生物四川省重点实验室,四川 成都 610039)
中国白酒是一种传统的酒精饮料,拥有2 000多年历史,也是世界六大蒸馏酒之一[1]。根据白酒的主要香气特征,可以将其划分为12种香型,其中浓香型、酱香型、清香型和米香型被广泛认为是四种基本香型。浓香型白酒作为四种基本香型之一,具有窖香浓郁、纯正和谐、香气协调、回味悠长的典型特征,其销售份额约占中国白酒总产量或市场份额的70%,深受广大饮酒者的喜爱[2]。浓香型白酒是以谷物为原料,以浓香型大曲为糖化剂,在窖池内经固态发酵、固态蒸馏、陈酿、勾兑等工序制得的白酒[3]。其原名为泸香型白酒,是根据著名浓香型白酒品牌“泸州老窖”的特点命名的,从20世纪80年代才开始被称为浓香型白酒。根据地区和白酒风格,浓香型白酒可以分为不同流派,包括四川流派、江淮流派和北方流派。四川流派是浓香型白酒的起源地,一半的高质量浓香型白酒品牌都产自该地区[4]。其中,泸州素有“中国酒城”之称,是川酒四大主产区之一,在中国浓香型白酒产业中具有特殊的重要性。
浓香型白酒在开放环境中生产,经不同微生物的代谢产生酒精和香气成分。微生物在白酒风味物质和风味类型的形成中起着决定性的作用,而所有微生物都直接或间接来自于环境并构成了由生产技术和环境生态调节的发酵微环境[5-7]。白酒发酵微环境是白酒发酵环境的重要组成部分,也是影响白酒质量安全和风味特征的重要因素[8]。发酵微环境包括粮食原料在操作过程中直接或间接接触的所有环境,包括但不限于土壤、用水、空气、工人等因素。研究表明,不同地区生产的酱香型白酒发酵谷物中的微生物群落组成有很大差异,这可能是其独特风味的部分原因[9-10]。HU Y L等[11]利用高通量测序技术研究了米香型白酒生产过程中微生物群落的变化,研究表明,各种主要微生物均来自于环境和大米原料,且温度和总酸含量是影响微生物组成的主要物理化学因素。此外,大曲和窖泥均对发酵谷物中的原核生物群落产生影响,窖泥中的厌氧菌可以迁移到糟醅中,并促进有机酸和风味化合物的生成[12]。LIU M K等[13]通过高通量测序对泸州老窖使用了40年和400年的窖池中细菌群落多样性和新颖性展开探究。结果表明,泸州老窖窖泥中的11个优势细菌属可能在中国浓香型白酒生产中发挥重要作用,且产己酸菌属(Caproiciproducens)在400年窖池中丰度显著增加,为泸州地区浓香型白酒特征性风味的形成奠定生物基础。因此,探究浓香型白酒发酵微环境与风味的相关性是提高白酒生产质量和可控性的关键。
本研究采用高通量测序技术分别对泸州产区浓香型白酒厂来源大曲、糟醅和窖泥以及环境样本中的微生物群落进行检测,进一步利用顶空固相微萃取结合全二维气相色谱-质谱联用技术(headspace solid-phase microextractioncomprehensive two-dimensional gas chromatography-mass spectrometry,HS-SPME-GC×GC-MS)检测大曲、糟醅、窖泥和原酒中的挥发性风味物质,基于相关性分析探究泸州产区浓香型白酒微环境与特征性风味的相关性,阐明其作用网络,以期揭示泸州产区浓香型白酒风味密码,为实现浓香型白酒的质量控制奠定理论基础。
1 材料与方法
1.1 材料与试剂
大曲、糟醅、窖泥和原酒样品:取自四川省泸州市3家浓香型白酒厂(分别编号为1、2、3),其中大曲样品采用五点取样法采集曲房内稳定储存的大曲(D1、D2、D3);糟醅样品为对上、中、下3个位置的内层和外层分别取样,混合为1个样品(Z1、Z2、Z3);窖泥样品采用五点取样法分别对窖池四周和中心点取样并混合为1个样品(J1、J2、J3);原酒样品编号为B1、B2、B3;土壤样品取自白酒厂内空地,去除部分可见杂质(RW);水体样品分别取自白酒厂酿造用水(FW)和泸州内长江(RW),各选3个取样点;每个样品采集3个平行样品,取样后使用无菌封口袋密封,经干冰保存运输至实验室,置于-80 ℃冰箱储存。
50×三羟甲基氨基甲烷-乙酸盐-乙二胺四乙酸缓冲液、2×San·Taq聚合酶链式反应(polymerase chain reaction,PCR)预混液、4SGreenPlus无毒核酸染料、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker 2 000:生工生物工程(上海)股份有限公司;2-辛醇(色谱纯):上海麦克林生化科技有限公司;氯化钠(分析纯):福晨化学试剂有限公司;E.Z.N.A.R土壤DNA试剂盒:美国Omega生物技术公司;革兰氏染色液试剂盒:北京索莱宝有限公司;DB蜡质石英毛细管柱、DB-17MS毛细管柱:安捷伦科技有限公司。
1.2 仪器与设备
Easycycle Gradient梯度PCR仪、BDA Box 2凝胶成像分析系统:德国耶拿分析仪器股份公司;DYY-8C双定时电泳仪:北京市六一仪器厂;QP2020NX气质联用仪:岛津(上海)实验器材有限公司;SB-5200DT超声波清洗器:宁波新芝生物科技股份有限公司;57330-U手动固相微萃取进样手柄、57329-U二乙烯基苯/羧基/聚二甲基硅氧烷(divinylbenzene/carbo-xen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头:德国默克公司;WFJ7200紫外分光光度计:尤尼柯(上海)仪器有限公司;PHS-320高精度智能酸度计:成都世纪方舟科技有限公司;QuantiFluorTM-ST荧光计:普洛麦格(北京)生物技术有限公司;固态热调制器HV(c720-21005):雪景电子科技(上海)有限公司。
1.3 方法
1.3.1 基本理化指标测定
根据QB/T 4257—2011《酿酒大曲通用分析方法》对样品pH值、水分、总酸、还原糖以及淀粉含量进行检测。pH值:pH计测定;水分含量:直接干燥法测定;总酸:氢氧化钠滴定法测定;还原糖:直接滴定法测定;淀粉含量:酸水解法测定。
1.3.2 高通量测序
根据E.Z.N.A.R土壤DNA试剂盒操作说明进行微生物DNA提取,分析DNA浓度和纯度,并利用1%琼脂糖凝胶电泳验证DNA完整性。使用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')进行细菌16S rRNA基因序列扩增,其PCR扩增体系包括4 μL 5FastPfu缓冲液、2 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2.5 mmol/L)、0.4 μL FastPfu聚合酶、0.2 μL牛血清白蛋白(bovine serum albumin,BSA)、0.8 μL引物338F(5 μmol/L)、0.8 μL引物806R(5 μmol/L)以及10 ng 模板DNA,并用双蒸水(ddH2O)补充至体系总体积为20 μL,PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,升温至72 ℃延伸45 s,重复30个循环;然后在72 ℃维持10 min以进一步延伸,最后降温至10 ℃并人工终止程序。使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')进行真菌ITS基因序列扩增,其PCR扩增体系包括4 μL 5FastPfu缓冲液、2 μL dNTPs(2.5 mmol/L)、0.4μLrTaq聚合酶、0.2μLBSA、0.8μL引物ITS1F(5μmol/L)、0.8 μL引物ITS2R(5 μmol/L)以及10 ng模板DNA,并用ddH2O补充至体系总体积为20 μL,扩增程序与细菌一致。进一步利用2%琼脂糖凝胶分离和提取扩增产物,通过DNA凝胶提取试剂盒进行纯化,最后利用荧光系统进行定量分析,将符合要求的样品置于-80 ℃储存。
测序得到的原始数据(Raw Reads)通过Trimmomatic v0.33软件进行过滤处理,之后通过cutadapt 1.9.1软件进行引物序列的识别和去除,得到不包含引物序列的高质量序列数(Clean Reads)。使用Usearch v10软件对样品Clean Reads进行拼接,并根据不同区域长度范围进行拼接和长度过滤。去除标签序列以及长度小于200 dp、平均值得分低于20分或含有模糊碱基对的低质量序列。使用QIIME2(版本2020.6)软件对嵌合体序列进行去噪和消除,按照97%成对同一性的阀值将优质序列进行归类,形成最终有效数据去除嵌合体后的序列条数(Non-chimeric Reads)。最后对来自细菌和真菌的操作分类单元(operational taxonomic units,OTU)代表序列使用Silva 138 16S rRNA数据库(http://www.arb-silva.de)和Unite 8.0 ITS数据库(http://unite.ut.ee/)作为相应比较数据库,使用朴素贝叶斯分类器对特征序列进行分类学注释。
1.3.3 挥发性风味化合物测定
采用HS-SPME-GC×GC-MS法检测原酒样品中挥发性风味化合物[14]。
窖泥和糟醅样品预处理:准确称取2.000 g样品、1.500 g氯化钠和5.00 mL蒸馏水,混合,然后转移到15 mL SPME瓶中。将样品置于30 ℃的水浴中超声(240 W)处理30 min,加入20 μL质量浓度为0.822 mg/mL的2-辛醇(蒸馏水溶解)作为内标。为使化合物充分挥发,进一步将样品置于60 ℃的水浴中平衡15 min,然后向该SPME瓶中插入75 μm的DVB/CAR/PDMS涂层的SPME纤维探头,以吸收瓶中的挥发性成分,该吸附过程持续45 min。之后,将该纤维探头插入气相色谱仪的注入口,进行1 min的解吸附。
原酒样品预处理:移取5.00 mL样品于15 mL SPME瓶中,加入3.000 g氯化钠和5 μL 2-辛醇,混合,其他与预处理步骤同上。
GC×GC-MS条件:一维色谱柱由DB蜡质石英毛细管柱(30 m×0.25 mm×0.25 μm)组成,二维色谱柱由DB-17MS毛细管柱(1.2 m×0.18 mm×0.18 mm)组成,应用固态热调制器HV(c720-21005),用高纯氦气(He)(纯度≥99.999%)作为载气,流速为1.0 mL/min。温度程序为40 ℃下保持2 min,之后以6 ℃/min的速度升至230 ℃,同时设置烘箱温度为230 ℃,二维分析时间与一维柱同步,调制周期为4 s。
定性定量分析:通过比较美国国家标准与技术研究所(national institute of standards and technology,NIST)质谱库中参考标准的保留指数和质谱对挥发性化合物进行鉴定;使用内标法对所鉴定的风味物质进行半定量分析[15]。
1.3.4 数据处理
每个实验独立重复3次(n=3)。使用SPSS 25.0软件进行单因素方差分析,然后进行邓肯多重范围检验。采用Excel 2019对风味化合物重复值进行处理。使用OriginPro 2019软件对数据进行图形处理。P值<0.05被用来表示差异显著。
2 结果与分析
2.1 泸州产区浓香型白酒酿造微环境分析
微生物相互作用模式很大程度上取决于它们所处的环境,环境条件的变化可能导致群落协作或竞争性相互作用的改变,同时环境条件的变化也是微生物内部相互作用结果的体现[16-17]。泸州产区浓香型白酒厂来源大曲、糟醅和窖泥的理化指标检测结果见图1。

图1 泸州产区浓香型白酒大曲、糟醅和窖泥样品的理化指标检测结果Fig.1 Physicochemical indexes determination results of strong-flavor Baijiu Daqu, Zaopei and pit mud samples in Luzhou production area
由图1a可知,大曲样品pH值为6.55~6.68,呈弱酸性;糟醅中pH值较低,仅为3.05~3.23,有利于耐酸性菌的筛选和后续发酵优势菌株的形成;窖泥样品的pH值为5.08~5.21,位于大曲和糟醅之间。
酸度是有机酸总量的体现,而有机酸作为窖泥风味分析中的主要物质以及最终香气呈现的前体物质,是衡量窖泥品质的重要指标。窖泥的高酸度使产酸细菌在其内部富集生长,最终成为优势细菌群落,为浓香型白酒特征性风味的形成做出积极贡献。由图1b可知,大曲样品的酸度最低,为0.60~0.73 mmol/10 g;糟醅酸度为1.83~2.20 mmol/10 g;窖泥酸度明显高于大曲和糟醅,达到6.87~7.63 mmol/10 g,大曲内部的弱酸性条件为微生物的适应性生长提供了良好的基础。
由图1c可知,糟醅和窖泥的还原糖含量分别为2.77~3.00 g/100 g、2.77~2.93 g/100 g,大曲中还原糖含量为4.83~6.17 g/100 g,表征大曲较高的糖化能力,可为后续发酵提供充足动能。
由图1d可知,糟醅中水分含量是评价环境湿度和样品质量的重要指标之一,窖泥、大曲的水分含量分别为52.20%~58.13%、8.73%~9.37%,糟醅中水分含量较高,达到48.73%~58.67%,为微生物的生长提供充足的水分条件。
以上结果初步刻画了泸州产区酿造微环境的特点,其合适的pH值、酸度、还原糖以及水分含量有效推动内部微生物区系的构建和稳定繁殖,为该产区浓香型白酒特征性风味的形成奠定坚实的环境基础。
2.2 泸州产区浓香型白酒酿造微环境微生物分析
2.2.1 细菌群落Alpha多样性分析
Chao1指数和基于丰度的覆盖估计值(abundance-based coverage estimator,ACE)指数表征物种丰富度,而Shannon指数和Simpson指数表征物种多样性。对泸州产区浓香型白酒厂来源大曲、糟醅、窖泥样品以及酿造水体、环境水体、厂区土壤样品的微生物菌群进行测序分析,其细菌群落Alpha多样性分析结果见表1。

表1 细菌群落Alpha多样性分析结果Table 1 Alpha diversity analysis results of bacterial community
由表1可知,土壤样品Chao1指数和ACE指数分别为2 662.03和2 663.34,Shannon指数和Simpson指数分别为10.50和1.00,均高于其他样品,表征其细菌群落丰富度和多样性最高。窖泥样品Chao1指数和ACE指数分别为501.14~512.20和509.88~515.89,Shannon指数和Simpson指数分别为6.01~6.47和0.93~0.98,均低于其他样品。此外,酿造水体和环境水体样品中细菌群落丰富度和多样性(Chao1指数分别为1 262.55、2 352.29,ACE指数分别为1 274.27、2 358.57,Shannon指数分别为7.88、9.20,Simpson指数均为0.99)均高于大曲、糟醅和窖泥样品,表明浓香型白酒酿造过程中细菌群落从土壤和水体向大曲、糟醅和窖泥转移的过程中伴随着微生物的演替,其中的优势细菌群落最终占据发酵微环境中的生态位,形成浓香型白酒酿造的优势细菌群。
2.2.2 细菌群落结构分析
基于属水平不同样品的细菌菌群结构以及层次聚类分析热图见图2。由图2a可知,针对所有样品,在属水平上平均相对丰度排名前10的属分别是醋酸乳杆菌属(Acetilactobacillus)、乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、喜热菌属(Caloramator)、水杨酸沉积杆菌属(Sedimentibacter)、白腐菌属(Petrimonas)和部分未分类的梭菌目(unclassified_Clostridiales)、未分类的厚壁菌门(unclassified_Firmicutes)、未分类的瘤胃球菌科(unclassified_Ruminococcaceae)、未分类的细菌(unclassified_Bacteria)。其中,大曲中魏斯氏菌属相对丰度最高,达52.28%。相较于四川其他产区,泸州产区浓香大曲中魏斯氏菌属相对丰度更高,这可能有助于解释泸州产区浓香型白酒的特征性风味[18]。大曲、糟醅和窖泥中均检出较高相对丰度的白腐菌属(分别为6.71%、3.60%和22.79%)。白腐菌属是一种来源于环境的嗜温发酵细菌属,有利于代谢活动的推进并创造适合于发酵的厌氧环境[19],促进窖池发酵阶段合适发酵环境的形成。此外,大曲、糟醅和窖泥中均检测到高丰度的乳杆菌属,分别为6.06%、63.09%和13.51%。研究表明,大曲发酵早期的高酸高温环境主要是由乳杆菌属的代谢活动引起的,有助于大曲微生物群落的自我净化和优势微生物群的形成和稳定[20]。在发酵后期,糟醅中乳酸菌大量富集并代谢产生乳酸,进一步代谢可产生乳酸菌素、有机酸等抗菌物质,有助于酿造微环境的稳定,对后续风味物质的形成与累积至关重要。
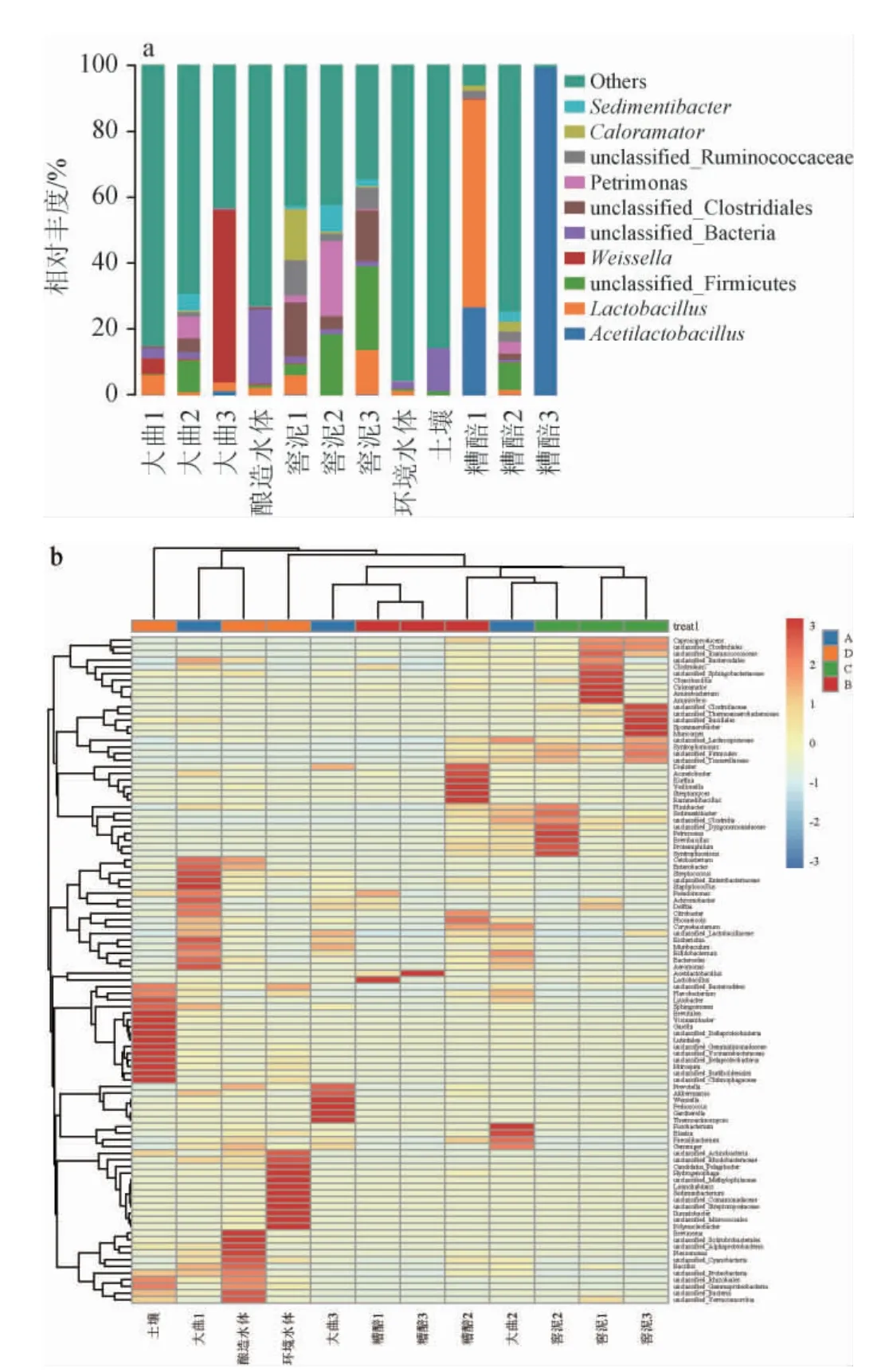
图2 基于属水平不同样品的细菌菌群结构(a)及层次聚类分析热图(b)Fig.2 Bacterial community structure of different samples based on genus level(a)and heat map for hierarchical cluster analysis(b)
在此基础上,针对12个样本中检测到的所有细菌属进行物种丰度聚类分析,结果见图2b。由图2b可知,大曲样品分别与糟醅、窖泥、土壤和酿造用水聚类,表明土壤和水体中微生物向大曲、大曲中微生物向糟醅和窖泥的转移。此外,窖泥样本先与糟醅发生聚类,之后与大曲聚类,最后与水体和土壤聚类,表明在浓香型白酒酿造过程中,土壤和水体中的微生物通过制曲过程向大曲内部迁移,进一步经堆积发酵转移至糟醅内部,最后经窖池内发酵向窖泥内迁移,并在该演替过程中逐渐形成特征性优势细菌群落。
由此可知,在泸州产区特征性生态环境作用下,形成了泸州产区浓香型白酒特征性的酿造微环境,并长时间的演替形成稳定的优势细菌群落,在浓香型白酒酿造过程中相互作用,最终有效推动该产区浓香型白酒特征性风味的形成。
2.2.3 真菌群落Alpha多样性分析
泸州产区浓香型白酒厂来源大曲、糟醅、窖泥样品以及酿造水体、环境水体、厂区土壤样品中真菌群落Alpha多样性分析结果见表2。由表2可知,土壤样品Chao1指数和ACE指数分别为664.13和664.87,均高于其他样品,表征其具有最高的物种丰富度,窖泥样品次之(Chao1指数和ACE指数分别为510.44~525.87和522.78~536.67)。此外,大曲样品Shannon指数和Simpson指数分别为7.33~7.80和0.99,为所有样品中最高,表明其物种多样性最高,土壤样品次之(Shannon指数和Simpson指数分别为7.43和0.98)。由此可知,大曲制作过程中的半开放环境使来自环境、原料等的各种真菌在其内部富集,为浓香型白酒的酿造提供生物基础。
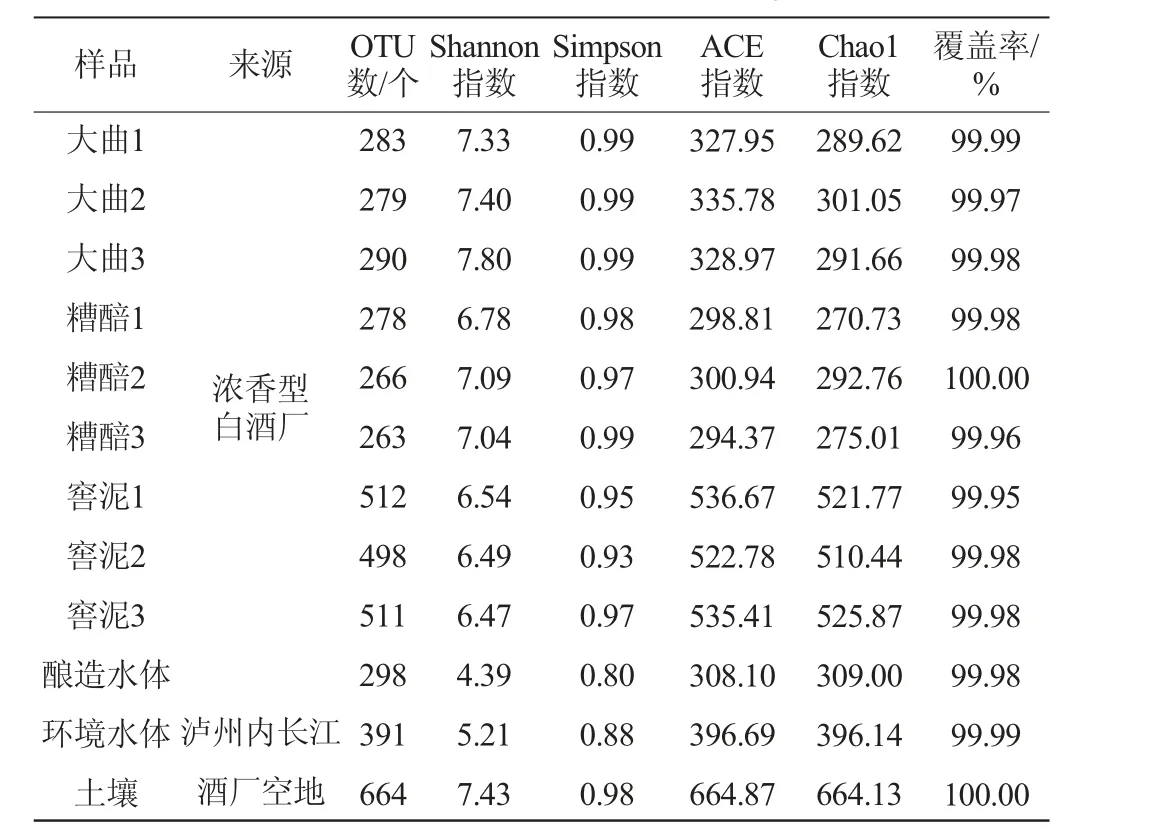
表2 真菌群落Alpha多样性分析结果Table 2 Alpha diversity analysis results of fungal community
2.2.4 真菌群落结构分析
基于属水平不同样品的真菌菌群结构以及层次聚类热图见图3。由图3a可知,针对所有样品,在属水平上平均相对丰度排名前10的属分别是嗜热子囊菌属(Thermoascus)、曲霉属(Aspergillus)、木霉属(Trichoderma)、迈耶氏酵母属(Meyerozyma)、根毛霉属(Rhizomucor)、哈萨克斯坦酵母属(Kazachstania)、篮状菌属(Talaromyces)、嗜热丝孢菌属(Thermomyces)未分类真菌(unclassified_Fungi)以及未分类菌属(unidentified)。

图3 基于属水平不同样品的真菌菌群结构(a)及层次聚类分析热图(b)Fig.3 Fungal community structure of different samples based on genus level(a)and heat map for hierarchical cluster analysis(b)
所有样品中均检出嗜热子囊菌属,且在大曲、窖泥和糟醅中相对丰度分别达到93.64%、36.27%和28.86%。嗜热子囊菌属代谢产生的木聚糖酶可耐受浓香型白酒发酵的高温环境并保持较高的催化效率,保证发酵过程中的高淀粉利用率,有效提高出酒品质[21]。研究发现,四川遂宁产区和泸州产区大曲真菌群落中嗜热子囊菌属丰度存在显著差异[18]。所有样品中均检出曲霉属,在大曲、窖泥、糟醅中的相对丰度分别达到28.25%、21.59%和14.41%,其代谢产生的酯化酶和糖化酶可有效推动浓香型白酒风味前体物质的形成。但是,与江淮产区大曲真菌群落相比,泸州产区大曲中曲霉属丰度较低,这可能与不同地区制曲环境温度有关[22]。此外,糟醅中的优势菌属是哈萨克斯坦酵母属,相对丰度高达32.99%,其有利于发酵过程中乙醇的产生和有机酸的积累[23]。据报道,泸州产区糟醅中哈萨克斯坦酵母属丰度与水分含量显著相关[24],一定程度上解释了发酵环境与微生物筛选的相关性。窖泥中的优势菌属是迈耶氏酵母属,相对丰度高达34.44%,其多来源于环境。梁欢[25]比较了泸州产区和北方产区窖泥真菌群落,发现其优势菌株存在明显的地区差异性,其中迈耶氏酵母属差异显著,这可能是由于不同地区环境差异所导致的。
由图3b可知,不同种类样品聚类不明显,大曲、糟醅和窖泥的真菌群落相似性较高,而水体和土壤样本中真菌群落有显著差异。由此可知,在泸州产区浓香型白酒酿造过程中,水体和土壤来源真菌向大曲、糟醅和窖泥中迁移并经长时间的演替,最终形成特征性真菌群落,且其优势真菌菌群在不同酿造微环境中具有相似性,表征优势真菌群落的稳定性,保证了泸州产区浓香型白酒特征性风味的形成。
因此,具有最高物种多样性的大曲是泸州产区浓香型白酒酿造微环境中真菌群落富集与演替的基础,并进一步向糟醅和窖泥中迁移,对特征性真菌群落的形成和稳定具有重要作用,进一步保证了该产区浓香型白酒特征性风味的形成。
2.3 泸州产区浓香型白酒挥发性风味化合物分析
基于HS-SPME-GC×GC-MS对泸州产区浓香型白酒厂来源大曲、窖泥、糟醅及原酒的挥发性风味物质进行检测,结果见图4。由图4可知,共检测到182种挥发性风味化合物,包括68种酯类、27种醇类、23种酸类和64种其他化合物,其他化合物中包括少量酚类、醛类、酮类、吡嗪类、吲哚类和萜烯类化合物。

图4 泸州产区浓香型白酒各类别挥发性风味化合物相对含量(a)和聚类分析热图(b)Fig.4 Relative contents of various categories volatile flavor compounds in strong-flavor Baijiu from Luzhou producing area (a) and cluster analysis heat map (b)
由图4a可知,不同样本中风味化合物类别存在显著差异,其中酯类在窖泥中相对含量最高,达到78.63%,其次是糟醅,相对含量达到54.96%。醇类在大曲中相对含量最高,达到43.57%,而酸类在糟醅中相对含量最高,达到24.65%。
在此基础上,进一步针对不同样品中风味化合物进行分层聚类分析,结果见图4b。由图4b可知,原酒中的主要风味化合物是酯类和醇类,相对含量分别高达36.05%和27.45%,其中主要包括己酸乙酯(19.18%)、棕榈酸乙酯(9.20%)、己酸己酯(2.40%)、乙醇(8.78%)、丁醇(3.68%)、己醇(2.73%)、戊醇(1.61%)等。大曲中相对含量较高的是己酸乙酯(22.12%)、己酸己酯(17.16%)、丁酸乙酯(3.53%)、1-辛烯-3-醇(13.82%)、2,3-丁二醇(6.42%)、乙醇(4.05%)等。糟醅中的主要风味化合物是酸类和酯类物质,其中己酸乙酯(19.16%)、棕榈酸乙酯(9.46%)、辛酸乙酯(6.29%)、己酸己酯(5.98%)、己酸(13.21%)、戊酸(2.97%)、辛酸(2.80%)和乙酸(1.90%)相对含量较高。此外,糟醅中乳酸乙酯(0.86%)相对含量明显提高,这可能是由于开放式发酵对乳酸的堆积引起的[26]。窖泥中以酸类和酯类为主,其中乳酸乙酯(0.08%)相对含量明显低于糟醅,其可能与厌氧发酵微生物的优势生态位相关。由此可知,酿造环境的动态变化对原酒风味的原始积累有较强的相关性[27]。
己酸乙酯主要由酵母对酸类和醇类物质的酯化反应生产,为浓香型白酒提供重要的窖香,是评价浓香型白酒质量的关键指标之一。大曲、糟醅、窖泥和原酒中己酸乙酯的相对含量分别为22.12%、19.16%、14.95%和19.18%,表征其在浓香型白酒酿造过程中发生的转化与演替。醇类在风味描述中多给人以复杂圆润的香气体验,被描述为具有坚果、香蕉的香气。泸州产区浓香型白酒原酒中丰富的乙醇、丁醇、己醇、戊醇、丙醇、糠醇等醇类对其绵柔口感具有重要意义。泸州产区浓香型白酒原酒中酸类的主要贡献来自于己酸(12.93%)、乙酸(2.72%)、丁酸(2.04%)、戊酸(0.68%)、丙酮酸(0.57%)、辛酸(0.23%)、庚酸(0.15%)和乳酸(0.07%),对白酒风味有明显的调和作用,也是酯类代谢过程中重要的前体物质。此外,原酒中还检测出微量的醛类、吡嗪类和吲哚类化合物。微量风味化合物在整体所占比例小,但其感官阈值高,为浓香型白酒的风味感受提供关键的调和作用。
由此可知,泸州产区浓香型白酒酿造微环境中微生物群落的演替伴随着酯类、醇类、酸类等风味化合物的转化。酯类是所有样品中的首要风味化合物,赋予浓香型白酒甜味和果味,同时弱化氨基的苦味和脂肪酸的辛辣味,对泸州产区浓香型白酒的特征性风味意义重大。其中,己酸乙酯、丁酸乙酯、油酸乙酯、乳酸乙酯、苯乙酸乙酯等均具有重要贡献。此外,己醇、丁醇、异戊醇、乙酸、己酸、丁酸等关键差异性风味化合物在不同样本中的转化与演替共同刻画了浓香型白酒风味的形成过程。
2.4 泸州产区浓香型白酒酿造微环境-风味相关性分析
为进一步探究酿造微环境对泸州产区浓香型白酒风味的影响,分别对理化指标、微生物属与挥发性风味物质进行Pearson相关性分析,结果见图5。

图5 泸州产区浓香型白酒挥发性风味物质与理化指标(a)、微生物属(b)的相关性分析结果Fig.5 Results of correlation analysis between volatile flavor compounds and physicochemical indexes (a) and microbial genera (b)
由图5a可知,水分含量和酯类呈正相关,与酸类呈负相关。还原糖是代谢中的主要能量供给,其与酸类和醇类呈正相关,与大部分酯类呈负相关。进一步针对测序得到的丰度较高的细菌属和真菌属,通过Pearson相关系数与主要挥发性风味化合物进行相关性分析可知,细菌群落与风味化合物的相关性强于真菌(图5b)。其中,白腐菌属(Petrimonas)、喜热菌属(Caloramator)、水杨酸沉积杆菌属(Sedimentibacter)以及未分类的厚壁菌门(unclassified_Firmicutes)、瘤胃球菌科(unclassified_Ruminococcaceae)、未分类的梭菌目(unclassified_Clostridiales)与棕榈酸乙酯、辛酸乙酯、庚酸乙酯、庚酸具有明显的正相关关系,而与丁酸乙酯、乳酸乙酯呈负相关。醋酸乳杆菌属(Acetilactobacillus)、乳杆菌属(Lactobacillus)与庚醇、丙醇、乙酸、丁酸、辛酸、戊酸呈正相关,而与庚酸乙酯、辛酸乙酯呈负相关。真菌群落与关键酯类和酸类化合物具有相关性,其中嗜热子囊菌属(Thermoascus)、木霉属(Trichoderma)、迈耶氏酵母属(Meyerozyma)、根毛霉属(Rhizomucor)与己酸乙酯、丁酸乙酯、庚酸乙酯呈正相关关系,曲霉属(Aspergillus)、木霉属(Trichoderma)、篮状菌属(Talaromyces)与丙醇、乙酸、丁酸、辛酸、戊酸呈正相关。
由此可知,控制浓香型白酒酿造微环境理化特性有助于风味化合物的形成与累积,其中高pH值、低水分含量有助于醇类和酸类物质的形成,而低pH值、低酸度、高水分含量有助于酯类物质的形成。此外,白腐菌属、喜热菌属、水杨酸沉积杆菌属以及部分未分类的厚壁菌门、瘤胃球菌科和梭菌目有助于泸州产区浓香型白酒中酯类风味化合物的形成,乙酰乳杆菌属、乳杆菌属、嗜热子囊菌属、木霉属和篮状菌属有助于醇类和酸类风味化合物的形成。在合适的理化性质与优势微生物群落的共同作用下,泸州产区浓香型白酒特征性风味得以稳定与协调。
3 结论
本研究采用高通量测序技术和HS-SMPE-GC×GC-MS对泸州产区浓香型白酒厂来源大曲、窖泥、糟醅以及原酒酿造微环境的微生物菌群结构及挥发性风味物质进行分析。进一步结合Pearson相关性分析阐明该地区浓香型白酒酿造微环境与特征性风味的相关性。结果表明,土壤样本中的微生物群落丰富度和多样性均高于大曲、糟醅和窖泥样本,表征酿造微环境中微生物群落的演替过程。魏斯氏菌属和嗜热子囊菌属分别是大曲中丰度最高的细菌属和真菌属,同时也是泸州产区大曲区别于其他产区大曲的主要菌属,为泸州产区浓香型白酒特征性风味形成奠定物质基础。大曲、糟醅、窖泥和原酒中风味化合物主要包括酯类、醇类和酸类,但不同样本中风味化合物含量差异显著。Pearson相关性分析表明,酿造微环境理化性质和微生物群落与白酒风味形成相关,且细菌群落与挥发性风味化合物的相关性强于真菌群落。其中,白腐菌属、喜热菌属、水杨酸沉积杆菌属等有助于酯类风味化合物的形成,乙酰乳杆菌属、乳杆菌属、嗜热子囊菌属等有助于醇类和酸类风味化合物的形成。本研究为泸州产区浓香型白酒特征性风味的形成提供了理论依据,同时为后续浓香型白酒的质量控制与优化提供参考。

