副结核分枝杆菌免疫原蛋白的筛选及免疫保护效果评价
陈凡若,张嘉俊,鹿萍,崔宁,崔莹莹,崔子寅,党光辉,刘思国
中国农业科学院哈尔滨兽医研究所/动物疫病防控全国重点实验室,哈尔滨 150069
0 引言
【研究意义】副结核病(paratuberculosis,PTB)是一种由副结核分枝杆菌(Mycobacteriumaviumsubsp.paratuberculosis,MAP)引起的反刍动物慢性消耗性疾病,能够引起患病动物持续性腹泻和肉芽肿性肠炎[1]。近年来,由于养殖业规模的扩增,PTB 的发病率也随之增加,在内蒙古等多个地区发现[2]。由于动物患上PTB 后会导致其生产性能下降、饲料转化效率降低、产奶量下降、对其他疾病的易感性增加以及过早淘汰导致的饲养成本增加,养殖业遭受极大的经济损失[3-5]。目前,由于商用的PTB 灭活疫苗存在干扰牛结核病的检测、导致注射部位损伤、保护率低等弊端,因此迫切需要开发PTB 新型疫苗[6-7]。【前人研究进展】目前,已经有一些关于MAP 的免疫原性蛋白的研究报道,如 P22、MAP1272c、Ag85C(MAP3531c)、MAP3783 和MAP3701c,这些蛋白均具有作为候选亚单位疫苗的潜力。P22 是MAP 分泌的一种脂蛋白,与油包水佐剂混合,经皮下免疫绵羊可诱导良好的IFN-γ 和抗体反应[8-9]。MAP1272c 是一种细胞壁相关的水解酶,用MAP1272c 与MAP1087、MAP1204、MAP2077c 混合制成的抗原鸡尾酒免疫犊牛,能够降低新生犊牛的MAP 感染率和粪便中MAP的脱落[10]。Ag85C 属于Ag85 蛋白家族,是高度保守的蛋白质[11]。有研究发现,牛群和小鼠经口感染MAP的过程中,Ag85 是免疫优势T 细胞抗原,可以诱导快速强烈的T 细胞增殖和IFN-γ 的分泌[11]。MAP3783是一种保守的假定ESAT-6 样蛋白,MAP3701c 是一种热休克蛋白。用MAP3701c、MAP3783 和MAP1508混合制成的抗原鸡尾酒免疫牛,促进IFN-γ 和抗体的释放分泌水平上升,且免疫效果稳定,不受年龄的增长而变化[12]。【本研究切入点】多种融合蛋白能够增加对MAP 的保护效果。常用的方法是在单一疫苗中使用多种蛋白抗原形成抗原鸡尾酒,以及将多种抗原相互连接,形成融合蛋白。据报道,MAP3527 和MAP1519 构建的融合蛋白74F,以及MAP3527 和Ag85B 构建的重组蛋白66NC,均对MAP 感染有着良好的保护作用[13-14]。【拟解决的关键问题】本研究拟对MAP 的p22、map1272c、map3531c、map3783、map3701c以及map3527这6 个基因,表达5 种融合蛋白58F、62F、69F、46F 和52F,通过IFN-γ ELISPOT实验筛选出最佳免疫原;随后将最佳候选免疫原和已报道的66NC 混合,通过IFN-γ ELISPOT 试验、监测抗体滴度、血清细胞因子,以及检测感染后免疫小鼠的体重变化、病理学和组织病理学观察以及组织荷菌数,综合评价候选亚单位疫苗的免疫原性和免疫保护效果,从而筛选出效果较好的候选亚单位疫苗,为PTB的有效防控奠定基础。
1 材料与方法
试验于2022 年5 月至 2023 年2 月在中国农业科学院哈尔滨兽医研究所完成。
1.1 实验动物
6 周龄C57BL/6 雌性小鼠购自辽宁长生生物技术有限公司,饲养于中国农业科学院哈尔滨兽医研究所动物实验中心。
1.2 载体与菌株
pET28a-3527N-3527C 和pET28a-3527N-Ag85B-3527C 载体由中国农业科学院哈尔滨兽医研究所动物疫病防控全国重点实验室保存。MAP K-10 菌株也是由该实验室保存。
1.3 引物
参考GenBank中MAP的p22、map1272c、map3531c、map3783以及map3701c的基因序列,利用Snapgene软件设计特异性引物 p22-F/R、map1272c-F/R、map3531c-F/R、map3783-F/R 以及map3701c-F/R。根据参照文献[15]合成MAP K-10 的荧光定量PCR 所用引物和探针。引物由吉林省库美生物科技有限公司和美国ABI 公司合成(表1)。

表1 特异性引物和探针Table 1 Specific primers and probes
1.4 主要试剂
PrimerSTAR Max 聚合酶、Premix Ex TaqTM(Probe qPCR)购自日本Takara 公司;小鼠IL-17A/ IFN-γ/TNF-α ELISA 检测试剂盒购自美国Thermo Fisher Scientific 公司;Ni Sepharose 6 Fast Flow 购自美国GE 公司;MONTANIDE ISA 61 VG 佐剂购自法国赛比克公司;小鼠脾脏淋巴细胞分离液试剂盒购自天津灏洋生物制品有限公司;Mouse IFN-γ Precoated ELISPOT Kit 购自北京达科为生物技术有限公司;Goat pAb to Mouse IgG/IgM/IgG1/IgG2a 购自英国Abcam 公司;Middlebrook 7H9 培养基购自美国BD公司。
1.5 融合蛋白的构建、表达与制备
以提取的MAP K-10 参考株基因组DNA 为模板,分别用 p22-F/R、map1272c-F/R、map3531c-F/R、map3783-F/R 以及map3701c-F/R 引物扩增5 种基因,将其分别克隆于pET28a-3527N-3527C 载体,构建5种重组质粒,并转化E.coliBL21 诱导表达,根据蛋白分子量大小将重组蛋白分别命名为58F、62F、69F、46F 和52F。以可溶形式表达的58F、62F 和52F 经Ni 柱亲和层析纯化;以包涵体形式表达的69F 和46F进行变性与复性,经Ni 柱亲和层析纯化。将pET28a-3527N-Ag85B-3527C 转化E.coliBL21 诱导表达,经Ni 柱亲和层析纯化,获得66NC。测定蛋白浓度,-80℃保存备用。
1.6 动物免疫与感染
1.6.1 疫苗制备 重组蛋白免疫组:重组蛋白分别与MONTANIDE ISA 61 VG 佐剂以1∶1.5 的比例乳化;61 VG 对照组:取与蛋白等体积的无菌 PBS 与MONTANIDE ISA 61 VG 佐剂以1∶1.5 的比例乳化;MAP K-10 灭活疫苗对照组:取适量MAP K-10,用灭菌水洗涤并重悬后,转移至EP 管中,置于80℃水浴锅中灭活30 min。在超净台中风干MAP K-10,待菌液完全风干后,对MAP K-10 粉末进行称重,室温保存备用。取适量无菌PBS 重悬热灭活风干后的MAP K-10 粉末,使其终浓度为5 mg·mL-1,与MONTANIDE ISA 61 VG 以1∶1.5 的比例进行乳化。室温置于高通量组织研磨仪中进行乳化。高通量组织研磨仪的程序设置为:频率20 次/s,工作时间20 min。吸取乳化后的液体滴至水面,液滴不立即弥散即为乳化成功。
1.6.2 动物分组 候选亚单位疫苗的筛选试验:21 只雌性C57BL/6 小鼠分为7 组,每组3 只,分别为61 VG 对照组、66NC 对照组、58F 免疫组、62F 免疫组、69F 免疫组、46F 免疫组和52F 免疫组;候选亚单位疫苗的免疫原性与保护效果评价试验:68 只雌性C57BL/6 小鼠分为4 组,分别为61 VG对照组(16 只)、MAP K-10 灭活疫苗对照组(16只)、58F 免疫组(18 只)和66NC+58F 免疫组(18只)。
1.6.3 动物免疫与感染 61 VG 对照组每只小鼠注射100 μL PBS;MAP K-10 对照组每只小鼠注射500 μg(100 μL)热灭活的MAP K-10;58F、62F、69F、46F、52F、66NC、66NC+58F 免疫组每只小鼠注射50 μg(100 μL)相应蛋白。接种途径为背部皮下多点注射。小鼠共免疫两次,间隔3 周。二免3 周时用MAP K-10 菌株通过腹腔注射感染除空白对照组以外的小鼠,MAP K-10 菌株用无菌PBST 重悬,浓度为1×109CFU/mL,每只小鼠注射100 μL。MAP K-10 菌株的感染方式和剂量参照文献[14]。
1.7 IFN-γ ELISPOT 试验
小鼠二免3 周时,使用小鼠脾脏淋巴细胞分离液试剂盒提取小鼠脾淋巴细胞,使用Mouse IFN-γ Precoated ELISPOT Kit 检测脾脏淋巴细胞分泌的IFN-γ 的细胞量,具体步骤参照使用说明书进行操作。
1.8 ELISA 监测血清特异性抗体
二免3 周、感染2 周和4 周时对各组小鼠采血,收集血清,进行1∶20、1∶40 等作2 倍倍比稀释,至1∶409 600,-20 ℃保存。取96 孔板,用相应抗原包被后,每孔分别加入100 μL 不同稀释度的血清样本,室温孵育并洗板后,用PBST 溶液对Goat anti mouse IgG、IgM、IgG1和IgG2a进行1∶10 000 倍稀释,每孔分别加入100 μL,室温孵育并洗板后,在避光条件下每孔加入TMB 显色液,孵育显色后用2 mol·L-1硫酸终止反应,用酶标仪在OD450处检测光吸收值。IgG 和IgM 的滴度为阳性OD450/阴性OD450值≥2.0时的最大血清稀释度。
1.9 ELISA 监测血清细胞因子水平
二免3 周、感染2 周与4 周时对各组小鼠采血,使用小鼠IL-17A/ IFN-γ/ TNF-α ELISA 检测试剂盒检测血清细胞因子水平,具体步骤参照使用说明书进行操作。
1.10 体重检测
记录小鼠感染前和感染2 周的体重,并计算感染2 周小鼠的体重增长率。
1.11 病理学和组织病理学观察
脱颈处死感染4 周小鼠,在超净台中解剖小鼠,分离小鼠肝脏,拍照记录肝脏上结节和宏观病变,并根据肝脏表面结节面积百分比做病理学打分。取感染4 周小鼠肝脏尾状叶,于组织固定液中固定,送至中国农业科学院哈尔滨兽医研究所病理实验室制备病理切片进行H·E 染色,观察组织病理学变化,并根据肝脏肉芽肿面积百分比进行组织病理学打分。病理学打分遵循以下原则,肝脏表面结节面积百分比打分如下:0=无,1=≤1%,2=>1%和≤3%,3=>3%和≤5%,4=>5%和≤7%,5=>7%和≤9%,6=>9%和≤11%,,7=>11%和≤13%,8=>13%和≤15%,9=>15%和≤17%,10=>17%和≤19%,11=>19%和≤21%,12=>21%和≤23%,13=>23%和≤25%,14=>25%和≤27%,15=>27%和≤29%。根据肉芽肿面积百分比对肝脏进行组织病理学打分:0=无;1=≤10%;2=>10%和≤15%;3=>15%和≤20%;4=>20%和≤30%;5=>30%和≤40%;6=>40%和≤50%。
1.12 qPCR 检测组织荷菌数
研磨感染4 周的小鼠肝脏,用细菌基因组DNA提取试剂盒提取细菌DNA,测定细菌DNA 的浓度,将细菌基因组DNA 置于-20 ℃保存备用。取标准品MAP 基因组DNA 进行倍比稀释,制成标准品模板。以DNA 酶处理过的灭菌水为阴性对照,进行TaqMan荧光定量PCR。由QuanStudioTMDesign & Analysis Software v1.4.3 分析绘制标准曲线。根据标准曲线计算小鼠肝脏荷菌数。
2 结果
2.1 6 种融合蛋白的构建与亲和层析纯化
用MAP 的p22、map1272c、map3531c、map3783、map3701c和map3527基因根据重组质粒模式图构建5 种重组质粒(图1-a)。将鉴定正确的5 种重组质粒和 pET28a-3527N-Ag85B-3527C 转化E.coliBL21,经过诱导表达、Ni 柱亲和层析纯化,获得6种融合蛋白58F、62F、69F、46F、52F 和66NC(图1-b)。

图1 重组质粒模式图(a)与SDS-PAGE 检测58F、62F、69F、46F 和52F 蛋白的纯化情况(b)Fig. 1 Pattern of recombinant plasmid (a) and affinity chromatographic purification of 58F, 62F, 69F, 46F, and 52F proteins detected by SDS-PAGE (b)
2.2 IFN-γ ELISPOT 试验筛选候选免疫原
为了筛选能够诱导较强免疫应答的抗原,分离二免3 周小鼠脾淋巴细胞,进行IFN-γ ELISPOT 试验。结果显示:与MONTANIDE ISA 61 VG(61 VG)对照组相比,58F 免疫组小鼠脾淋巴细胞分泌的IFN-γ的细胞量显著高于61 VG 对照组与62F、69F、46F 和52F 免疫组(P<0.001),并且与阳性对照66NC 免疫组无显著差异(图2)。以上结果表明,5 种重组蛋白中,58F 能够诱导强烈的IFN-γ 免疫反应,是免疫效果更好的候选抗原。
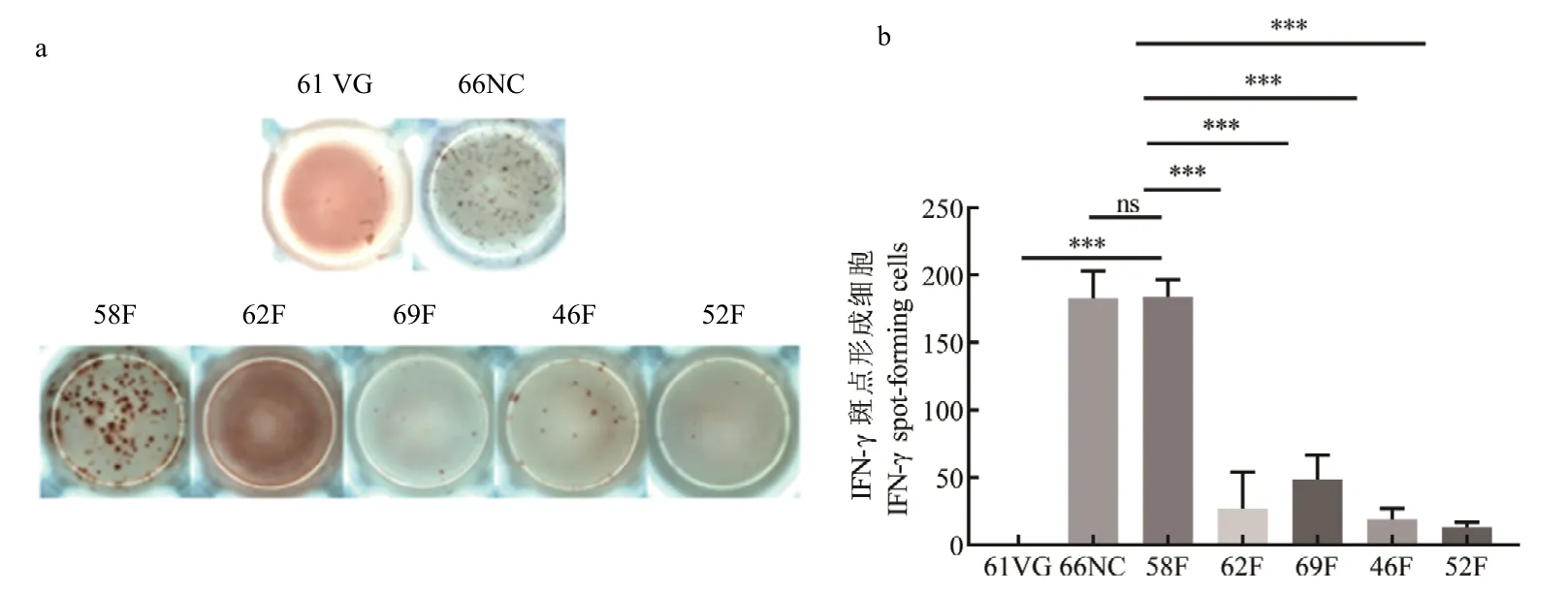
图2 酶联斑点分析仪检测抗原刺激脾淋巴细胞后IFN-γ 表达情况Fig. 2 The expression of IFN-γ in spleen lymphocytes stimulated by antigen was detected by ELISPOT
2.3 融合蛋白58F 和66NC+58F 的免疫原性分析
为了比较融合蛋白58F 和66NC+58F 的免疫水平,分离二免3 周小鼠的脾淋巴细胞,进行IFN-γ ELISPOT 试验,并收集二免3 周小鼠的血清,ELISA检测血清细胞因子IFN-γ、TNF-α 和IL-17A 和IgG1、IgG2a抗体水平(图3)。结果显示:与61 VG 对照组和MAP K-10 对照组相比,66NC+58F 免疫组小鼠的脾淋巴细胞分泌IFN-γ 的细胞量非常显著增加(P<0.01);58F 免疫组小鼠的脾淋巴细胞分泌IFN-γ 的细胞量高于对照组,但无显著性差异(P>0.05);66NC+58F 免疫组高于58F 免疫组,但无显著性差异(P>0.05)(图3-a、图3-b)。与两个对照组和58F免疫组相比,66NC+58F 免疫组分泌的IFN-γ、TNF-α和IL-17A 显著增加(P<0.05)(图3-c)。与61 VG对照组和MAP K-10 对照组相比,58F 和66NC+58F免疫组的IgG1和IgG2a水平均显著增高(P<0.05),但两组无显著性差异(P>0.05)(图3-d、图3-e)。以上结果表明,融合蛋白66NC+58F 能够诱导更高的Th1、Th17 型免疫反应和抗体水平,是免疫效果更好的候选抗原。

图3 二免3 周融合蛋白58F 和66NC+58F 的免疫原性分析Fig. 3 Immunogenicity analysis of fusion protein 58F and 66NC+58F at 3 weeks of secondary immunization
2.4 ELISA 监测血清特异性抗体
为了监测融合蛋白58F 和66NC+58F 诱导的抗体水平,首免后每2 周对各组小鼠进行采血,通过ELISA检测免疫至感染期间IgG 和IgM 抗体水平(图4)。结果显示:与MAP K-10 对照组相比,58F 免疫组和66NC+58F 免疫组在整个监测过程产生的IgG,以及首免2 周、4 周和感染4 周产生的IgM 极显著增加(P<0.001),66NC+58F 免疫组在感染2 周产生的IgM非常显著增加(P<0.01),但两组产生的IgG 和IgM在整个监测过程中始终无显著性差异(P>0.05)(图4-a、图4-b)。以上结果表明,融合蛋白58F 和66NC+58F 均可诱导产生高水平的抗体。

图4 血清抗体监测Fig. 4 The monitoring results of serum antibody
2.5 ELISA 检测感染后小鼠血清细胞因子
为了比较融合蛋白58F 和66NC+58F 在小鼠感染后诱导的细胞因子水平的差异,在感染2 周和4 周对各组小鼠进行采血,通过ELISA 检测IFN-γ、TNF-α和IL-17A 水平(图5)。结果显示:感染2 周时,与61 VG 对照组、MAP K-10 对照组和58F 免疫组相比,66NC+58F 免疫组分泌的IFN-γ、TNF-α 和IL-17A 极显著增加(P<0.001)(图5-a)。感染4 周时,与61 VG 对照组相比,58F 免疫组和66NC+58F 免疫组分泌的IFN-γ、TNF-α 和IL-17A 非常显著增加(P<0.001),但两组与MAP K-10 对照组相比无差异(P>0.05),两个免疫组之间无差异(P>0.05)(图5-b)。以上结果表明,融合蛋白66NC+58F 刺激小鼠血清中IFN-γ、TNF-α 和IL-17A 的释放,能够诱导较强的Th1和Th17 型免疫反应。

图5 血清细胞因子检测Fig. 5 Serum cytokine assay results
2.6 体重检测
为了比较感染后各组小鼠增重差异,记录感染前和感染2 周时小鼠的体重,计算小鼠体重增长率(图6)。与61 VG 对照组相比,58F 免疫组体重增长率显著增加(P<0.05),66NC+58F 免疫组体重增长率极显著增加(P<0.001),但58F 与66NC+58F 免疫组间无差异(P>0.05);与MAP K-10 对照组相比,66NC+58F 免疫组体重增长率非常显著增加(P<0.01),58F 免疫组无差异(P>0.05)。以上结果表明,融合蛋白58F 和66NC+58F 均可抵抗MAP 感染造成的体重下降,66NC+58F 的抵抗效果较58F 更好。

图6 感染2 周小鼠体重增长率Fig. 6 Body weight growth rate of mouse at two weeks of infection
2.7 融合蛋白58F 和66NC+58F 的保护效果分析
为了评价融合蛋白58F 和66NC+58F 免疫小鼠后的保护效果,笔者分离MAP K-10 感染4 周小鼠的肝脏进行病理学和组织病理学分析,并通过荧光定量PCR 的方法检测肝脏荷菌数(图7)。结果显示:感染4 周时,所有组的肝脏表面均有表面结节,但66N+58F 免疫组肝脏表面结节面积比61 VG 对照组和MAP K-10 对照组更少(图7-a,红色箭头指示)。病理学打分显示,与61 VG 对照组相比,两个免疫组的各个脏器病变无差异(P>0.05);与MAP K-10 对照组相比,两个免疫组的肝脏病变非常显著下降(P<0.01),但两个免疫组各个脏器病变之间无差异(P>0.05)(图7-b)。感染4 周时,所有组的肝脏均有广泛性的肝细胞坏死与多发性微型肉芽肿,但66N+58F免疫组肉芽肿面积比两个对照组和58F 免疫组更少(图7-c,红色箭头指示)。组织病理学打分显示,66NC+58F免疫组肝脏肉芽肿面积显著低于61 VG 对照组和MAP K-10 对照组(P<0.05),且肝脏组织病理得分显著低于58F 免疫组(P<0.05)(图7-d)。感染4 周时,58F免疫组肝脏的荷菌数显著低于61 VG 对照组(P<0.05);66NC+58F 免疫组肝脏的荷菌数显著低于61 VG对照组和MAP K-10 对照组(P<0.05);但两个免疫组之间的荷菌数无差异(P>0.05)(图7-e)。以上结果表明,融合蛋白58F 和66NC+58F 能够抵抗MAP 感染对小鼠造成的病理损伤,均可降低MAP 在小鼠肝脏中的定植水平,且66NC+58F 的抵抗效果优于58F。

图7 小鼠脏器病理学、组织病理学和菌落定植分析Fig. 7 Organ pathology and histopathological analysis of mouse
3 讨论
3.1 重组亚单位候选疫苗的筛选
MAP 感染主要导致宿主的Th1 免疫反应,其中IFN-γ 是最关键的细胞因子,它在T 细胞和巨噬细胞的激活中有着重要作用,从而介导细胞免疫,抑制和杀伤MAP[16-17]。对MAP 感染的控制取决于宿主的Th1免疫反应和Th1 细胞在获得性免疫阶段分泌的IFN-γ对巨噬细胞的激活[18]。因此,筛选出能够诱导强烈的Th1 免疫反应和IFN-γ 水平的候选免疫原对于开发MAP 亚单位疫苗至关重要。本研究在获得6 种融合蛋白后,通过IFN-γ ELISPOT 试验评价融合蛋白免疫原性,确定了MAP 的最佳候选抗原58F。
在结核病和副结核病的亚单位疫苗的开发过程中,越来越多的研究采用了抗原鸡尾酒或融合蛋白的策略,以增加亚单位疫苗的免疫效果,最终获得的亚单位疫苗比起单一抗原可以引起更有效的免疫反应[10,12,19]。本研究将用已报道的MAP3527 和Ag85B构建的融合蛋白66NC 与筛选出的MAP 最佳候选免疫原58F 混合,制成的重组亚单位疫苗66NC+58F 免疫小鼠后,通过IFN-γ ELISPOT 试验评价其免疫原性,确定了MAP 的最佳候选抗原66NC+58F。
3.2 重组亚单位候选疫苗的免疫原性评价
MAP 感染主要导致宿主的Th1 免疫反应,特点包括IgG2a抗体、IFN-γ 和TNF-α 的产生[18,20]。IFN-γ 和TNF-α 可以激活巨噬细胞的成熟和抗原特异性Th1 细胞的增殖,进而协调细胞介导的免疫功能,是遏制胞内感染的必要条件。TNF-α 缺乏会导致MAP 传播增强,并在感染部位表现出弥漫性肉芽肿病变[21]。IL-17与IFN-γ 等细胞因子构成促炎细胞因子环境,共同控制疾病的早期发展[22]。本研究通过ELISA 检测小鼠血清细胞因子,结果显示,二免3 周时,66NC+58F 免疫组IFN-γ、TNF-α 和IL-17A 的分泌水平显著高于61 VG 对照组和58F 免疫组,表明融合蛋白66NC+58F能够诱导较强的Th1 和Th17 型免疫反应。
研究发现,在接种MAP 灭活疫苗的绵羊中,B细胞在保护动物免受MAP 感染方面非常重要[23]。免疫产生的抗体可以提高动物的存活率,减少细菌的传播[24-25]。由于亚单位疫苗主要诱导宿主体液免疫反应,因此抗体滴度也是评价候选亚单位疫苗的工具之一[17]。本研究通过ELISA 监测小鼠血清抗体水平,结果表明,58F 和66NC+58F 免疫组在免疫过程中均诱导高滴度的IgG、IgM、IgG1和IgG2a。表明融合蛋白58F 和66NC+58F 能够刺激机体产生体液免疫和细胞免疫反应。
3.3 重组亚单位候选疫苗的免疫保护效果评价
目前已经鉴定出多种能够诱导Th1 免疫反应的抗原,但由于牛、羊等反刍动物进入临床阶段前有较长的潜伏期,因此只有少数候选免疫原在牛上进行了保护效果评价[26-27]。小鼠是研究MAP 长期感染最合适的替代模型,主要用来早期筛选候选疫苗,虽然反刍动物的临床特征如腹泻和严重的肠道病变等症状无法在小鼠中复现,但小鼠在感染MAP 时的组织学和免疫学特征与反刍动物相似[28-29]。对于小鼠模型,脾脏、肝脏和肠的细菌负荷量或细菌的粪便脱落可以作为疾病发展的标志。
本研究通过ELISA 检测小鼠抗体水平和血清细胞因子,结果显示,感染2 周、4 周时,58F 和66NC+58F免疫组均诱导高滴度的IgG 和IgM,对抵抗MAP 感染具有一定的保护作用;66NC+58F 免疫组IFN-γ、TNF-α 和IL-17A 的分泌水平显著高于61 VG 对照组和58F 免疫组,表明融合蛋白66NC+58F 能够诱导较强的Th1 和Th17 型免疫反应。本研究监测了感染2周各组小鼠的增重差异,以评价融合蛋白对感染后小鼠体重的影响,结果显示,66NC+58F 免疫组小鼠体重的增重效果高于61 VG 对照组和58F 免疫组,更能抵抗MAP 感染造成的体重下降。本研究通过病理学及组织病理学观察评价融合蛋白58F 和66NC+58F 在感染过程中对小鼠的保护作用,结果显示,与61 VG对照组相比,58F 免疫组和66NC+58F 免疫组肝脏的病理损伤均明显减轻,66NC+58F 免疫组较58F 免疫组更轻,表明融合蛋白66NC+58F 能够抵抗MAP 感染对小鼠造成的病理损伤。本研究通过荧光定量PCR评价融合蛋白58F 和66NC+58F 在感染过程中对小鼠肝脏定植情况的影响,结果显示,与61 VG 对照组相比,58F 免疫组和66NC+58F 免疫组的肝脏荷菌数均显著下降,表明融合蛋白58F 和66NC+58F 均可降低MAP 在肝脏的定植水平。
4 结论
成功获得5 种融合蛋白58F、62F、69F、46F 和52F,其中,58F 诱导强烈的特异性IFN-γ 反应;融合蛋白66NC+58F 能够诱导小鼠产生高滴度的抗体以及Th1 和Th17 型免疫反应,对MAP 感染有着一定的免疫保护作用,是PTB 重要的亚单位疫苗候选,为PTB新型亚单位疫苗的研究提供重要的科学依据。

