白术治疗溃疡性结肠炎作用机制的网络药理学分析及实验验证研究*
余学成,高增祥,吴 斌,涂济源,2,陈林霖,曹国胜,2**
(1.湖北中医药大学药学院 武汉 430065;2.湖北省中药炮制工程技术研究中心 武汉 430065)
溃疡性结肠炎(Ulcerative colitis,UC)是一种常见的、慢性的、非特异性的炎症性疾病,任何年龄均可发病,多见于年轻群体,其病因尚不明确,在临床上,常表现为血性腹泻、便血等症状[1-3]。其发病机制复杂,遗传、免疫失调、肠道菌群失调、环境等是目前普遍认为的诱发因素[4]。近年来,全球的UC 发病率一直在上升[5]。目前临床上有氨基水杨酸类、皮质固醇类和免疫调节剂类等作为治疗UC 的常用药物,但其副作用明显且易复发[6-7]。近年来,随着中医药在治疗UC 方面取得了巨大的进展,从传统中医药理论出发,寻找安全有效的治疗UC的药物显得十分迫切。
根据UC 临床表现,在我国传统医学理论中,把UC归属于“泄泻”、“肠风”以及“痢疾”等范畴,认为UC的发生是由脾失健运、湿热蕴肠所致[8],故围绕健脾益气、祛湿止泻为治疗UC 的基本法则。而白术具有健脾益气、燥湿利水、止汗安胎之功效[9],现代研究也表明白术具有免疫调节、抗炎、抗肿瘤等作用,对不明原因的肠炎也具有较好的疗效[10]。临床上通过常规治疗手段联合应用白术治疗效果显著,其可明显改善患者的临床症状[11-12]。白术的主要活性成分之一白术多糖(Atractylodes Macrocephala Polysaccharides,AMP)可以改善溃疡性结肠炎,其治疗效果与调节肠道菌群组成、粪便代谢和血浆代谢的能力有关[13]。另一主要活性成分之一白术内酯III 可通过维持线粒体功能来减弱UC发展进程中的上皮屏障的破坏[14]。因此,推测白术对UC 具有较好的改善作用,但其治疗UC 的潜在分子机制尚未完全清楚,有待进一步研究。
网络药理学是多交叉学科,以系统层次和生物网络的整体角度为出发点阐释药物作用、疾病机制的新兴学科,其通过探索疾病与药物之间的分子关联,从而揭示药物作用于人体多靶点,多层次的机理[15-17]。基于网络药理学角度,从中药多成分、多靶点、多环节的作用特点出发,为系统阐明中药治疗UC 等复杂疾病的分子机制提供了研究策略[18]。本研究拟基于网络药理学、分子对接技术及体内实验验证系统性分析白术治疗UC 的作用机制,为临床应用白术等健脾燥湿中药治疗UC疾病提供实验依据和思路借鉴。
1 材料与方法
1.1 网络药理学
1.1.1 网络药理学数据库的整理
将本文所使用的数据库及软件进行了相关整理,见表1。
1.1.2 白术活性成分的筛选
通过TCMSP数据库、TCM-ID数据库的检索,以及查阅相关文献[19-20],去重后以口服生物利用度(Oral bioavail-ability,OB≥30%)和类药性(Drug likeness,DL≥0.05)为条件[21]获取并筛选白术的有效活性成分信息。
1.1.3 药物活性成分的靶点筛选
应用Swiss 数据库进行药物活性成分的靶点筛选,选取Probability>0 的靶点。有部分活性成分靶点在Swiss 数据库中未找到,将其靶点通过Batman-TCM数据库进行补充。
1.1.4 疾病靶点的收集、共同靶点的获取以及网络图的构建
以“ulcerative colitis”为关键词在GeneCards 数据库中搜索,收集UC 疾病的相关靶点。将疾病与药物靶点取交集,并利用Venny2.1.0 进行交集分析并构建韦恩图。将通过上述步骤得到的相关靶点、药物、活性成分、疾病进行整理后导入到Cytoscape 中构建“药物-成分-靶点-疾病”网络图。
1.1.5 PPI网络的构建
将上述疾病与药物的共同靶点导入到String 数据库中,将蛋白种类设置为“Homo sapiens”,其他均为默认条件,得到PPI 网络并导入到Cytoscape 3.7.2 软件中,通过软件插件Centiscape 2.2 进行核心靶点的筛选。以插件中的Degree、Closeness、Betweenness 三个参数进行核心靶点筛选,选取大于三个参数值的靶点,进行筛选2次,最终得到核心靶点。将核心靶点导入到String 数据库中,默认条件,再将得到的网络图导入Cytoscape 3.7.2软件中,得到最终的核心靶点PPI网络图。
1.1.6 GO功能富集分析和KEGG信号通路注释分析
将1.1.5中最终筛选得到的核心靶点导入到David数据库中,相关参数设置如下:物种选择为“Homo sapiens”,列表类型设置为“gene list”,标识符选择“official gene symbol”,之后进行GO 功能富集分析与KEGG 信号通路注释分析,前者选择P值排名前10 的进行气泡图的绘制,后者选取P 值排名前20 的进行气泡图的绘制。
1.1.7 通路靶点网络图的构建
将KEGG 信号通路注释分析结果中的基因、通路数据以及活性成分进行整理,导入到Cytoscape 3.7.2软件中进行,构建“通路-活性成分-靶点”网络图。
1.1.8 活性成分与靶点蛋白的分子对接
应用分子对接软件Autodock 进行分子对接,在UniProt数据库中获取相关靶点的“Entry”,再以获取的具体“Entry”为关键词在PDB 蛋白数据库中检索从其中选取相关蛋白并下载其Pdb 结构,将其导入到Pymol2.5 软件中删除所有水分子和多余的小分子配体。在Pubchem 数据库中获取活性成分的3D 结构文件,并应用Open Babel GUI 软件将其转为mol2 格式。将处理好的蛋白与活性成分导入Autodock Tool 1.5.7软件转换为pdbqt 格式,之后使用Autodock Vina 1.1.2软件进行两两分子对接,并计算出结合能(kcal/mol)。最后,利用Pymol2.5软件进行可视化。
1.2 验证性实验
1.2.1 实验试剂及药物
无水乙醇(批号20180904),购自国药集团化学试剂有限公司;柳氮磺吡啶肠溶片(SASP)(批号09220718),购买自上海信谊天平药业有限公司;人尿素粪便隐血试剂盒(批号20221104),购自南京建成科技有限公司;通用型组织固定液(批号G1101),购自武汉赛维尔生物科技有限公司;葡聚糖硫酸钠(dextran sodium sulfate,DSS,批号160110),购自美国MP Biomedicals 公司;IL-1β(博奥森,bs-0812r),浓度为1/200;TNF-α(三鹰,60291-1-ig),浓度为1/200;白术(生产批号20220101),产地浙江,购自湖北天济药业有限公司,由湖北中医药大学药学院余坤教授鉴定为菊科植物白术Atractylodes macrocephala koidz.的根茎。
1.2.2 动物
SPF级BALB/c 小鼠32只,雄性,体质量20±2 g,购自辽宁长生生物技术股份有限公司,实验动物许可证号:SCXK(辽)2022-0001。小鼠在清洁环境中进行饲养,不限制饮水和进食,饲养环境温度为22±2℃,湿度为55%±5%,光照环境和黑暗环境各交替循环12 h,小鼠适应性喂养3天后进行后续实验。
1.2.3 仪器
电子天平(CPA225D),购自美国梅特勒-托利仪器有限公司。旋转蒸发仪(RE-52AA),购自上海亚荣生化仪器厂;冷冻干燥机(LGJ-12N),上海华玺科学仪器有限公司;粉碎机(DFY-800C),购自温岭市大机械有限公司;其他的小型仪器,如烧杯、镊子、剪刀等。
1.2.4 实验药物制备
(1)DSS 溶液的制备:将称量的3.5 g DSS 试剂溶解与纯水中,配制成3.5%的DSS溶液。
(2)白术醇提物的制备:称取25 g 白术,打粉机将进行粉碎,所得粉末过2号筛,从中取20 g白术粉末置于烧杯中,加十倍量80%乙醇浸泡过夜。次日将其超声提取3 次(每次操作均相同),每次30 min,后将3 次所得滤液合并,并将其旋蒸(50℃,40 r·min-1)至浓膏状。将所得样品在-80℃条件下过夜,次日冷冻干燥,后置于-20℃条件下保存备用。
(3)柳氮磺吡啶肠溶片(SASP)混悬液制备:在研钵中将SASP 片剂研磨至极细粉末后配制成浓度为250 mg·10 mL-1的混悬液。将其分装,4℃冷藏备用。
1.2.5 动物分组、造模以及给药
将32 只老鼠随机分为4 组,分别是空白组(Control)、模型组(Model)、白术组(BZ)和阳性药组(SASP),每组各8 只,适应性喂养3 天,第1 天起,小鼠自由饮用3.5% DSS溶液,每2天更换新制的DSS溶液。第2 天起,各组分别给药,空白组,模型组均灌胃生理盐水,白术组组灌胃白术醇提物,参考《中国药典》规定:白术用量6-12 g。此实验按成人白术9 g·60 kg-1给药,考虑小鼠与人剂换算系数12.3,则白术剂量为1845 mg·kg-1·d-1。阳性药组灌胃柳氮磺吡啶(SASP),剂量为250 mg·kg-1·d-1。各组按1 mL·100 g-1给药,连续给药7天[22]。
1.2.6 检测各组小鼠DAI评分和结肠长度变化
自实验开始第1天起,每天在相同时间段内,对小鼠进行称量并记录鼠体质量,观察小鼠大便形状及便血情况并进行记录,小鼠大便隐血情况按照隐血试剂盒说明书的方法进行测定,参考相关文献并计算DAI评分,DAI评分标准如表2所示,计算公式为:DAI评分=体质量变化评分+大便性状评分+隐血或便血评分。末次给药后处死小鼠,取出小鼠结肠并用直尺测量其自然长度,记录并拍照。
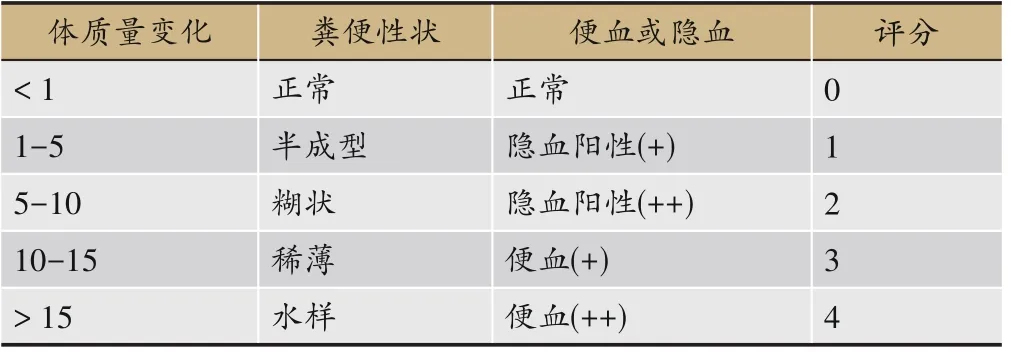
表2 DAI评分表
1.2.7 HE染色观察各组小鼠结肠组织病理学变化
取小鼠结肠组织,多聚甲醛进行固定,脱水,石蜡包埋,切片,置于载玻片上,进行HE 染色。光学显微镜下对结肠组织结构、杯状细胞、绒毛排列及炎性细胞浸润等组织病理学变化情况进行观察并拍照。HE染色病理学评分标准:①炎性损伤程度:无炎性反应,0分;轻度炎性反应,1分;重度炎性反应,2分。②病变损伤深度:无病变,0分;病变侵及黏膜下层,1分;病变侵及肌层,2分;病变侵及浆膜层,3分。③隐窝损伤程度:无损伤,0分;基底1/3隐窝被破坏,1分;基底2/3隐窝被破坏,3分;全部隐窝和上皮被破坏,4分。计算公式:病理学评分=炎性反应+病变深度+隐窝损伤。
1.2.8 AB-PAS 染色观察各组小鼠结肠组织中杯状细胞数目
取小鼠结肠组织石蜡块,切片,置于载玻片上,二甲苯脱蜡,梯度乙醇脱水,先后用阿利新蓝染色液染色、过碘酸溶液浸泡,并加入Schiff 试剂反应,再经梯度乙醇脱水,二甲苯透明,最后封片。光学显微镜下进行镜检,呈现蓝色的为酸性黏液质,呈现红色的为糖原和中性黏液质。
1.2.9 免疫组织化学法检测各组小鼠结肠组织中IL-1β、TNF-α蛋白表达的变化
免疫组织化学法如下:取各组小鼠结肠组织石蜡块,切片,置于载玻片上,脱蜡后进行抗原修复,4℃条件下孵育一抗和二抗,细胞核用苏木素复染,经梯度乙醇脱水后,封片。光学显微镜下镜检,其中细胞核呈蓝色,相应炎症因子的阳性表达呈棕黄色。
1.2.10 统计学处理方法
应用GraphPad Prism 8.0 统计软件对本次数据的结果进行统计分析,计量资料用均值±标准差(±s)表示,采用单因素方差分析,两组组间比较采用t检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 活性成分筛选结果
通过数据库及文献查阅筛选,其中有20个活性成分通过TCMSP 数据库筛选得到,16 个由TCM-ID 数据库及查阅文献得到,经去重后共得到30 个活性成分(见表3)。

表3 活性成分信息表
2.2 白术治疗UC的潜在靶点预测以及网络图的构建
将筛选出白术活性成分的“Canonical SMILES”结构导入到Swiss Target Prediction数据库中,设置条件为Probability>0,未在该数据库中找到靶点的活性成分用Batman-TCM 数据库进行补充,得到相应靶点591 个。再以“ulcerative colitis”为关键词应用GeneCards 数据库进行疾病靶点的检索,得到靶点5139个。
将白术的预测作用靶点及溃疡性结肠炎疾病的靶点导入Venny2.1.0,取两者交集,得白术和溃疡性结肠炎共同靶点308 个,蓝色部分为白术活性成分相关靶点,黄色部分为UC相关靶点,见图1A。

图1 白术治疗UC的潜在靶点预测以及网络图PPI的构建
将所得靶点、信息进行整理,导入Cytoscape3.7.2软件,绘制“药物-疾病-成分-靶点”网络图,结果见图1B。其有338 个节点,1206 条边。图中深红色节点(菱形)为白术和疾病;浅红色(倒三角形)为活性成分;浅黄色(圆形)为靶点。
将白术和溃疡性结肠炎共同交集的308个靶点基因导入String 数据库,获取得到相应的文件导入Cytoscape 3.7.2 软件,绘制靶点蛋白相互作用的网络图,共得308 个节点,4950 条边。因其节点过多,故运用Cytoscape 3.7.2 软件插件Centiscape 2.2 进行核心靶点的筛选。将筛选得到的22 个核心靶点再次导入STRING 数据库,下载其Tsv 文件,将文件导入Cytoscape 3.7.2 软件,得到核心靶点的PPI 网络图,其有22 个节点,227 条边。根据度值的大小来设定节点的大小以及颜色,颜色越深、大小越大,度值越大。结果所示IL-1B、TNF、AKT1、MAPK3 等为排名靠前的靶点,结果见图1C。图中外圈颜色较深,说明靶点度值较大,内圈为黄色和蓝色,颜色较浅,说明靶点度值较小,其中蓝色靶点的度值最低。
2.3 GO功能富集和KEGG通路富集分析
运用DAVID 数据库对白术作用于UC 疾病中的22 个核心靶点进行生物过程(Biological process,BP)、分子功能(Molecular function,MF)和细胞组分(Cellular component,CC)等分析。通过GO 分析得到322 条BP 程条目,38 条MF 条目,33 条CC 条目。分别根据P值进行排序,对各富集结果排名前10 的条目进行可视化,见图2。

图2 GO功能富集分析
再通过DAVID 数据库对22 个核心靶点进行KEGG通路富集分析得到145条通路,根据P值进行排序,显著性最大的前20 条通路见图3。除去不相关的广谱通路,可知白术治疗UC 的主要信号通路涉及表皮生长因子受体信号通路(EGFR)、磷脂酰肌醇3-激酶/蛋白激酶B 信号通路(PI3K-Akt signaling pathway)等。

图3 KEGG通路富集分析
2.4 白术“药物成分-靶点-通路”网络的构建及分析
将白术活性成分、排名前20的通路及富集其上的靶点进行整理,将整理好的文件导入到Cytoscape 3.7.2软件中进行网络图的构建,结果见图4,其有68 个节点,290 条边。图中绿色(倒三角形)代表白术防治溃疡性结肠炎的相关通路,橙色(三角形)代表白术的活性成分,粉红色(圆形)代表白术防治溃疡性结肠炎作用靶点。两者间的对应关系由各节点之间的连线代表。其表明白术可能通过多成分,多靶点,多信号通路来起到防治溃疡性结肠炎的作用(见表3)。

图4 药物活性成分-对应靶点-信号通路网络图
2.5 分子对接验证
白术内酯I、II、III 虽然在上述活性成分排名中较为靠后,但白术内酯类成分作为白术的主要活性成分,有大量文章报道其具有很好的抗炎活性[23-24],故将这3种活性成分也纳入核心成分进行分子对接。基于此,选择BZ10、BZ11、BZ12、BZ15、BZ16、BZ17 共6 个活性成分和排名靠前的白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)两个靶点进行两两分子对接验证。结合能越小代表结合构象越稳定,结合能小于-5 kcal·mol-1表示具有结合能力,结合能小于-7 kcal·mol-1表示结合能力较强[25]。白术6 个活性成分与IL-1β、TNF-α 的分子对接示意图,如图5 所示。分子对接结果显示白术6 个活性成分与IL-1β、TNF-α 两个靶点均具有较好的结合能力(均小于-5.0 kcal·mol-1),提示白术改善UC 可能有抑制相关炎症因子的释放有关,但需要进行实验验证。

图5 关键活性成分与靶点的对接及结合能模式图
2.6 体内实验验证结果
2.6.1 白术对各组小鼠结肠长度、小鼠DAI 评分的影响
在对动物进行取材的过程中发现模型组小鼠肠道与其他组小鼠肠道相比出血较明显,有明显的溃疡症状,肠道内粪便呈稀样,异味明显,肠道弹性较差,白术组(BZ)和SASP 组的小鼠肠道的状况则有明显改善,空白组肠道状况正常。由图6A、6B 所示空白组与模型组相比较,模型组结肠长度明显减少(P<0.01);和模型组相比,白术组(BZ)和SASP 组小鼠的结肠长度均有所增加(P<0.01)。由图6C 所示空白组和模型组相比,模型组DAI评分显著增加(P<0.01),可知实验造模成功,和模型组相比较,白术组(BZ)与阳性药组的DAI评分均有所降低(P<0.01)。

图6 白术对各组小鼠结肠长度、小鼠DAI评分的影响
2.6.2 白术对各组小鼠结肠组织病理学变化及杯状细胞数目的影响
如图7A 所示,细胞核呈蓝紫色,细胞质呈粉红色。HE 染色结果显示,和空白组(Control)相比,模型组(Model)结肠组织结构破坏严重,炎性浸润明显,黏膜水肿明显,上皮细胞损伤严重。和模型组相比,白术组(BZ)和SASP 组的结肠组织病理状态改善明显,粘膜上皮细胞排列较为紧密,炎性浸润减轻。图7B为病理学评分的统计图,统计结果与HE 染色结果的趋势一致。
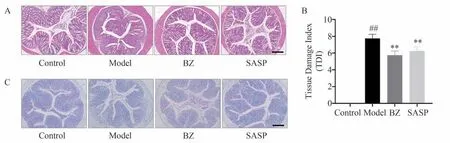
图7 白术对各组小鼠结肠组织病理形态学变化及杯状细胞数目的影响
如图7C所示,糖元、中性粘液物质呈红色,酸性粘液呈蓝色。AB-PAS 染色结果显示,和空白组相比,模型组结肠组织中杯状细胞个数明显减少,和模型组相比较,白术组(BZ)、SASP 组的颜色有所加深,染色阳性细胞有所增加。结果表明白术给药治疗后可明显增加UC小鼠结肠组织中杯状细胞的个数。
2.6.3 白术对各组小鼠结肠组织中关键靶点IL-1β、TNF-α表达的影响
由图8 所示,棕褐色代表阳性,蓝色代表细胞核。免疫组化检测结果显示,相比较于空白组,模型组小鼠结肠组织中炎性因子IL-1β 及TNF-α 阳性表达有所增加;而相比较于模型组,白术组(BZ)、阳性药柳氮磺吡啶(SASP)组小鼠结肠组织中IL-1β 及TNF-α 阳性表达有所减少,且IL-1β 阳性表达减少更为明显。研究结果表明,白术可通过抑制UC 小鼠结肠组织中IL-1β、TNF-α 等炎症因子的表达减缓炎症反应的发生来改善UC损伤。

图8 白术对各组小鼠结肠组织中关键靶点IL-1β、TNF-α表达的影响(IHC,×100)
3 讨论
UC 易复发,且发病率逐年上升,给医药卫生行业带来了巨大挑战[26]。因其严重影响患者的生活质量,世界卫生组织将其确定为现代难治性疾病之一[27]。传统中医学认为湿热内蕴是UC 的主要发病机制,多与脾气受损、湿滞日久等因素有关[28],而白术归脾、胃二经,具有健脾燥湿的功效,自古以来白术就被历代医者用于治疗脾胃相关疾病[29]。
本研究运用网络药理学方法筛选出白术19 个有效活性成分,443个作用靶点以及225个药物与疾病交集靶点。研究表明,白术内酯类成分、挥发油及白术多糖等是白术的主要活性成分,并被证实有广泛的药理作用[30-31]。其中,白术内酯I、II 均有良好的抗炎、抗氧化作用[32-33]。此外,白术内酯III 可通过调节自噬水平清除过氧化物减轻小鼠UC 损伤[34]。白术挥发油对大肠杆菌、铜绿假单胞菌、肠道沙门氏菌、金黄色葡萄球菌和枯草芽孢杆菌的生长均有抑制作用[35]。另外,白术多糖还可减轻机体炎症反应,改善类风湿性关节炎,其机制可能与抑制TLR4/NF-κB 信号通路的活化有关[36]。大量研究表明,出自《太平惠民和剂局方》的参苓白术散被常用于治疗脾胃气虚、湿阻气滞证,针对UC 疾病具有良好的疗效[37-38],因此,推测白术对溃疡性结肠炎的治疗有很好的效果。体内动物实验结果表明,白术醇提物组可明显增加UC 小鼠的结肠长度,降低DAI 评分,还可以改善UC 小鼠结肠组织病变程度,增加小鼠结肠组织中杯状细胞的个数,这均提示白术对UC小鼠具有较好的疗效。
白术作用靶点间的协调促进和抑制可能会增加结肠上皮细胞的癌症风险,并加速转化为调节复杂疾病表型的新型功能模块或协同模块组合[39]。本研究筛选出的核心靶点主要有IL-1B、TNF、MAPK3、AKT1 等。研究表明,在UC的炎症反应过程中,TNF-α是促使UC发生与发展的炎症启动因子,其是导致肠黏膜损害以及微循环障碍的重要因素[40]。TNF-α炎症因子主要通过对中性粒细胞趋化作用,对肠黏膜组织细胞进行浸润,从而导致炎症损伤[41]。炎症因子IL-1β可增强炎症损伤,使UC 病情加重[42]。因此,选择TNF-α 及IL-1β 两个关键靶点进行了体内验证实验。实验结果发现白术可使UC小鼠结肠组织中TNF-α、IL-1β表达情况下降,从而减轻机体炎症反应发挥对UC的改善作用。
综上,白术可通过减少TNF-α、IL-1β在结肠组织中的表达量来抑制UC 小鼠的炎症反应,从而改善UC的症状。本研究基于网络药理学和分子对接技术角度,并进行了体内动物实验进行初步验证。此外,本研究存在一定的局限性,比如实验验证的方法较为单一,未对预测得到的其他信号通路展开实验验证,但在某种程度上为临床应用健脾燥湿等中药治疗UC 提供了实验依据与思路借鉴[43]。

