环维黄杨星D对醛固酮诱导型心肌肥厚和凋亡的保护作用及机制*
蒋丹, 刘斌, 付凌云, 徐旖旎, 陶玲, 沈祥春*
(贵州医科大学药学院 &贵州省高等学校天然药物药理与成药性评价重点实验室, 贵州医科大学, 贵州 贵阳 550025)
心血管疾病死亡率高、预后差,严重影响患者的生活质量[1]。心肌肥厚是心脏为满足应激而激活的一种代偿反应,以心肌细胞体积增大、蛋白累积增加为特征[2]。心肌肥厚初始是增强心脏功能的代偿性反应,如运动或妊娠时。但长期心肌肥厚会诱发心室重塑、心力衰竭[3]。醛固酮(aldosterone,ALD)是激活肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)分泌的一种效应因子,参与心肌肥厚及心力衰竭的病理进程[4]。但ALD诱发的心肌肥厚病理机制尚不明确,因此,探究ALD诱导心肌肥厚的病理机制对探索治疗心肌肥厚的新药意义重大。沉默信息调节因子3(sirtuin3,Sirt3)在心脏中高度表达,在调节心肌肥厚、心肌梗死等心血管疾病中有重要作用[5]。研究表明,Sirt3过表达可减轻心肌肥厚和纤维化,防止心脏重塑和心脏功能障碍[6]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-gamma,PPARγ)作为核受体超家族的成员,是一种配体激活的转录因子,参与葡萄糖代谢、炎症反应等[7]。有研究发现激活PPARγ可以减轻心衰小鼠的心室重塑、肥大和纤维化[8]。Sirt3通过激活PPARγ来改善血管生成和成纤维细胞转分化等[9-10]。但关于Sirt3/PPARγ通路在ALD诱导的心肌肥厚中的作用研究未见报道。环维黄杨星 D(cyclovirobuxineD,CVB-D)是黄杨科植物小叶黄杨 (buxusmicrophyllasieb.et zucc.var.sinica rehd.et wils)及其同属植物中提取而得的一种生物碱[11]。它作为我国研发的创新药物,临床已应用于多种心血管系统疾病,如心律失常、心绞痛和心力衰竭等[12]。本课题组前期研究证实CVB-D改善ALD诱导的心肌损伤和凋亡[13-14]。因此,本研究以ALD诱导心肌肥厚为模型,探讨CVB-D减轻心肌肥厚和抑制凋亡的分子机制,为临床治疗心肌肥厚提供新靶点和新思路。
1 材料与方法
1.1 实验材料
1.1.1实验动物 体外实验:新生1~3 d的SPF级SD大鼠,雌雄不拘,许可证号[SCXK(湘)2019-0014]。体内实验:8周龄的SPF级C57BL/6雄性小鼠,18~22 g,50只,许可证号[SCXK(京)2019-0010]。所有动物由贵州医科大学动物实验中心提供,动物实验经贵州医科大学动物伦理委员会批准(批号2000904),符合动物伦理要求。
1.1.2药物及试剂 CVB-D(成都普思生物科技股份有限公司,860-79-7),螺内酯(上海江莱生物科技有限公司,52-01-7),醛固酮(美国Sigma公司,#MKBX 5094V),5-溴脱氧尿嘧啶(美国Sigma公司,59-14-3),胰酶(维森特生物科技有限公司,2327859),青链霉素混合液(维森特生物科技有限公司,450-201-EL),DMEM高糖培养基(美国Gibco公司,8122356),胎牛血清(成都普思制药公司,21110705),噻唑蓝(北京索莱宝公司,117X0516),心房钠尿肽(atrial natriuretic peptide,ANP)购于英国Abcam(ab180649),B型尿钠肽(b-type natriuretic peptide,BNP)购于英国Abcam(ab239510),心肌肌钙蛋白T(cardiac troponin T,cTnT;15513-1-AP)、Bcl-2相关X蛋白(bcl-2 associated x protein,Bax;50599-2-Ig)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2;26593-1-AP)、胱天蛋白酶3(Caspase3,19677-1-AP)、去乙酰化酶-3(Sirtuin 3,Sirt3;10099-1-AP)和PPARγ(16643-1-AP)均购于美国Proteintech 公司,3-磷酸甘油醛脱氢酶(glyceraldehydes-3-phophate dehydrogenase,GAPDH)购于上海Bioworld(AP0063);BCA蛋白定量试剂盒(北京索莱宝公司,PC0020);吉姆萨染色试剂盒 (珠海贝索生物有限公司,417086),乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(南京建成生物工程研究所,A003-1-2/20210103)。ADV6-NC和Ad-Sirt3购自吉玛基因。
1.1.3仪器 HF90型二氧化碳培养箱(上海力申科学仪器有限公司),VARIOSKANLUX多功能酶标仪(美国Themo Fisher Scientific公司),CFX型凝胶成像系统(美国BIO-RAD公司),80-2型电动离心机(常州澳华仪器有限公司),XDS-2B型倒置显微镜(日本尼康公司),Dmi8倒置荧光显微镜(德国Leica公司),小动物超声成像系统(苏州飞依诺科技有限公司)。
1.2 研究方法
1.2.1动物分组、造模及给药 50只小鼠适应性喂养1周,随机分为对照组(Control组)、模型组(ALD组,80 μg/kg),CVB-D低剂量组(CVB-D.L组,0.5 mg/kg CVB-D+80 μg/kg ALD),CVB-D高剂量组(CVB-D.H组, 1 mg/kg CVB-D+80 μg/kg ALD),阳性药螺内酯组(Spir.组,20 mg/kg Spir.+80 μg/kg ALD),每组10只。给药组连续7 d灌胃给予对应药物,期间Control组、ALD组灌胃等量双蒸水。第8天时,ALD组及给药组颈背部皮下注射ALD并联合高盐饮水(1%NaCl),Control组皮下注射等量生理盐水正常饮水,持续灌胃。给予ALD 8周后,乙醚麻醉小鼠,解剖取心脏。
1.2.2心功能检测 小鼠经麻醉后固定四肢,脱去胸前毛发,涂抹超声耦合剂,用小动物B超仪于M型下记录超声心动图,并分析左心室射血分数(left ventricular ejection fraction,LVEF)和左心室缩短分数(left ventricular fractional shortening, LVFS)。
1.2.3组织病理学 心脏组织经预冷的PBS漂洗干净,浸泡到 4%多聚甲醛固定。固定的心脏组织依次经脱水透化,石蜡包埋后切片。用HE、Masson及小麦胚芽凝集素荧光(WGA)试剂染色,封片后显微镜镜检,采集图像并分析。
1.2.4原代新生大鼠心肌细胞(primary rat neonatal cardiomyocytes,PNRCMs)的培养和鉴定 通过胰酶消化法和差速贴壁法提取PNRCMs。取新生1~3 d的SD大鼠乳鼠的心脏,预冷的PBS冲洗2次,青霉素链霉素漂洗1次,PBS再次冲洗2次后剪成约1 mm3的组织小块,加入4 mL 0.125%的胰酶消化液于4 ℃过夜。次日,加入6 mL 0.08%胰酶于37 ℃静置5 min,胶头滴管轻轻吹打5 min,上清与血清混合以终止消化,重复以上步骤至组织块消失。细胞混合液于1 000 r/min离心5 min,用6 mL含10%胎牛血清的DMEM培养基重悬接种到培养瓶,90 min后按所需密度接种细胞,并加入终浓度为0.1 mmol/L的5-溴脱氧尿嘧啶置37 ℃,5%CO2的培养箱中培养72 h,采用cTnT鉴定细胞纯度。
1.2.5PNRCMs药物分组 于培养PNRCMs 72 h时点,给药组先用CVB-D和螺内酯预保护2 h,与ALD共同孵育48 h后再进行后续实验。实验分组(1)为对照组(Control)、模型组(ALD,10 μmol/L),CVB-D低剂量组(CVB-D.L,0.1 μmol/L CVB-D+10 μmol/L ALD),CVB-D高剂量组(CVB-D.H, 1 μmol/L CVB-D+10 μmol/L ALD),阳性药螺内酯组(Spir.组,1 μmol/L Spir.+10 μmol/L ALD)。Sirt3的过表达载体(Ad-Sirt3)对CVB-D改善PNRCMs肥大和凋亡的影响分组(2)为阴性对照组(ADV6-NC组),ALD(10 μmol/L)+ADV6-NC组,CVB-D(1 μmol/L CVB-D+10 μmol/L ALD)+ADV6-NC组,Ad-Sirt3组,ALD(10 μmol/L ALD)+Ad-Sirt3组,CVB-D(1 μmol/L CVB-D+10 μmol/L ALD)+Ad-Sirt3组。
1.3 观察指标
1.3.1MTT检测PNRCMs活力 将PNRCMs以1×109个/L的密度接种到96孔板中培养72 h后,分别加入0.1、1、10、100 μmol/L的ALD分别作用12、24、48 h摸索ALD造模浓度和时间,再给予0.1、0.5、1 μmol/L CVB-D和1 μmol/L Spir. 共孵育;48 h后每孔加入20 μL MTT(5 g/L)孵育4 h,弃上清液,每孔加入150 μL DMSO后,置于水平摇床至底部晶体溶解;最后,在490 nm处测定吸光度值,计算细胞存活率。
1.3.2吉姆萨染色观察细胞形态 提取PNRCMs后接种于6孔板,培养72 h后按方法1.2.5分组(1)进行给药处理;48 h后弃培养基,PBS洗3次,4 %的多聚甲醛固定15 min;按照试剂说明书加入吉姆萨A液和B液染色,于倒置显微镜下观察并拍照。
1.3.3LDH的测定 提取PNRCMs后接种于6孔板,培养72 h后按方法1.2.5分组(1)进行给药处理;48 h后收集细胞上清液,及时根据南京建成生物工程研究所的试剂盒说明书进行检测,最后于450 nm处测定吸光度值,计算结果。
1.3.4免疫荧光检测细胞表面积 提取PNRCMs后接种于6孔板,培养72 h后按方法1.2.5分组(1)进行给药处理;48 h后弃细胞培养液,PBS洗3次,4 %的多聚甲醛固定15 min,PBS洗3次,山羊血清封闭40 min;加入cTnT(1∶500)一抗孵育过夜;次日,避光回收一抗,PBS洗 3次;先孵育荧光二抗1 h,再用DAPI染细胞核 5 min;最后于倒置荧光显微镜下观察并拍照。
1.3.5Western blot检测蛋白的表达 取5 mg心脏组织,剪碎后加入RIPA裂解液,置冰上振摇30 min;PNRCMs按方法1.2.5分组(1)处理,48 h后弃细胞培养液,加入RIPA裂解液置冰上振摇30 min提取细胞总蛋白。BCA定量试剂盒定量,分装好的蛋白经SDS聚丙烯酰胺凝胶电泳分离,湿法转膜,将蛋白转至PVDF膜上,用5%牛血清白蛋白V封闭2 h,按照不同蛋白的分子量剪膜,加入相应的一抗孵育:ANP(1∶1 000)、BNP(1∶500)、Bax(1∶2 000)、Bcl2(1∶2 000)、Caspase3(1∶1 000)、Sirt3(1∶1 000)、PPARγ(1∶1 000)、GAPDH(1∶10 000),室温孵育30 min,4 ℃过夜。次日孵育相应的二抗90 min,TBST洗3次。ECL发光液淋膜,采用Bio-Rad蛋白质印迹成像系统显影,采集图像,最后用Image Lab 4.0软件对蛋白条带的灰度值进行分析。
1.3.6Sirt3在PNRCMs中过表达 提取PNRCMs后接种于6孔板,每孔加入1 mL中含1 μL腺病毒的培养液感染细胞,适当晃荡6孔板,在37 ℃培养箱孵育8 h后更换新培养液,待细胞恢复12 h后给药。通过免疫印迹检测转染效率。
1.4 统计学方法
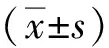
2 结果
2.1 CVB-D对ALD诱导小鼠心功能的影响
小动物B超仪检测心功能结果如图1所示,与Control组相比,ALD组小鼠心动图紊乱无规律,心脏质量/体质量(HW/BW)增加(P<0.01),LVEF、LVFS均降低(P<0.01);与ALD组相比,CVB-D.L组、CVB-D.H组小鼠心动图较为规律且清晰,显著降低HW/BW(P<0.01),升高LVEF和LVFS (P<0.01)。以上提示CVB-D可改善ALD诱导小鼠心脏功能的损伤。

注:A为小鼠超声心动图的代表图,B、C为LVEF和LVFS的统计结果,D为HW/BW统计图;(1)与Control组比较,P<0.01;(2)与ALD组比较,P<0.01。
2.2 CVB-D对ALD诱导小鼠心脏病理形态的影响
HE染色结果显示,Control组小鼠心肌结构完整且排列有序,无明显细胞坏死;ALD组小鼠心肌纤维紊乱,心肌细胞肥大、炎症细胞浸润;CVB-D.L、CVB-D.H组小鼠心脏心肌细胞肥大、坏死等均明显改善。Masson染色结果显示,Control组小鼠胶原纤维排列整齐,无明显胶原沉积;ALD组小鼠胶原纤维沉积、断裂,明显纤维化;CVB-D.L、CVB-D.H组小鼠纤维沉积明显减少。以上结果表明CVB-D改善ALD诱导的心脏组织病理变化。见图2。

注:HE中箭头所指细胞肿胀,纤维排列紊乱;Masson中箭头所指纤维断裂、纤维化。
2.3 CVB-D对ALD诱导小鼠心肌肥厚的影响
WGA是特异性结合心肌细胞膜的糖蛋白,因此,本研究采用WGA染色分析心肌细胞是否肥大。如图 3A所示,与Control组相比,ALD组小鼠心肌细胞明显增大,提示ALD诱导小鼠心肌细胞肥大;与ALD组相比,CVB-D.L、CVB-D.H组小鼠心肌细胞明显减小。为进一步明确CVB-D对心肌肥厚小鼠心脏的保护作用,本研究检测了肥厚指标ANP和BNP蛋白表达水平。如图3B所示,与Control组相比,ALD组小鼠心脏组织ANP、BNP表达明显上调(P<0.05);与ALD组相比,CVB-D.L、CVB-D.H组ANP、BNP表达明显下调(P<0.05)。以上结果表明,CVB-D改善ALD诱导的小鼠心肌肥厚。

注:A为CVB-D对ALD诱导心肌细胞面积的影响(400×),B为ANP和BNP蛋白的表达水平,(1)与Control组比较,P<0.05;(2)与ALD组比较,P<0.05。
2.4 CVB-D对ALD诱导PNRCMs损伤的影响
2.4.1ALD和CVB-D对PNRCMs活力的影响 PNRCMs纯度鉴定结果见图 4A。ALD分别以0.1、1、10、100 μmol/L处理PNRCMs 12、24、48 h,如图4B所示,与Control组相比,PNRCMs活力均有不同程度的降低(P<0.05);最终选择10 μmol/L的ALD作用PNRCMs 48 h时,细胞活力降低了20%(P<0.01);如图4C所示0.1、0.5及1 μmol/L的 CVB-D对ALD诱导的PNRCMs损伤均有改善作用(P<0.05)。
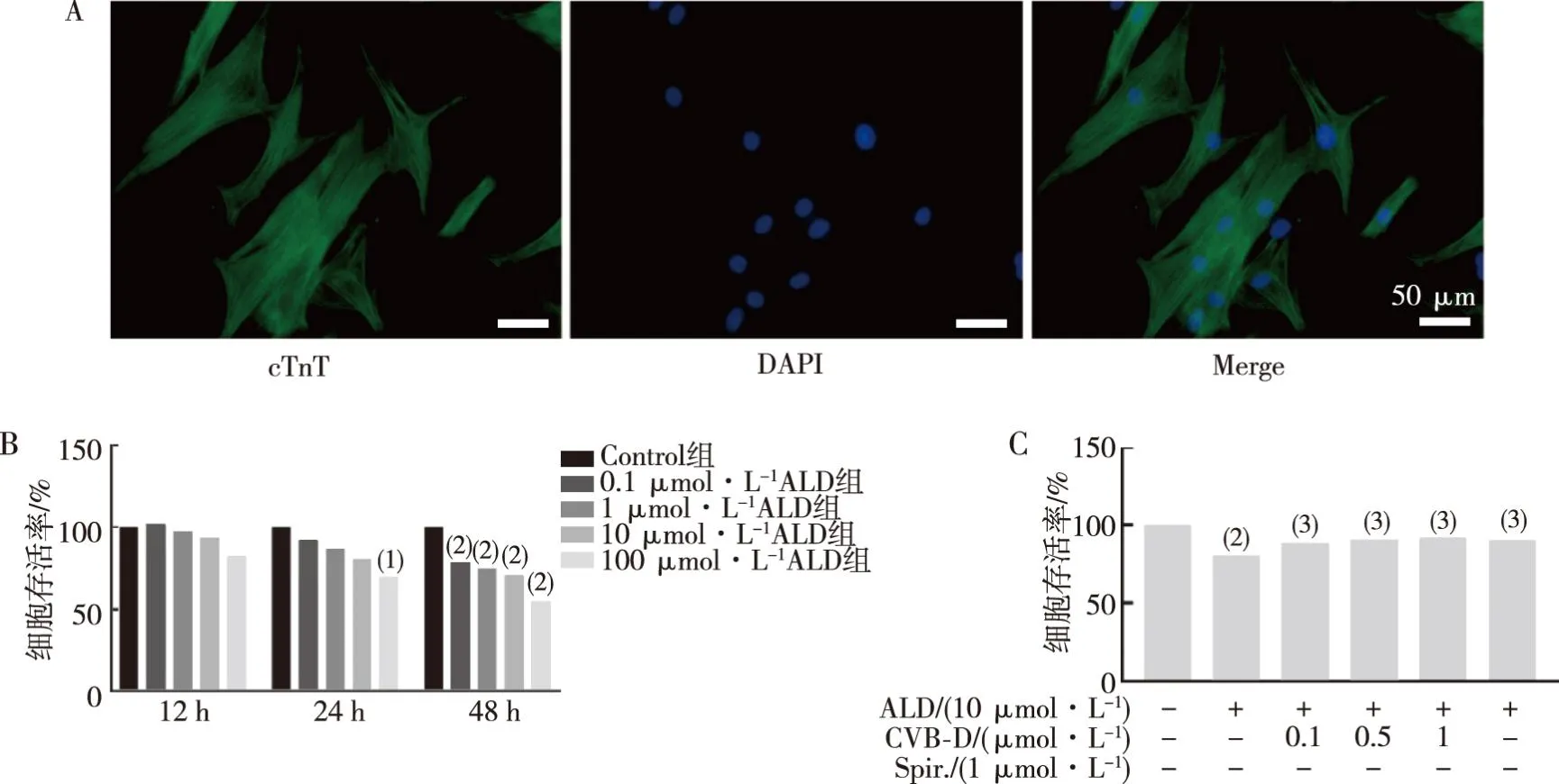
注:A为免疫荧光法鉴定PNRCMs纯度图(400×),B、C为不同浓度ALD对PNRCMs活力的影响;(1)与Control组比较,P<0.05;(2)与Control组比较,P<0.01;(3)与ALD组比较,P<0.05。
2.4.2CVB-D对ALD诱导的PNRCMs损伤的影响吉姆萨染色结果显示,与Control组相比,ALD导致PNRCMs肥大,细胞核易位、皱缩,出现空泡化,而CVB-D可以改善以上细胞形态变化,见图5A。LDH结果显示,与Control组相比,ALD组胞内LDH的渗漏增加(P<0.01),而CVB-D.L、CVB-D.H组均降低了胞内LDH渗漏(P<0.05),见图 5B。以上结果提示,CVB-D可以改善ALD诱导PNRCMs损伤。

注:A为吉姆萨染色观察PNRCMs形态(200×),B为细胞培养上清液中LDH的泄漏率;(1)与Control组比较,P<0.01;(2)与ALD组比较,P<0.05。
2.5 CVB-D对凋亡相关蛋白Bax,Bcl2,Caspase3表达的影响
Western blot结果提示(见图6),与Control组相比,ALD组中Bax和Caspase3的蛋白表达水平上调(P<0.01),Bcl2的蛋白水平下调(P<0.01),而CVB-D可逆转上述蛋白的表达(P<0.05)。提示CVB-D可以改善ALD诱导的细胞凋亡。

注:A为Bax、Caspase3和Bcl2蛋白印迹代表图,B为Bax、Caspase3和Bcl2蛋白表达定量结果;(1)与Control组比较,P<0.01;(2)与ALD组比较,P<0.05;(3)与ALD组相比,P<0.01。
2.6 CVB-D对ALD诱导的PNRCMs肥大的影响
cTnT荧光染色结果如图7A所示,与Control组相比,ALD组心肌细胞表面积增大,CVB-D显著降低心肌细胞表面积。Western blot结果也提示,与Control组相比,ALD处理增加了肥厚蛋白ANP和BNP的表达水平(P<0.05),而CVB-D.L、CVB-D.H组均逆转ANP和BNP的蛋白表达水平(P<0.05),见图 7B。以上结果表明CVB-D可以改善ALD诱导的PNRCMs肥大。

注:A为cTnT检测PNRCMs细胞大小的荧光图(400×),B为ANP和BNP蛋白的表达水平;(1)与Control组比较,P<0.05;(2)与ALD组比较,P<0.05;(3)与ALD组相比,P<0.01。
2.7 CVB-D对ALD诱导的Sirt3和PPARγ蛋白表达的影响
Western blot结果如图8所示,与Control组相比,ALD组中Sirt 3和PPARγ的蛋白表达水平下调(P<0.01),CVB-D上调Sirt 3和PPARγ的表达(P<0.05),提示Sirt3和PPARγ参与了CVB-D改善ALD诱导的心肌肥大的过程。

注:A为Sirt3和PPARγ蛋白印迹代表图,B为Sirt3和PPARγ蛋白表达定量结果;(1)与Control组比较,P<0.01;(2)与ALD组比较,P<0.05。
2.8 CVB-D改善ALD诱导的PNRCMs肥大和凋亡与上调Sirt3信号的关系
Western blot结果显示,ALD可显著增加ANP、BNP、Bax和Caspase3的表达(P<0.01),降低Bcl2、PPARγ和Sirt3的表达(P<0.01),单独使用CVB-D或Ad-Sirt3可降低ANP、BNP、Bax和Caspase3蛋白的表达(P<0.05),增加Bcl2、Sirt3和PPARγ的表达(P<0.05),提示在ALD诱导心肌肥厚中Sirt3可能作为一种负调控因子;CVB-D和Ad-Sirt3联合应用时则增强了CVB-D下调肥大、凋亡和PPARγ蛋白表达的能力(P<0.05),提示CVB-D可能通过调节Sirt3/ PPARγ信号改善ALD诱导的心肌肥厚和凋亡。见图9。
3 讨论
心肌肥厚是心力衰竭最危险的独立病理因素之一,是心脏为了满足应激需要而激活的一种保护机制。但长期的心肌肥厚会影响心肌供需,诱发心肌梗死、心律失常和心力衰竭等多种心血管疾病[15],探究心肌肥厚的治疗策略对预防心力衰竭有益。ALD是一种盐皮质激素,它可以调节电解质稳态、容量和血压等,但心脏长期处于高ALD的环境,心肌和周围血管易发生纤维化,促进胶原纤维形成、心室重塑,从而引发心脏衰竭;使用ALD拮抗剂如螺内酯等对降低心衰的死亡率有一定作用[16-17]。因此,阐明ALD诱导心肌肥厚的发病机制十分重要。
中药是我国传统中医特有药物,而且在治疗心肌肥厚方面颇有疗效。CVB-D是传统中药小叶黄杨的主要活性成分,对治疗心血管疾病有良好的药理活性,临床常用制剂有黄杨宁片[18]。现有多项研究揭示CVB-D的作用机制与Nrf2抗氧化通路[19]和NLPR3抗焦亡[20]等通路相关。凋亡是心肌细胞死亡的重要途径之一,而心肌细胞死亡是心肌肥厚发展为心力衰竭的重要事件,提示抑制细胞凋亡对心脏保护有重要作用[21]。本研究结果表明,ALD成功诱导心肌肥厚的过程中触发凋亡,并下调了Sirt3和PPARγ的表达,而CVB-D减轻肥厚,抑制凋亡,上调了Sirt3和PPARγ的表达,这提示Sirt3/PPARγ信号通路参与了CVB-D改善心肌肥厚和凋亡的过程。
Sirt3是烟酰胺腺嘌呤二核苷酸(NAD+)依赖性组蛋白Ⅲ类去乙酰化酶,参与凋亡、调控代谢和基因转录等多种细胞进程[22]。Sirt3信号通路与心肌肥厚的发展密切相关,在心肌肥厚中Sirt3激活有益于改善心脏功能障碍和重塑[23],敲低Sirt3促进心肌细胞凋亡和氧化应激,显著恶化心肌纤维化和肥大[24],这表明激活Sirt3通路可能是治疗心肌肥厚的潜在策略。PPARγ在治疗心肌纤维、心力衰竭方面有重要意义。PPARγ的激活可以抗心肌凋亡,从而减轻心脏损伤,保护心脏;心肌细胞特异性缺乏PPARγ会导致心肌肥厚,而PPARγ的激活可以减轻肥厚[25-26]。此外,现有研究表明Sirt3通过调控PPARγ改善心功能等[26-27]。本研究发现,CVB-D通过上调Sirt3信号发挥抗肥厚和抑制凋亡的作用。
综上所述,本研究初步证实了CVB-D对PNRCMs的保护、减轻ALD诱导的心肌肥厚和抑制凋亡作用,其机制可能与调节Sirt3/PPARγ信号通路相关,为心肌肥厚的治疗提供新的理论基础。然而,深层次的调控机制及作用位点尚待进一步研究。

