光损伤视网膜片培养上清液诱导大鼠骨髓间充质干细胞为视网膜样细胞的研究
白 月 徐国兴 陈金国 谢茂松 郭 健 王婷婷
光损伤视网膜片培养上清液诱导大鼠骨髓间充质干细胞为视网膜样细胞的研究
白 月 徐国兴 陈金国 谢茂松 郭 健 王婷婷
福建医科大学附属第一医院,福建省眼科研究所
目的:探讨大鼠视网膜片光损伤后诱导体外培养的大鼠骨髓间充质干细胞(MSCs)成视网膜细胞的可能性。方法:实验研究。采用贴壁筛选法分离、培养SD大鼠骨髓MSC细胞,经流式细胞仪鉴定后,用大鼠视网膜片光损伤后的上清液与10%FBS的LG-DMEM以2:3混合成的条件培养液诱导MSC细胞7~8d。用免疫细胞化学染色和RT-PCR观察诱导后的细胞是否表达视紫红质、GFAP、NSE。结果:第3代MSC细胞经诱导后有(36.64±7.84)%表达rhodopsin, (20.21±6.47)%表达GFAP, (21.83±2.98)%表达NSE。RT-PCR鉴定结果分析示GFAP、NSE、Rhodopsin mRNA均有表达。结论:光损伤SD大鼠视网膜片培养上清液可诱导MSCs分化为视网膜样细胞。
骨髓间充质干细胞 视网膜细胞 大鼠
成体干细胞中的骨髓间充质干细胞(mesenchymal stem cells, MSCs)具有多向分化的潜能,虽然其来源于中胚层,却可以跨胚层分化为外胚层来源的组织细胞,而视网膜则来源于胚胎期神经外胚层。MSC表达许多生长因子和细胞因子受体以及细胞与细胞黏附作用的受体,提示MSC的功能受自分泌和旁分泌循环的调控。这成为不同方法诱导MSCs定向分化的理论基础。组织或细胞在受到损伤后会进行自身修复,视网膜是接受光能,形成视觉的重要组织结构,如果光照强度或光照时间超过了视网膜的承受力,将会造成视网膜光损伤。本研究旨在用光损伤视网膜片的培养上清液体外诱导MSCs,看其损伤时分泌的细胞因子和分化所需蛋白是否能诱导MSCs分化为视网膜光感受器样细胞和视网膜神经细胞。探索体外构建MSCs分化成视网膜细胞所需微环境的理论可能性。
1 材料与方法
1.1 实验动物
健康无眼病成年Sprague-Dawley(SD)大鼠,雌雄不限,体重120~150g(吴氏实验动物中心)。
1.2 大鼠视网膜片的取材
10%水合氯醛按0.3mL/100g腹腔注射麻醉,无菌状态下取出眼球。把眼球用10%FBS的LG-DMEM洗涤3次,去除球周筋膜组织,清洗干净后移入另一盛有10% FBS的LG-DMEM培养皿中,在解剖显微镜下,在角巩膜缘后1mm处剪开,用显微剪取出角膜、晶状体、玻璃体,留有外层覆盖巩膜的视网膜杯。把视网膜杯浸入培养皿中的培养液里,由杯缘向杯底,用显微镊钝性分离视网膜和巩膜,在视神经处剪断,彻底分离视网膜色素上皮层与视网膜神经上皮层。
1.3 大鼠视网膜神经上皮层常规石蜡切片HE染色
将大鼠视网膜片(只包含神经上皮层)常温浸泡甲醛24h以固定,常规脱水、透明、包埋、切片,常规脱蜡,行苏木素-伊红(HE)染色,封片。用数字摄像系统观察并采集照片。
1.4 视网膜片光损伤和条件培养液的制备
把分离好的4只眼球的视网膜神经上皮层移入另一盛有8mlNeurobasal+B27的小培养皿中(直径60mm)。用眼科显微剪把视网膜神经上皮层剪成1mm×1mm×1mm大小。在超净台内,50W,12V的卤素灯作为光源,采取直落式照射上述的小培养皿,用TES-1330A照度计测定光照强度,调整光源与培养皿之间的距离(3.5cm),使被照细胞同一水平的光照强度为(1950 ±200)Lux ,光照时该水平温度变化在0.5℃之内,持续光照45min,光照后将培养皿放入37℃、5%CO2饱和湿度培养箱继续培养1小时15min。用去针头的针筒吸出小培养皿中的液体,离心后上清液用0.22um滤器过滤,以2:3的比例与10%FBS-LGDMEM混合,并吹打均匀,制成条件培养液Ⅰ。条件培养液Ⅱ制备方法同条件培养液Ⅰ,只是视网膜片未经过光损伤处理,盛有Neurobasal+B27和视网膜神经上皮层的小培养皿直接放入37℃、5%CO2饱和湿度培养箱培养2小时。条件培养液Ⅲ为Neurobasal+B27和10%FBS-LGDMEM以2:3的比例混合,无视网膜片以及光损伤处理。三种条件培养液均放于-20℃保存。
1.5 视网膜神经上皮层光损伤后电镜观察
取材,3%戊二醛—1.5%多聚甲醛前固定,1%锇酸—1.5%亚铁氰化钾后固定,酒精—丙酮脱水,环氧树脂618包埋剂包埋;超薄切片,醋酸铀、柠檬酸铅染色,日立Hu-12A型(飞利浦208型)透射电镜观察、摄影。
1.6 大鼠MSC的分离和培养
取SD大鼠,麻醉后,无菌条件下取出双侧股骨和胫骨,剔除周围肌肉组织。在超净台内,用PBS冲干净,转移到盛有20%FBS-LGDMEM的培养皿中,去除长骨2端骨骺,暴露骨髓腔。用培养液冲出骨髓腔内的骨髓液,吹打。用200目筛网过滤后置于离心管中,1000rpm,10min,弃上清,用10%FBS-LGDMEM培养液重悬后以10×108/mL接种于塑料培养瓶中。37℃、5%二氧化碳培养,24h换液,以后每3d换液一次,除去非贴壁细胞,12~15d后MSC达90%瓶底面积时传代,P1后细胞融合至80%进行1:2传代。
1.7 MSC的鉴定
当第3代的BMSCs融合达90%,经0.25%胰蛋白酶-0.02%EDTA消化、离心后用PBS制成2×106/mL的细胞悬液,将细胞悬液分装至4只样品管中,分别加入荧光标记的小鼠抗大鼠单抗CD34-FITC+小鼠抗大鼠单抗CD90-PE,小鼠抗大鼠单抗CD34-FITC+小鼠抗大鼠单抗CD44-PE及其对应的同型对照各10μL,混匀,37℃下避光反应20min。每管加入1mLPBS混匀,离心2000rpm,10min以洗去未标记上的抗体。弃上清液,每管再加入1mLPBS重新混悬细胞,用流式细胞仪检测细胞表面抗原CD34、CD44和CD90的表达。对细胞纯度进行鉴定。
1.8 MSC体外诱导成视网膜细胞
取第3代BMSCs细胞消化、离心后用10%FBS-LGDMEM重悬后以200ul/孔接种于6孔板,24h待BMSC贴壁后,弃培养液,将细胞分为3组:第1组换用条件培养液Ⅰ,第2组换用条件培养液Ⅱ,第三组换用条件培养液Ⅲ,3个组均在在37℃、5%CO2培养箱孵育。每天观察记录细胞生长分化情况,每2天换一次条件培养液,培养至第7~8天时停止。
1.9 诱导的BMSCs细胞免疫化学染色
采用Envision二步法,分别将3组诱导的MSC玻片取出,均与神经元特异性标志小鼠抗大鼠醇化酶(NSE)(稀释度1:50)(美国Fisher Scientific公司)、星形胶质细胞特异性标志小鼠抗大鼠单克隆抗体神经胶质酸性蛋白(GFAP)(稀释度1:50)(美国Fisher Scientific公司)、光感受器特异性标志小鼠抗大鼠单克隆抗体视紫质(Rhodopsin)(稀释度1:50)(美国Fisher Scientific公司)和二抗(生物素标记的羊抗鼠IgG抗体)作用,二氨基联苯胺(diaminobenzidin,DAB)显色后,苏木素复染,室温干燥后封片,光镜下观察是否表达视紫红质、NSE、GFAP。选取至少10个随机视野,每个视野在200倍物镜下统计阳性细胞数和整个视野细胞总数,计算阳性细胞率,测量值均以x±s表示,来对三种诱导条件下所表达的阳性细胞进行分析。
1.10 数据分析方法
所有数据用均数±标准差表示,并进行双因素方差分析。
2 结果
2.1 大鼠视网膜片光损伤电镜观察所见:光损伤后视网膜神经上皮层,可见光感受器外段肿胀成圆形,盘膜结构紊乱,叠状结构解离,膜间隙增大。内节线粒体固缩和肿胀,空泡变性。染色质浓染,核膜皱缩内陷。
2.2 大鼠MSC细胞的鉴定(如图1)
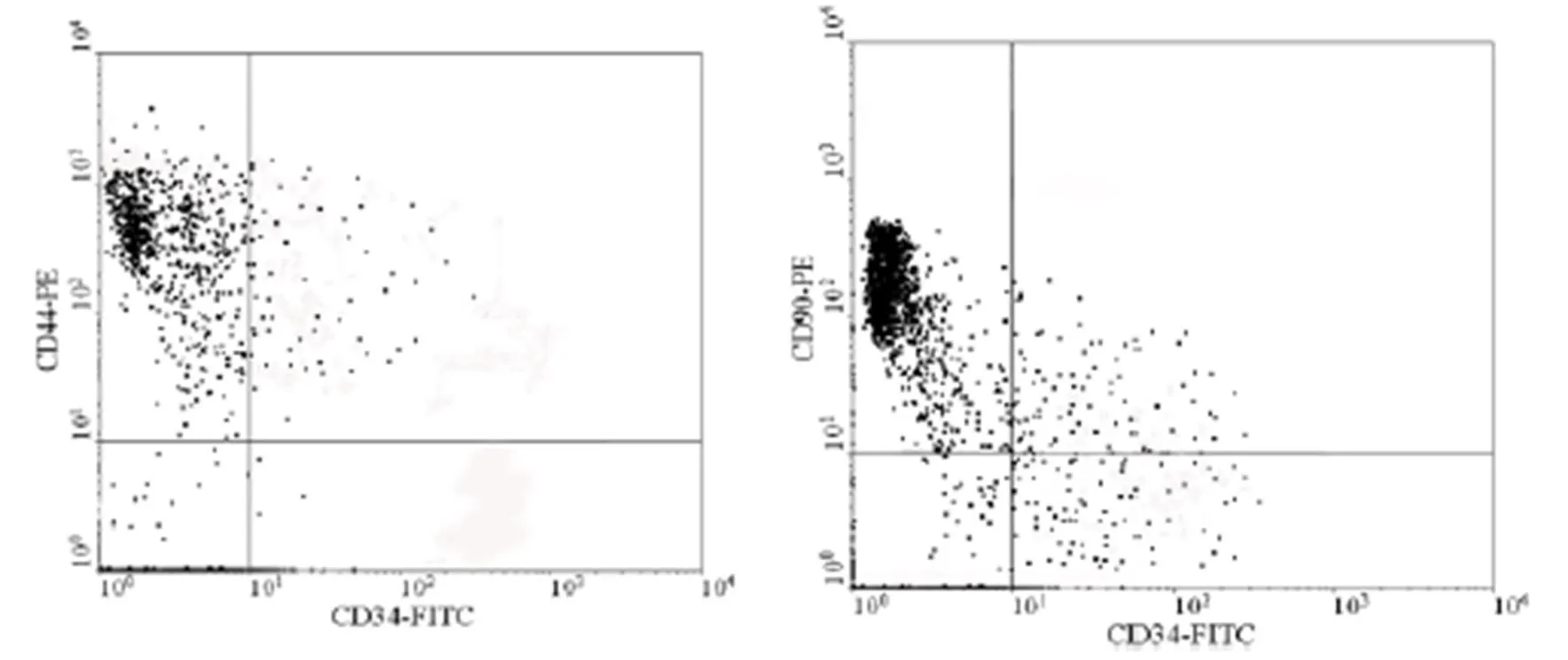
图1 大鼠MSC细胞的鉴定
BMSCs流式细胞术鉴定结果,培养的第三代BMSCs干细胞表面标志CD90阳性(CD90+/CD34-:92%),基质细胞表面标志CD44阳性(CD44+/CD34-:93%)
2.3 诱导分化的细胞形态学观察(如图2)
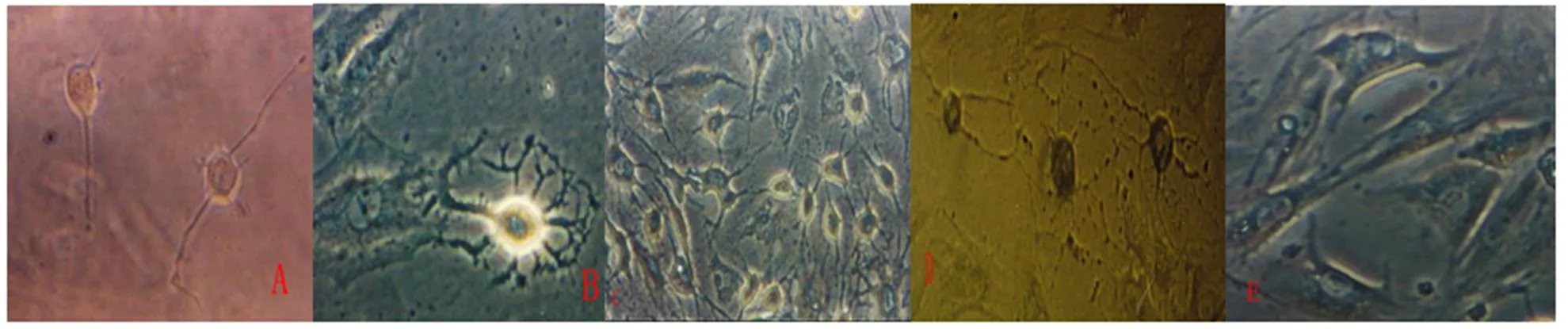
A:3天后原来梭形的BMSCs胞体发生收缩,呈圆形或椭圆形,细胞边缘变得不规整,有零星的细胞突起×300;B:4天后BMSCs有较多突起×300;
2.4 诱导分化的视网膜样细胞不同诱导条件下免疫细胞化学染色表达指标阳性率

表1 不同诱导条件下免疫细胞化学染色表达指标阳性率
注:均方比F值为7.6054,F0.05=6.944,可见视网膜片三组间两两比较差异有显著性(P <0.05)。
3 讨论
3.1 视网膜光损伤
视网膜是接受光能,形成视觉的重要组织结构,但也是眼组织中最易受到光损伤的部位。如果光照强度或光照时间超过了视网膜的承受能力,将会造成视网膜光损伤。
本实验采用(50W,12V的卤素灯作为光源,采取直落式照射上述的小培养皿,1950 ±200Lux)主要是考虑到以下几点:①视网膜光损伤受诸多因素影响,内在因素包括视网膜部位、体温、肤色、年龄、种属、营养状态及晶体状况,外在因素包括视网膜暗适应状态、光照射方式、光强度、波长和光照时间。因此本实验选择单纯照射细胞而不是照射活体动物来尽量排除内在因素的干扰,选择成年SD白鼠是考虑到有研究表明白种人较黑种人容易损伤,大白鼠视网膜对光的敏感性随着年龄的增加而增高。②视网膜光化学损伤的敏感性随着光波长的缩短而呈对数上升,因此短波长更易引起视网膜光损伤,角膜可吸收<295nm的紫外线,晶体可吸收波长<400nm,而且短波长的近紫外光引起的视网膜损伤主要位于色素上皮层,而我们取的SD大鼠视网膜片只有神经上皮层,所以不考虑用紫外光进行光损伤。红外光波长大于可见光,造成视网膜损伤不仅有光化学损伤还有热损伤,并且以损伤视网膜色素细胞为主,而光化学损伤在视网膜光损伤中最具普遍性和重要性,可见光造成视网膜光损伤属于光化学损伤,而且可见光为随处可见光源,并可到达人眼视网膜,因此最终考虑用卤素灯作为光损伤光源。③光对视网膜损伤有3种方式:热损伤、机械损伤、光化学损伤。要注意避免光照时温度的升高,因为温度升高可以增加视网膜光损伤的易感性,温度每升高2℃,视网膜损伤阈较正常体温降低5~10倍,要使温度变化在10℃以内以排除温度升高引起细胞光热损伤的可能[1]。④照射时间相同时,照射强度增加,损伤加重。光照强度相同条件下,光照时间越长,损伤越重。Semple-Rowland提出65~130lux为损伤的阈值,宋忆淑等将装有RPE细胞的6孔培养板放在光照器下,卤钨灯为光源,(1950±200)Lx的光照强度,持续光照30min,光照结束后.继续培养。分别于光照结束后30 min及2 h对培养的RPE细胞进行倒置相差显微镜观察。同时采集培养的RPE细胞,进行透射电镜观察根据预实验电镜结果,随着光照后培养时间的延长,细胞出现损害的程度逐渐加重,受损的细胞数目逐渐增多[2]。
3.2 MSC细胞分离、培养、鉴定
用组织工程技术体外分离和培养所需靶细胞,用于体内相关疾病的细胞替代治疗为多种疾病带来了新的治疗思路。因此有关此类的研究受到广泛关注。胚胎干细胞具有发育全能性,但涉及伦理学问题,以往受到很大限制,发展缓慢。应用眼色素上皮缘的视网膜干细胞[3]及鼠脑神经先祖细胞移植[4]也由于供体组织有限性及安全性问题,不利于治疗视网膜疾病的开展。于是有人把目光投向成体干细胞中的MSCs,因其来源于中胚层,可以跨系统甚至跨胚层分化为3个胚层来源的细胞,特别是中胚层和神经外胚层来源组织的细胞(视网膜来源于胚胎期神经外胚层),并且经过20~30次细胞分裂后,这种分化特性也不会消失[5]。且分离培养方便。MSC存在于体内多处如胎血、胎肝、胎脾、胎儿的骨髓以及成人骨髓[6], 脐血、脂肪组织和成人的外周血中亦含有数量极少的间质干细胞[7],现多从骨髓中分离获得。MSC的纯化方法有贴壁筛选法,流式细胞仪分选法,密度梯度离心法,免疫磁珠法。较常采用的方法为贴壁筛选法和密度梯度离心法,或两者联合。MSCs的表面标志具有非单一性,表达了间质细胞、内皮细胞和表皮细胞的表面标志,一般认为CD29、CD44、CD71、CD90、CD105、CD120a、CD124、CD166以及STRO-1、SH2、SH3是其重要的标志物,流式细胞术发现不表达造血细胞表面抗原如CD34、CD45、CD11a、CD14。如果能找到更特异性标记物,就可以获得更纯的MSCs,这对后续的实验步骤所得的实验数据有重要影响。前2种方法分离所获得的细胞纯度较低,但具有良好的细胞分化能力。应用流式细胞仪技术和磁性分选技术针对细胞表面标志进行富集和分离,分选效率和纯度均较高[8-9]。
3.3 MSC体外诱导成视网膜细胞
目前国内外主要用生长因子诱导MSCs分化为视网膜细胞。Anthony K等[8]发现EGF、taurine或activinA体外诱导大鼠MSCs,有20%~32%表达视网膜光感受器细胞的表面抗原视紫红质。Anthony K等[8]应用activinA(活化蛋白A),牛磺酸和EGF对成人CD90+MSCs体外诱导分化后,20%-32%的细胞表达感光细胞特异标志—视紫红质,视蛋白,recoverin。非视网膜来源的,可替代视网膜细胞功能的自体细胞是细胞移植治疗视网膜变性疾病和视神经损伤的理想种子细胞,目前国外有少量研究发现MSCs视网膜下移植可诱导分化为视网膜细胞,但由于体内局部微环境复杂,影响因素繁多,移植细胞的分化方向不确定,往往无法定向分化成所需细胞,存在表达增殖性玻璃体视网膜病变的潜在危险。而体外诱导MSCs定向分化为视网膜细胞仍是当前研究的难点。国内外仅数篇文献报道用视网膜片培养上清液体外诱导MSCs分化为视网膜样细胞,但均未对培养上清液成分进行具体分析检测,分析其有效成分。本实验探索体外诱导MSCs定向分化的新途径,可进一步进行蛋白质组学技术检测不同诱导微环境的蛋白差异,为构建MSC体外诱导分化为视网膜细胞的微环境提供理论支持。这不仅解决了直接将MSCs体内移植分化方向不确定的问题,以及应用异体的人视网膜片诱导时可能引发排斥反应等问题。
[1]Noell WK.Possible mechanisms of photo receptor damage by light in mammalian eyes[J]. Vision Res,1989,20(12):1163-1171.
[2] 宋忆淑,贺冰,费向东,等. 可见光照射致培养的视网膜色素上皮细胞凋亡的超微结构观察[J].中国老年学杂志,2001,25(1):69-70.
[3] Tropepe K, Brenda LK,Bernard JC, et al. Retinal stem cells in the adult mammalian eye[J].Science, 2000,287:2032-2036.
[4] Van Hoffelen, Samantha J. Young, Michael J.Shatos, et al. Incorporation of murine brain progenitor cells into the developing mammalian retina[J].Invest.Ophthalmol.Vis.sci,2003,44:426.
[5] Friedenstein AJ,ChailakhyanRK,GerasimonUV.Bone marrow osteogenic stem cells:in vitro cultivation and transplantation in diffu-sion chamber[J].Cell Tissue Kinet,1987,20(3):263-272.
[6] Campagnoli C,Roboerts AG,Kumar S,et al.Identification of mesenchymal stem progenitor cells in human first-trimester fetal blood,liver,and bone marrow[J].Blood,2001,98(8):1396-1402.
[7] EricesA,Conget P,Minguell JJ.Mesenchymal progenitor cells in human umbilical cord blood[J].Br J Haematol,2000,109(1):235-242.
[8] Anthony K, Wei-Yong S, Ann S, et al. Differentiation of marrow stromal cells into photoreceptors in the rat eye [J]. J Neuros, 2003, 23(21) : 7742-7749.
[9] Minoru T, Yasushi A, Haruhiko Y, et al.Bone Marrow-derived stem cells can differentiate into retinal cells in injured rat retina[J]. StemCells, 2002, 20: 279-283.
1.福建省重点科研课题(基金编号2008Y0040);2.国家卫生部科研基金课题(基金编号:WKJ2008Y004-2-61)。
徐国兴,zjfmuxgx@pub5.fz.fj.cn。

