木瓜蛋白酶水解克氏原螯虾虾壳提取虾青素的研究
钱飞, 刘海英, 过世东
(江南大学食品学院,江苏无锡 214122)
木瓜蛋白酶水解克氏原螯虾虾壳提取虾青素的研究
钱飞, 刘海英, 过世东*
(江南大学食品学院,江苏无锡 214122)
研究以克氏原螯虾壳为原料,利用木瓜蛋白酶对其水解提取虾青素,通过单因素试验和中心点实验设计试验优化最佳酶解工艺条件。结果表明,酶解最适条件为:酶解温度48.5℃、p H值5.8、酶活力为2 522U/g、水解时间63min、配液与底物固比2∶1(g∶m L),每克湿虾壳含总类胡萝卜素115.76μg,比用酸处理法提取量提高13.82%。高效液相检测其虾青素质量浓度达到13.06 g/dL,显著提高了萃取物中虾青素浓度,为虾的废弃物的综合利用提供了新的途径。
虾青素;木瓜蛋白酶;中心点实验设计;克氏原螯虾壳
虾青素(astaxanthin),学名为 3,3′-二羟基-4,4′-二酮基-β,β′胡萝卜素 , 属于叶黄族 (xanthohylls)酮式类胡萝卜素,易溶于有机溶剂,难溶于水,具有独特的着色、抗氧化、防癌[1-2]、促进抗体产生、抵御紫外线、带维生素A活性、改善视力、免疫力、色素形成和神经连通以及改善生育等功能[3]。虾青素广泛存在于自然界中,如:大多数甲壳类动物和鲑科鱼类体内,植物的花中以及火烈鸟的羽毛中等,起显色作用。绝大多数海产甲壳动物和鱼类等自身不能合成虾青素,而仅通过食物链从海洋微藻、浮游动植物获取[4],从而在其体内富集。文献资料表明:Ssahindranm等[5]在印度洋海域的甲壳纲动物中,发现虾青素及其酯占总类胡萝卜素的质量分数为65.5%~67.6%;Gladisn等[6]通过实验证明在墨西哥弯捕获的龙虾中,虾青素双酯、单酯、游离虾青素及叶黄素分别占总类胡萝卜素的质量分数为7.0%、12%、10%、8%。
目前,提取虾青素的方法有很多,姜启兴等(2003年)[7]报道了目前国内外从甲壳类水产品加工下脚料中提取虾青素的提取方法有碱提法、油溶法、有机溶剂法、超临界CO2萃取法。
克氏原螯虾俗称小龙虾,在我国分布广,捕捞量大,加工后的废弃物占原料的70%~85%,是提取虾青素的一种良好来源。但是在国内的小龙虾加工中,虾壳除提取壳聚糖外,绝大多数被废弃,造成资源浪费和环境污染,不利于其综合利用。
本文采用木瓜蛋白酶酶解克氏原螯虾虾壳提取虾青素,利用酶法脱蛋白,其化学试剂用量少,蛋白质回收容易。同时,木瓜蛋白酶可选择性降解甲壳素的 GIcNAc-GleN糖苷键,有利于虾青素的提取[8]。利用此方法回收虾青素,经济可行,污染小,对克氏原螯虾的加工下脚料的综合利用具有重要的意义[9-10]。
1 材料与方法
1.1 材料与仪器
克氏原螯虾壳(质量分数)(水分54.39%、粗蛋白 13.45%、灰分 25.88%、粗脂肪 1.93、其它4.65%),江苏宝龙集团有限公司提供;
木瓜蛋白酶(2.0×106U/g):购于广西南宁厐博生物工程有限公司;虾青素标准样品:购于sigma公司;乙腈,色谱纯,其余试剂纯度为分析纯。
RE-85Z型旋转蒸发仪:上海青浦沪西仪器厂;PW 100型高速万能粉碎机:天津市泰斯特仪器有限公司;水浴恒温振荡器:江苏太仓实验仪器厂;3K30冷冻离心机:SIGMA公司产品;Waters 600高效液相色谱仪:美国Waters公司产品;TU-1900双波长紫外扫描仪:北京普析通用仪器有限公司产品。
1.2 试验方法
1.2.1 原料的预处理 将克氏原螯虾虾壳洗净,沥干,用万能粉碎机粉碎备用。
1.2.2 酸处理提取法 虾壳5 g,往壳中加入2 mol/L的盐酸20 m L,浸渍24 h后,用布氏漏斗双层滤纸抽滤,并用水反复冲洗,除去矿物质,将沉淀物质装于棕色磨口瓶中,加丙酮50 mL,30℃水浴振荡7 h,其间每隔3 h更换丙酮50 mL,合并提取液,静置冷冻2h,快速过滤除杂将所得的有机溶剂溶液,稀释10倍,在474 nm测吸光值,重复试验3次。
1.2.3 酶解提取流程 虾壳5g→加缓冲液混合→调p H→恒温水浴振荡木瓜蛋白酶酶解→冰水浴冷却→布氏漏斗双层滤纸抽滤→并反复用水冲洗(除去矿物质)→沉淀物加入丙酮25 mL→置入超声波清洗池10 min→摇床常温振荡1 h→冷冻离心机在10 000 r/min,4℃下离心10 min→取上清液定容至25 m L的容量瓶中→稀释10倍后,在474 nm,测其吸光值。
1.2.4 分光光度法测定 采用丙酮为提取剂,先称取一定质量的虾青素标准样品,溶于丙酮,配制成虾青素标准溶液,于400~700 nm光波长范围内扫描最大吸收波长及吸光值。试验结果为,虾青素在丙酮溶液中的最大吸收波长为474 nm,标准曲线方程为:

式中:x表示虾青素质量浓度(μg/m L),y表示对应的吸光度,线性回归相关系数显著,虾青素质量浓度在0~6μg/m L范围内具有线性关系。
样品的测定:按照标准曲线绘制的操作条件测定其吸光度,从标准曲线中查出稀释液中总类胡萝卜素浓度。总类胡萝卜素提取量的计算公式:

式中:c为稀释液中总类胡萝卜素质量浓度,单位:μg/m L;N为稀释倍数,本实验中为10;V为定容后的体积,本实验选取25 m L;m为虾壳的质量,单位:g。
1.2.5 高效液相对虾青素检测 标准品溶液:称取虾青素标品10 m g,少量二氯甲烷溶解后,用乙腈定容到100 m L容量瓶。
样品:丙酮提取液,用50 m L石油醚萃取,40℃水浴真空旋转蒸发浓缩至2m L。
色谱条件:色谱柱为 Symm try C18(3.9×150 mm);流动相甲醇—水(90:10,V/V),体积流量0.8m L/min,柱温为30 ℃,检测波长480 nm,进样量为5μm。
虾青素的定量:虾青素的质量=化合物的峰面积与外标(标准品)的峰面积比×外标(标准品)浓度。
1.2.6 试验设计 首先研究不同酶解温度酶解T、p H、酶解时间t、酶与底物比E/S、酶解液固比对提取类胡萝卜素量的影响。再根据单因素试验的结果,以提取类胡萝卜素量为指标,采用中心点实验设计,回归分析用SAS 8.0完成。
2 结果与讨论
2.1 酸处理法提取虾青素
利用酸处理提取虾青素可从湿虾壳中提取总类胡萝卜素(101.70±2.52)μg/g。
2.2 木瓜蛋白酶酶解对总类胡萝卜素提取量的影响
2.2.1 酶解p H对总类胡萝卜素提取量的影响在酶与底比为2 500 U/g,50℃水浴振荡,酶解时间为60 m in,液固比为2∶1(g∶m L)的条件下,考查酶解p H对总类胡萝卜素提取量的影响。

图1 酶解p H对总类胡萝卜素提取的影响Fig.1 Effects of pH on the total carotenoidsamount
图1显示酶解p H对总胡萝卜素提取的影响。当p H值小于6.0时,总类胡萝卜素的提取量随p H值增大而增大;当p H值小于6.0时,总类胡萝卜素的提取量随p H值增大而减小。说明适用于酶解克氏原虾壳的p H值是弱酸性,在p H≈6.0时可能会有最佳点出现。因此选择p H值在5.5、6.0、6.5为响应面试验水平。
2.2.2 酶解时间对总类胡萝卜素提取量的影响酶与底比为2 500 U/g,50℃水浴振荡,酶解p H=6.0,液固比为2:1的条件下,考查酶解时间对总类胡萝卜素提取量的影响。

图2 酶解时间对总类胡萝卜素提取的影响Fig.2 Effect of time on the total carotenoidsamount
图2显示酶解时间对总类胡萝卜素提取量的影响,在初始60 m in内,总类胡萝卜素提取量明显上升趋势,水解时间超过60 min,随着时间的增加提取量反而下降,可能是随着时间的增加,导致类胡萝卜素的破坏。因此以水解时间45、60、75 min为响应面分析实验水平。
2.2.3 酶与底物E/S比对总类胡萝卜素提取量的影响 酶解时间60 min,50℃水浴振荡,酶解p H=6.0,液固比为2∶1(g∶m L)的条件下,考查酶解时的酶与底物比对总类胡萝卜素提取量的影响。

图3 酶与底物比对总类胡萝卜素提取的影响Fig.3 Effect of the ratio of enzyme to substrate on the total carotenoidsamount
图3表明了不同酶与底物比对总类胡萝卜素提取的影响。在酶与底物比达到2 500 U/g前,随着酶用量的增加,水解速度加快,总类胡萝卜素的提取量呈明显上升趋势。当酶活力从2 500 U/g增加到4 000 U/g时,总类胡萝卜素的提取量上升幅度很小,曲线基本趋于平缓。因此酶活力2 250、2 500、2 750 U/g为响应面分析实验水平。
2.2.4 酶解温度对总类胡萝卜素提取的影响 酶解时间60 min,酶活力2 500 U/g,酶解p H=6.0,液固比为2∶1(g∶mL)的条件下,考查酶解温度对总类胡萝卜素提取量的影响。

图4 酶解温度对总类胡萝卜素提取的影响Fig.4 Effect of temperature on the total carotenoidsamount
从图4可以看出在20~50℃,总类胡萝卜提取量随温度的升高而增加。50℃的总类胡萝卜素提取量达到最高。虾青素的提取量随及温度的升高先增加而后减少,这与虾青素多双键,易被氧化或断裂的结构性质有关。赵仪等[11]认为是由于虾青素的化学结构是由4个异戊二烯单位以共轭双键形式联结,两端又有2个异戊二烯单位组成的六元环结构,这个长的共轭不饱和双键结构决定了光、热、氧化物很容易破坏它的结构,可见温度对其影响十分明显。因此,酶解温度45、50、55℃为响应面分析实验水平。

图5 不同液固比对总类胡萝卜素提取的影响Fig.5 Effects of substance consistency on the total carotenoidsamount
2.2.5 液固比对类胡萝卜素提取的影响 酶解时间60 min,酶活力为2 500 U/g,酶解p H=6.0,酶解温度为50℃的条件下,考查酶解液固比对总类胡萝卜素提取量的影响。图5显示不同酶与底物比对总类胡萝卜素提取的影响,可以看出在液固比2:1(g∶mL)之前提取总类胡萝卜素量随着液固比的升高而升高,而在液固比为2:1后,总类胡萝卜素量开始下降。可能是液固太小,振荡不能是酶与底物充分接触;液固过大,导致底物浓度变小。为了生产效率的最佳,确定液固比为2:1(g∶mL)。
2.3 响应面分析结果
为了生产效率的最佳,确定液固比为2∶1,在响应面分析中考虑其它4个因素对虾青素提取量的影响。为找出影响虾青素提取量的主次因素,对以上4因素进行响应面分析实验(见表1)。
2.3.1 数据分析 采用响应面分析法对实验数据进行设计,SAS软件分析及处理数据。
依据表2的设计,应用响应面分析法对虾壳酶解工艺进行优化,得到回归模型的显著性检验及方差分析结果。将所有影响不显著的项剔除,用SAS相应面回归程序,回归拟合得到回归方程如下:其中R2=0.893 4


表1 虾壳酶解中心点实验设计中变量的变化范围和水平值Tab.1 Variance and value of analysis of focal point for experimental design

表2 虾壳酶解工艺中心点实验设计Tab.2 Central point for experimental design for technology for enzymatich hydrolysis

续表2
依据表2的设计,应用响应面分析法对酶解提取工艺优化。得到回归模型的各项估计值、显著性检验以及方差分析结果(见表3,4)。从方差结果可看出,一次项、二次项显著(P<0.05),将所有影响不显著的(P>0.05)项剔除,用SAS做响应面回归程序,回归拟合得到回归方程,可看出R2达到0.8934,说明回归模型显著。分析表明方程中待估特征值均为负,说明指标Y(总类胡萝卜素提取量)的稳定值为响应面最大值。

表3 回归方程中各项的参数估计值Tab.3 Estimated coefficients of the fitted regression equation for different response based on t-statistic

表4 各因素对指标的方差分析Tab.4 Analysis of variance for response of dependent variables
2.4 最佳工艺条件结果验证以及讨论
在中心点实验设计中,中心点试验水平分别为:酶解温度 50℃,p H值 6.0,酶活力为 2 500 U/g,水解时间60 min。经响应面分析,得出的最佳工艺参数以及实验值与预测值见表5。

表5 酶解总类胡萝卜素提取量实验值与预测Tab.5 Comparison between predicting value and experimental value of degree of hydrolysis
由表5可知,Y(总类胡萝卜素提取量)的理论预测最大值为117.09;试验值为115.76,二者接近。
2.5 高效液相结果分析
图6为虾青素标准品的高效液相色谱图。图7优化后的克氏原螯虾壳萃取物的液相色谱图,保留时间为5.976m in的峰为虾青素峰。

图6 虾青素标品的高效液相色谱图Fig.6 HLPC profile of astaxanthin
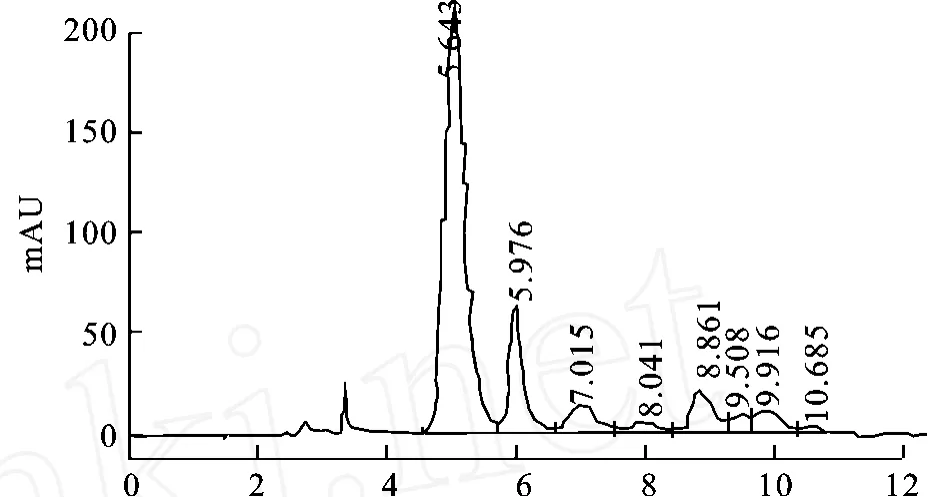
图7 克氏原螯虾虾壳萃取物液相色谱图Fig.7 HPLC profile of Crayfish Shell extract
结果表明,利用木瓜蛋白酶酶解并经用有机溶剂萃取,总类胡萝卜素中虾青素质量浓度达到了13.06 g/dL,其虾青素提取率比酸溶剂法的提取率(3.37%)有显著提高。
3 结 语
利用木瓜蛋白酶酶解处理克氏原奥虾壳提取虾青素,结合单因素法和中心点实验设计计法优化虾青素提取的工艺条件。得到的工艺条件为:酶解温度50.5℃,p H值5.85,水解时间63 min,酶与底物比为2 522 U/g,每克湿虾壳含总类胡萝卜素115.76μg;高效液相检测其虾青素浓度达到达到13.06 g/dL,比用酸处理提取方法的释放率有显著提高。本方法为虾的废弃物的利用提供了新的思路和方法。
(References):
[1]Tanaka T,Makita H,Ohnishi H et al.Chemoprevention of rat oral carcinogenesis by naturally occurring xantho-phylls,antaxanthin and canthaxanthin[J].Cancer Res.,1995,55(18):4059-4064.
[2]Gradelet S,Lebon AM,Berges R et al.Dietary carotenoids inhibit aflatoxin B1-induced liver preneoplastic fociand DNA damage in the rat[J].Carcinogenesis,1998,19(3):403-411.
[3]Nishino H.Cancer prevention by carotenoids[J].Mutat Res.,1998,40(2):159-163.
[4]惠伯棣,钟粟,朱蕾,等.类胡萝卜素生物合成的分子生物学研究[J].食品工业科技,2003(5):106-109.
HUI Ba-li,ZHONG Su,ZHU Lei,et al.Study on molecular biology for the biosynthesis of carotenoids[J].Food Industry Technology,2003(5):106-109.(in Chinese)
[5]Ssahindranm,Bhaskar N,Mahendrakar N S.Carotenoids in crabs f rom marine and fresh waters of India[J].LWT-food science and technology,2005,38:221-225.
[6]Gladisn,Coralh,Bjoen.Astaxanthin from the red crab langostilla(Pleuroncodes planipes):op ticalrys isomers and fatty acid moieties of astaxanthin esters[J].Comparative Biochemistry and Physiology Part B,2002,133:437-444.
[7]姜启兴,夏文水.甲壳类下脚料中虾青素的提取的研究[J].食品科技,2003(4):85-88.
QIANG Qi-xing,XIA Wen-shui.Study on the astaxanthin extraction fron the waste of crustaceans[J].Food Technology,2003(4):85-88.(in Chinese)
[8]黄永春,李琳,郭祀远,等.木瓜蛋白酶对壳聚糖的降解特性[J].华南理工大学学报:自然科学版,2003,31(6):71-75.
HUANG Rong-chun,LI Lin,GUO Shi-yuan et al.degradation characteristics of chitosan by papain[J].Journal of South China University of Technology:Natural Science Edition,2003,31(6):71-75.(in Chinese)
[9]魏东,严小君.天然虾青素的超级抗氧化活性及其应用[J].中国海洋药物,2001(4):45-50.
WEI Dong,YAN Xiao-jun.The super antioxidant activity and its application of nature astaxanthin[J].China national offshore drug,2001(4):45-50.(in Chinese)
[10]施安辉,萧海杰.目前国内外虾青素研究的进展[J].生物工程进展,1999,19(1):29-31.
Si Anhui,Xiao Hai-jie.The progress of the study on astaxanthin at home and abroad currently[J].Biotechnology Progress,1999,19(1):29-31.(in Chinese)
[11]赵仪,陈兴才.木瓜蛋白酶在虾仁加工废弃物中提取虾青素的应用[J].福州大学学报:自然科学版,2006,34(3):453-457.
ZHAO Yi,CHEN Xing-cai.Papain in the application of astaxanthin extraction from the waste of the shrimp processing[J].Journal of Fu Zhou University:Natural Science Edition,2006,34(3):453-457.(in Chinese)
The Application of Papain in Astaxan thin Extraction from Crayfish Shell
QIAN Fei, LIU Hai-ying, GUO Shi-dong*
(School of Food Science and Technoloqy,Jiangnan University,Wuxi 214122,China)
The aim of this study is to develop a astaxanthin extraction process from hydrolyzing the Crayfish shell by papain.For this,the optimal hydrolyzed conditions was determined by the single factor test and the central point experimental design and the optimum conditions as fellow s:temperature 48.5,p H 5.8,E/S 2522U/g,hydrolyzed time 63 min,L/S 2:1.A higher carotenoids amount and density achieved at 115.761μg.g-1and 13.06%,respectively.The amount was higher 13.8%than that of the amount extracted by acid treatment The results presented here provided a new technology process for comprehensive utilization of shrimp waste.
astaxanthin,papain,central point for experimental design,crayfish shell
Q 814.9
A
1673-1689(2010)02-0237-07
2009-04-16
江苏省科技成果转化专项基金项目(BA 2007089)。
*
过世东(1953-),男,江苏无锡人,教授,博士生导师,主要从事水产品加工与饲料工程研究。Email:Qianyuan fei 1984@yahoo.com.cn
(责任编辑:杨萌)

