高磷对大鼠血管平滑肌细胞钙化及核心结合因子α1表达的影响
李峻岭,王 琳,李丽华,李胜范,曹平安
(大连大学附属新华医院 肾脏内科,辽宁 大连 116021)
进行性血管钙化是慢性肾功能衰竭(CRF)心血管事件发生率增高的重要原因。大量研究证实血管钙化是一种类似于骨和软骨形成的主动的调节过程,血管平滑肌细胞(VSMC)表达成骨细胞表型是血管钙化过程的中心环节[1]。研究表明,高磷可诱导培养的VSMC钙化,然而,磷如何影响血管钙化,目前机制尚不完全清楚。核结合因子αl(Core Binding Factor α1,Cbfα1)又称急性髓性白血病因子3(AML3)、Runx相关转录因子2(Runx2)和成骨细胞特异性因子2(OSF2)。Cbfα1控制成骨细胞分化的启动,早期促进成骨细胞的分化,晚期可抑制其分化。Cbfα1在体外可诱导人和小鼠间充质干细胞向成骨细胞分化[2]。本研究进行大鼠主动脉VSMC体外培养,观察高磷对钙化的影响,并探讨其与Cbfα1的关系。
1 材料和方法
1.1 试 剂
大鼠胸主动脉平滑肌细胞株购自中科院上海细胞所;高糖DMEM培养基、胰蛋白酶、青霉素、链霉素购自Gibco公司;胎牛血清购自奥地利PAA公司;钙测定试剂盒购自美国Sigma公司;BCA蛋白测定试剂盒购自北京索莱宝科技有限公司;核蛋白提取试剂盒和T ransAM AML3/ Runx2核转录因子活性检测试剂盒购自美国Active Mortif公司;骨钙素放射免疫试剂盒购自北京东亚免疫技术研究所。兔抗鼠平滑肌α肌动蛋白单克隆抗体购自Zymed公司,SP免疫组化试剂盒和DAB显色剂购自北京中山生物技术公司。
1.2 大鼠血管平滑肌细胞株的培养
将大鼠血管平滑肌细胞株置于25 mL培养瓶中,加入含15%胎牛血清的DMEM培养基5 mL,静置于37℃,CO2浓度为5%的孵箱培养。2 d换液1次,待细胞融合覆盖瓶底80%~90%后,以0.25%的胰蛋白酶消化传代。在载玻片上培养的细胞融合后,采用免疫组化α-SMA染色对血管平滑肌细胞株进行鉴定。
1.3 诱导钙化
传5代后的细胞经0.25%的胰蛋白酶消化后接种于六孔板中,待细胞贴壁后,换成磷浓度分别为1.4 mmol/L(正常磷浓度)和2.4 mmol/L(高磷浓度)的培养基。2种培养基的钙浓度均为2.0 mmol/L。培养3、6、9 d。换用不同培养基的第1天记为第0天。
1.4 钙沉积定量
各组细胞D-Hanks液洗涤细胞3次后,0.6 mmol/L盐酸脱钙1 d。盐酸悬液中钙含量用氨羧络合剂方法测定。脱钙后的细胞用D-Hanks液洗涤细胞3次后,0.1 mmol/L NaOH-0.1%SDS(十二烷基硫酸钠)溶解细胞,BCA法测定蛋白含量。用蛋白含量标化钙含量。
1.5 Von Kossa染色
第9天的培养细胞在戊二醛中固定后,加入5%硝酸银,避光、室温孵育30 min。三馏蒸涤细胞3次,紫外光下放置30 min,苏木素伊红复染,磷酸钙沉积染为黑色。
1.6 骨钙素测定
每个培养孔加入磷浓度分别为1.4 mmol/L或2.4 mmol/L的培养基,孵育3 d,吸出上清液,骨钙素的浓度用放射免疫法测定。
1.7 cbfa1活性的测定
每个培养孔加入磷浓度分别为1.4 mmol/L或2.4 mmol/L的培养基,分别于培养第3、6、9天收集细胞,用核蛋白提取试剂盒提出各组细胞的蛋白质,用BCA比色法测定蛋白质含量,吸取5 μg蛋白质提取物,用细胞裂解液稀释至20 μL,采用ELISA试剂盒测定cbfa1的活性。
1.8 统计学方法
每组指标均计算均数±标准差,组间比较采用t检验,所有检验分析均使用SPSS 10.0 软件,P<0.05为差异有统计学意义。
2 结 果
2.1 血管平滑肌细胞形态学和鉴定
5代后倒置显微镜下单个平滑肌细胞为梭状或带状(图1)。经免疫组化α-SMA染色后,细胞胞浆内a-SMA丰富表达,呈细丝状沿细胞纵轴排列。95%为阳性,纯度符合实验要求(图2)。
2.2 磷诱导牛血管平滑肌细胞钙化沉积

图1第5代VSMC,单个血管平滑肌细胞为梭状或带状(×40)
Fig 1 Photomicrograph of VSMC of the fifth generation. Single VSMC presented spindle-shaped or girdle-shaped (×40)
图2免疫组化α-SMA染色后,细胞胞浆内棕色阳性信号丰富表达,呈细丝状沿细胞纵轴排列(×400)
Fig 2 Photomicrograph of VSMC containing a-SMA-like immunoreactivity. Brown deposit was abundantly located in intracytoplasm. Brown deposit presenting filament-shaped was arrayed along longitudinal axis of VSMC (×400)
正常磷浓度组细胞钙含量在9 d内无明显变化。高磷浓度组第3、6、9天细胞钙含量与第0天相比,差异有显著性意义(P<0.01)。高磷浓度组在第3、6、9天细胞钙含量与同一时间正常磷浓度组比较,差异均有显著性意义(P<0.05),见表1。

表1 各组在不同时间血管平滑肌细胞的钙沉积(μg/mg蛋白)Tab 1 Calcium deposition in VSMC in different time in the two groups(μg/mg protein)
1)与第0天比较P<0.01;2)与同一时间正常磷浓度组比较P<0.05;3)与同一时间正常磷浓度组比较P<0.01
2.3 钙化血管平滑肌细胞的形态学特征
经Von Kossa染色,在高磷浓度组培养基中生长的细胞见大量的黑色颗粒状沉着,弥漫性分布于整个细胞,主要是细胞外区域(图3A)。在正常磷浓度组培养基中的细胞却几乎看不到这种沉积的存在(图3B)。
2.4 骨钙素的测定
第3天高磷浓度组上清液骨钙素含量为(14.62±2.93)pg/μg蛋白,而正常磷浓度上清液骨钙素含量为(2.83±0.64)pg/μg蛋白。两者比较,差异具有显著性意义(P<0.01)。
2.5 Cbfα1活性的检测
正常磷浓度组细胞Cbfα1活性在9 d内无明显变化。高磷浓度组在第6天和第9天细胞Cbfα1活性与第0天相比,差异有显著性意义(P<0.05)。高磷浓度组在第3天细胞Cbfα1活性与正常磷浓度组比较,差异无显著性;而高磷浓度组在第6天和第9天细胞Cbfα1活性与同一时间正常磷浓度组比较,差异有显著性意义(P<0.05),见表2。
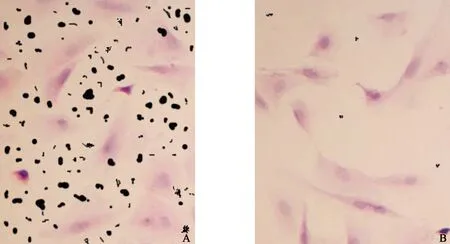
图3 钙化血管平滑肌细胞
A:Von Kossa染色,高磷浓度组培养基中生长的细胞见大量的黑色颗粒状沉着 (×200);B:Von Kossa染色, 正常磷浓度组培养基中的细胞却几乎看不这种沉积的存在 (×200)
Fig 3 Von Kossa stains. Copious black particle deposit was presented in medium containing high phosphate (the left Photomicrograph ×200). Seldom deposit was presented in medium containing normal phosphate(the right Photomicrograph ×200)

表2 各组在不同时间血管平滑肌细胞的Cbfα1活性(吸光度)Tab 2 Cbfα1 activity of VSMC in different time in the two groups(absorption factor)
1)与第0天比较P<0.05;2)与同一时间正常磷浓度组比较P<0.05
3 讨 论
心血管疾病是慢性肾脏病(CKD)患者致残和致死的主要原因,超过50%CKD 5期的患者死于心血管疾病,其风险比普通人群高出20~30倍。组织学和影像学的研究证明,在CKD的患者,血管钙化非常普遍,常从年轻时就开始,且比一般人群更加严重[3]。流行病学和临床资料发现血管钙化与粥样硬化斑块数量、心肌梗死和心脏骤停等心血管事件的发生都密切相关,目前被认为是强有力的心血管病死率和总病死率的预测因素[4]。
血管钙化过去一直被认为是一种被动的过程。新近认为,血管钙化是一种类似于骨和软骨形成的主动的调节过程,主要特征是血管壁的细胞,尤其是VSMC发生骨样变化的主动调节过程。许多实验均发现血管钙化与高血磷有关[5]。本研究通过细胞培养实验也证实高磷与平滑肌细胞钙化有密切关系。当用磷浓度(1.4 mmol/L) 培养基培养,细胞钙化不明显,而当磷浓度为2.4 mmol/L时,细胞明显钙化,且随着培养时间延长, 细胞钙化越来越显著。这提示高磷能促进血管平滑肌细胞钙化,并且这种作用具时间和剂量的依赖性。形态学观察磷浓度2.4 mmol/L培养时可见到细胞大量黑色颗粒状沉积(经Von Kossa 染色证实为磷酸盐矿物质),这与国内外一些细胞实验结果一致[6]。骨钙素又称骨 Gla 蛋白,含有 3个羧基谷氨酸基团,主要由骨细胞和成骨细胞合成及分泌, 被认为是成骨细胞最终分化的特异性指标,是反映机体骨代谢变化灵敏、可靠的指标[7],其在血管钙化期间分泌增加并与钙化程度呈正相关 。骨钙素的出现,表明表达成骨细胞表现型的细胞在血管钙化的发生过程中起中心作用。本实验中,与磷浓度1.4mmol/L培养基中的平滑肌细胞相比,磷浓度为2.4 mmol/L培养基中平滑肌细胞表达的骨钙素水平明显增高。
多项研究发现Cbfα1在钙化血管中膜和内膜均有表达而正常血管几乎无表达。Cbfα1在体外可诱导人和小鼠间充质干细胞向成骨细胞分化[8]。Cbfα1作为成骨细胞分化的特异性转录因子对成骨细胞的生长分化、软骨细胞的成熟发育及牙齿的分化发育有重要作用[9],其基因缺失突变可引起遗传性骨病。Cbfα1基因突变小鼠的胚胎中仅有微弱的碱性磷酸酶的表达,几乎不表达骨桥蛋白和骨钙蛋白,骨钙素有3个结合Cbfα1的启动区域。骨桥蛋白、骨钙蛋白和碱性磷酸酶在骨钙化后期都下调,证明Cbfα1的缺失导致成骨细胞成熟的中止发生于分化早期[10]。本实验中,在正常磷浓度时细胞Cbfα1活性无明显变化。而磷浓度2.4 mmol/L时细胞Cbfα1活性增强,且随时间延长逐渐增强。这表明随着钙化的加重,Cbfα1表达逐渐增强。
一项横断面研究经过多元回归分析显示,血磷水平升高是颈动脉内膜和中膜厚度增加的独立危险因素之一[11]。高血磷如何诱导血管钙化的机制目前还不完全清楚。可能机理有:①近期研究表明磷可调节细胞信号的传导和基因表达。高磷可刺激体外培养的VSMC表达碱性磷酸酶,诱导转录因子cbfal及骨钙素产生,且诱导骨桥素表达依赖于VSMC细胞膜Na/Pi共转运体和碱性磷酸酶的活性;上调Cbfα1,表达成骨细胞表型,即促进成骨相关性蛋白基因表达并抑制平滑肌细胞特异性基因表达,最终引起细胞钙化[12]。②细胞内磷水平升高后会引起部分细胞发生凋亡,这些凋亡小体是钙化结晶的基础。高磷和(或)高钙可明显诱导VSMC凋亡,使用凋亡抑制剂后,VSMC钙化减少20%[13]。③细胞内高磷刺激潜在的矿化物质如基质小泡、碱性磷酸酶、钙结合蛋白和含胶原的细胞外基质的分泌[13]。
高磷能诱导血管平滑肌细胞发生钙化,这种钙化与磷浓度、磷作用时间有关。高磷培养基还可诱导血管平滑肌细胞表达cbfα1,这说明cbfα1参与并调控血管钙化,但其具体作用仍有待更深入的实验进一步证实。
[1] Chwn NX,Moe SM.Vascular calcification in chronic kidney disease[J].Sem Nephrol,2004,24:61-68.
[2] Lien CY,Lee OK,Su Y.Cbfb enhances the osteogenic differentiation of both human and mouse mesenchymal stem cells induced by Cbfα-1 via reducing its ubiquitination-mediated degradation[J].Stem Cells,2007,25:1462-1468.
[3] Block G,Port FK.Calcium phosphate metabolism and cardiovascular disease in patients with chronic kidney disease[J].Semin Dial,2003,16:140-147.
[4] 付平,唐万欣.慢性肾脏病患者血管钙化的诊治进展[J].中国血液净化,2008,7:233-235.
[5] Giachelli CM. The emerging role of phosphate in vascular calcification[J].Kidney Int,2009,75:890-897.
[6] 王英,王梅. 高钙、高磷对体外培养的大鼠血管平滑肌细胞钙化的作用[J].中国血液净化,2008,7:85-89.
[7] Davies MR,Hruska KA.Pathophysiological mechanisms of vascular calcification in end-stage renal disease[J].Kidney Int,2001,60:472-479.
[8] Lien CY,Lee OK,Su Y.Cbfb enhances the osteogenic differentiation of both human and mouse mesenehymal stem cells induced by Cbfa 1 via reducing its ubiquitination-mediated degradation[J].Stem Cells,2007,25:1462-1468.
[9] Kojima H,Uemura T.Strong and rapid induction of osteoblast differentiation by cbfa1/til-1 overexpression for bone regeneration[J].J Bio Chem,2005,280:2944-2953.
[10] 白宇,张柳,吕志伟.辛伐他汀在人骨髓基质干细胞向成骨细胞分化过程中的作用[J].中国骨质疏松杂志,2007,13:381-384.
[11] Ishimura E,Taniwaki H,TabataT.elal.Cross-sectional association of serum phosphate with carotid intima-medial thickness in hemodialysis patients[J].Am J Kidney Dis,2005,45:859-865.
[12] 张颖娟,郑法雷.慢性肾脏病血管钙化机制研究进展—抑制与促进血管钙化两类因子的重要作用[J].国际泌尿系统杂志,2008,28:505-509.
[13] Reynolds JL,Joannides AJ,Skepper JN,et al.Human vascular smooth muscle cells undergo vesicle-mediated calcification in response to changes in extracellular calcium and Phosphate Concentrations:a potential mechanism for accelerated vascular calcification in ESRD[J].J Am Soc Nephrol,2004,15:2857-2867.

