川芎嗪逆转人乳腺癌细胞耐药株多药耐药性的实验研究
苗迎秋,郑丛龙
(大连大学 医学院,辽宁 大连 116622)
现临床许多抗肿瘤药物如阿霉素、长春新碱、紫衫醇等能通过启动凋亡机制杀伤肿瘤细胞。其作用过程:药物抵达肿瘤细胞→与靶点结合→细胞功能改变或细胞内损伤→感受器损伤→信号传导→凋亡机制启动→细胞死亡[1]。 随着细胞凋亡研究的逐步深入,许多学者认识到对肿瘤细胞凋亡的抑制,可导致肿瘤对多种化疗药物产生耐药性,即多药耐药(MDR)[2]。MDR的发生是制约临床治疗效果的主要因素。寻找有逆转作用而毒副作用小的化疗增敏剂,对提高肿瘤治疗水平具有重要意义。目前,临床上应用的多药耐药逆转剂如钙离子通道抑制剂(如盐酸维拉帕米等)和环孢霉A及其衍生物,由于毒副作用限制其应用。为了寻找高效、 低毒、作用靶点广泛的肿瘤耐药逆转剂,许多学者把目光转向了天然药物。中药资源丰富,作用靶点多,可针对多药耐药机制复杂的特点。中药川芎嗪(tetramethylpyrazine,TMP)为中药川芎的有效成分之一,具有钙通道阻滞活性,临床主要用于治疗心脑血管疾病等。近年来发现它可部分纠正阿霉素对小鼠腹水癌的抗药性[3],以及逆转有多药耐药表型的MCF-7/adr细胞对多柔比星的耐药性[4],所以本研究通过细胞凋亡现象来观察川芎嗪对细胞多药耐药的逆转作用。
1 材料和方法
1.1 材 料
1.1.1 人乳腺癌细胞系MCF-7/S:由吉林省肿瘤研究所提供;人乳腺癌耐药细胞系MCF-7/adr: 本实验室诱导建立。
1.1.2 主要试剂:RPMI 1640培养液和胎牛血清Gibco/BRL公司生产;四甲基偶氮唑蓝(MTT)为美国Sigma产品;酚:氯仿:异戊醇(25∶24∶1,v/v)混合液、Hoechst/PI(碘化丙啶)、RNaseA、cell lysis buffer(10 mmol/L Tris-HCl buffer:pH 8.0,10 mmol/L EDTA,0.5% Triton X-100)TAE buffer为Solarbio产品。
1.1.3 药 品:阿霉素(ADR 浙江海正药业);足叶乙甙(VP-16 贵州汉方制药);长春新碱(VCR 广州白云山明兴制药);紫衫醇(PTX 贵州汉方制药);长春花碱(VBL 日本和光药业);逆转剂盐酸维拉帕米(Ver 新华医院肿瘤科提供);川芎嗪(TMP 上海第一生化药业)。
1.2 方 法
1.2.1 耐药细胞株MCF-7/adr的建立:取对数生长期MCF-7/S细胞 2×106个接种到10 mL RPMI 1640完全培养基的平皿中,置5 %CO2、相对湿度90 %、温度37℃的培养箱中。24 h后待细胞呈单层贴壁生长,先以终浓度为160 ng/mL的ADR培养液冲击细胞,72 h后弃含药培养液,PBS洗3遍,换新鲜RPMI 1640完全培养液,换液1次/2 d洗去死亡细胞,待形成细胞克隆时传代,恢复稳定生长后再次冲击,3次后再提高ADR浓度如此反复间歇作用直至细胞可在浓度为80 ng/mL的ADR培养液中维持培养。再用20 μg/mL ADR作用2 h后,消化传代24 h后细胞恢复健康,于含80 ng/mL的ADR培养液中继续培养,反复冲击用药。通过细胞形态学观察、生长曲线测定,MTT法测定细胞对ADR等5种抗癌剂的敏感性、耐药性等常规测定MCF-7/adr符合MDR细胞株。
1.2.2 MTT法测定药物对细胞的无毒浓度和TMP、Ver对MCF-7/adr耐药性的逆转作用:MCF-7/adr细胞株脱离ADR 2周后,取生长对数期MCF-7/S和MCF-7/adr细胞4×104个/mL 100 μL分别接种到96孔培养板中,置5 %CO2,相对湿度90 %,温度37℃的培养箱中,24 h后待细胞呈单层贴壁生长后,加各药物相应浓度100 μL,和逆转剂作用时加抗癌剂相应浓度50 μL,TMP或Ver 50 μL。培养72 h后,每孔加25 μL MTT(5 mg/mL),继续培养4 h后,弃去孔内原有液体,每孔加200 μL二甲基亚砜(DMSO),振荡至结晶完全溶解后,酶标仪上以570 nm波长测吸光光度值(A)。相对抑制率(%)=(1-加药孔A值/对照孔A值)×100%,IC50计算器软件计算50 %细胞生长抑制时的药物浓度(IC50),耐药指数(RI)=耐药细胞IC50/亲本细胞IC50,逆转倍数=耐药细胞逆转前IC50/耐药细胞逆转后IC50。
1.2.3 倒置显微镜和荧光显微镜观察TMP逆转前、后细胞形态的变化:取生长对数期MCF-7/adr细胞制成2×106个/mL细胞悬液,1 mL/孔的比例接种到6孔培养板中,置5 %CO2,相对湿度90 %,温度37℃的培养箱中,24 h培养生长后,各药物溶液加1 μL,空白孔加DMSO 1 μL,继续培养48 h后倒置显微镜下进行观察。加入20 μL 的1 mM Hochest 33342和1 mg/mL PI混合物(1∶1,v/v),5% CO2,37 ℃的培养箱中培养10 min,荧光显微镜下进行观察,活细胞被荧光色素处理后呈现蓝色,死亡细胞和凋亡细胞的凋亡小体呈现红色。
1.2.4 凋亡细胞DNA片段检测:取生长对数期MCF-7/adr细胞制成1×106个/mL细胞悬液,直径9 cm的平皿中,置5 %CO2,相对湿度90%,温度37℃的培养箱中,24 h培养生长后,各种药物溶液加10 μL,空白孔只加DMSO 10 μL。5% CO2,37℃的培养箱中培养48 h后,用细胞刮刀回收各样本细胞,离心(3000 r /min, 5 min,4℃)去除上清,用低温的PBS洗两次。加入细胞溶解液500 μL,4 ℃,静置45 min后,离心(13000 r /min, 45 min,4 ℃)取上清移至1.5 mL离心管中,加入500 μL酚:氯仿:异戊醇(25∶24∶1,v/v)混合液,反复颠倒混匀90 min,常温离心13000 r /min, 15 min,取上层移至1.5 mL离心管中,重复上述操作。取上层于1.5 mL离心管中,加入氯仿500 μL反复颠倒混匀30 min,13000 r /min, 常温离心15 min,取上层500 μL于1.5 mL离心管中,加入50 μL 5 mol/L氯化钠、1 mL乙醇,-20℃放置,取出离心(13000 r /min,45 min,4 ℃),去除上清,用70 %乙醇500 μL洗净,离心室温风干。用TAE buffer溶解,加RNase A最终浓度400 μg/mL,37℃作用2 h,定量,加样缓冲液调整1 μg/孔,1.8 %琼脂糖凝胶电泳25 min,1 mg/mL溴化乙锭染色30 min,脱色30 min,用Dolphin view检测。
1.3 统计学方法
应用 SPSS 11.5 统计软件, 采用t检验,P<0.05为差异有显著性意义。
2 结 果
2.1 MCF-7/adr细胞株的耐药性检测
2.1.1 阿霉素诱导的MCF-7/adr细胞形态变化:倒置显微镜下MCF-7/S和MCF-7/adr细胞均呈上皮样单层排列,细胞大小不一,为多角形;MCF-7/S边界清楚,多伪足;MCF-7/adr细胞边界不清,核大,细胞体积增大,由原来体积相对较小的细长的梭形变为体积膨胀的不规则形状,核分裂像增多,见图1。MCF-7/adr的生长周期(Td):(49.56±1.27)h 与MCF-7/S的Td:(41.23±2.61)h 比较,差异有显著性意义,P<0.01。

图1 ADR诱导后的MCF-7/S与MCF-7/adr在外观形态的区别Fig 1 The comparison of cell shape of MCF-7/S cell and MCF-7/adr cell after treated with ADR
2.1.2 不同抗癌剂对细胞株的IC50及耐药指数测得的结果:运用MTT方法测得各抗癌剂对ADR诱导的MCF-7/adr细胞株的IC50明显增加,结果见表1。对ADR、VP-16、VCR 、PTX 和VBL的RI分别为145.7、41.7、72.2、488.4 和286.8,显示出明显的多药耐药表型。

表1 不同抗癌剂对细胞的IC50和RI的测定结果Tab1 IC50 and RI of cell treated with various anticancer drugs
1)MCF-7/S对抗癌药的IC50;2)MCF-7/adr 对抗癌药的IC50(P<0.01,MCF-7/S vs MCF-7/adr)
2.1.3 TMP和Ver逆转后不同抗癌剂对耐药细胞株的IC50结果:运用MTT方法测得TMP细胞最大无毒浓度为320 μg/mL,确定Ver逆转浓度为5 μg/mL。结果显示,TMP逆转后各抗癌剂对MCF-7/adr细胞株的IC50明显降低,逆转效果虽不及Ver,但也具有明显的统计学意义(表2)。
2.2 倒置显微镜观察TMP逆转前、后MCF-7/adr细胞形态的变化
取浓度分别为3、20、10、8和5 μg/mL的ADR、VP-16、VCR、PTX 和VBL作用细胞48 h后,镜下观察细胞形态良好,TMP逆转后,可见变圆、脱落的细胞增多(图2)。
2.3 荧光显微镜观察TMP逆转后细胞形态
经Hochest 33342和 PI染色后,荧光显微镜下可见TMP逆转后抗癌剂诱导的细胞核浓缩和凋亡小体(图3箭头处)典型细胞凋亡的现象。
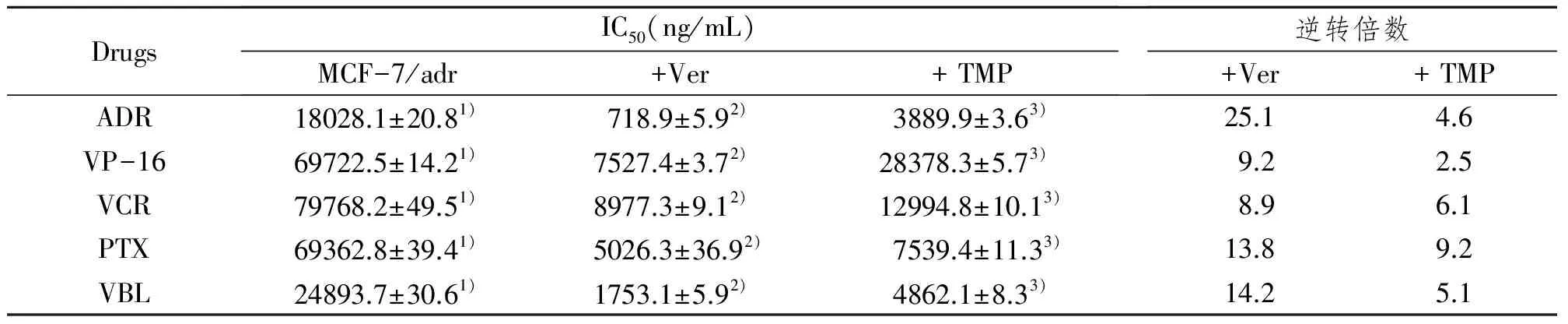
表2 Ver和TMP逆转后不同抗癌剂对MCF-7/adr细胞的IC50和逆转倍数Tab 2 IC50 and reverse multiple of MCF-7/adr cell line of anticancer drugs after treated with Ver and TMP
1) 加逆转剂前抗癌剂对MCF-7/adr的IC50;2)加Ver后抗癌剂对MCF-7/adr的IC50;3)加TMP后抗癌剂对MCF-7/adr的IC50(P<0.01,TMP逆转前 vs TMP逆转后)

图2 倒置显微镜观察TMP逆转前、后MCF-7/adr细胞的形态 A:ADR;B:ADR+TMP;C:VP-16 ;D:VP-16+TMP;E:VCR;F:VCR+TMP;G:PTX;H:PTX+TMP ;I:VBL;J:VBL+TMPFig 2 The cell shape of MCF-7/adr cell line treated with TMP or not under inverted microscope and fluorescence microscope

图3 荧光显微镜观察TMP逆转后MCF-7/adr细胞的形态A:TMP;B:ADR+TMP;C:VP-16+TMP;D:VCR+TMP;E:PTX+TMP;F:VBL+TMPFig 3 The cell shape of MCF-7/adr cell line treated with TMP or not under fluorescence microscope
2.4 琼脂糖凝胶电泳检测TMP逆转前、后细胞凋亡DNA片段结果
取浓度分别为3、10、8和5 μg/mL的ADR、VCR、PTX 和VBL作用细胞48 h后,琼脂糖凝胶电泳检测结果显示无DNA片段,TMP逆转后,结果显示检测出DNA片段,见图4。
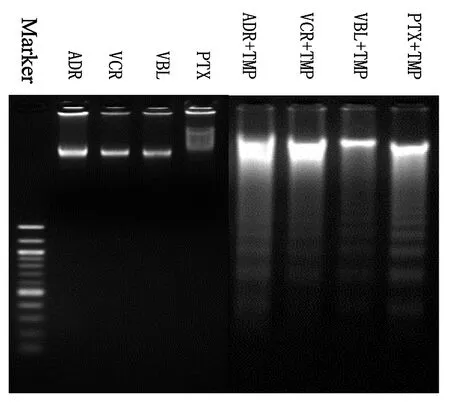
图4琼脂糖凝胶电泳检测TMP逆转前、后抗癌剂诱导MCF-7/adr细胞凋亡的DNA片段
Fig 4 The change of DNA fragment of MCF-7/adr apoptosis cell line induced by anticancer drugs treated with TMP or not
3 讨 论
本研究结果显示,利用ADR诱导的MCF-7/adr细胞显示出很好的多药耐药表型;TMP有效地逆转了MCF-7/adr细胞对ADR、VP-16、VCR、PTX 和VBL的耐药性,其逆转倍数虽不及Ver,但与逆转前相比差异有显著性意义,P<0.01;通过凋亡小体荧光染色观察和DNA片段测定,结果显示TMP有效逆转了MCF-7/adr细胞对非细胞毒性剂量的抗癌药物引起的凋亡诱导。
肿瘤细胞对多种抗癌药物产生抗药性,即多药耐药,阻碍了肿瘤生物治疗的进展,是肿瘤化疗失败的重要原因。探究多药耐药肿瘤治疗的新策略,是目前肿瘤防治研究的热点。多药耐药基因及其产物P-gp糖蛋白过度表达,在一定程度上限制了人类肿瘤化疗的成功。P-gp 可将结构和功能不同的化合物,如抗癌药物(长春新碱、阿霉素)、细胞毒药物(秋水仙碱、嘌呤霉素)、免疫抑制剂(环孢素 A、 FK506)等泵出细胞外[5]。许多抗肿瘤药物是通过诱导凋亡杀伤细胞来抑制肿瘤生长的。而对P-gp的另一重要发现是其具有凋亡抑制作用。该发现为肿瘤耐药与细胞凋亡耐受之间在分子水平上建立了有机的联系[6]。目前研究认为,细胞凋亡抑制亦可能是肿瘤耐药的主要机制之一[7]。近年来的研究表明,P-gp 可能直接或间接地参与细胞的分子代谢、增殖、分化等方面的调控,揭示P-gp具有潜在的多重生理功能,尤其是它可抵抗死亡受体配体 FasL、肿瘤坏死因子(TNF)、射线等诱导的caspase 依赖性凋亡,而颗粒酶B、孔形成蛋白、六甲撑双乙酰胺(HMBA)等诱导的caspase 非依赖性凋亡不受P-gp的影响,提示P-gp在细胞凋亡中可能发挥重要的调控作用[8]。
非细胞毒性剂量的川芎嗪能通过下调P-gp的表达而逆转MDR[4,5], 其可能的机制有: ①钙通道阻滞剂与抗肿瘤药物竞争P-gp的结合位点,从而抑制其跨膜泵作用,使抗肿瘤药物的细胞外排降低,提高细胞内瘤药物浓度而逆转耐药[9];②有研究推测 TMP 在竞争P-gp药物结合位点的同时,还可能通过直接抑制P-gp的活性而影响P-gp功能[10];③TMP不仅可阻断外钙内流,而且也可直接作用于钙库,阻断内钙释放,通过以上两条途径,降低细胞中钙浓度[11]。胞内钙浓度降低可以抑制钙依赖型蛋白激酶C(PKC)的活化。同时也有研究发现TMP在人外周血淋巴细胞中抑制PKC的活化[12]。有研究提示PKC 可以促进P-gp磷酸化,增强其跨膜转运功能,维持细胞MDR表型,而抑制PKC活性则可以降低P-gp磷酸化水平,逆转肿瘤 MDR[13,14],可以据此推测 TMP 还可能通过PKC而抑制P-gp的活性和跨膜转运功能。尽管TMP逆转多药耐药的具体机制尚不明了,但深入研究P-gp与凋亡现象之间的内在联系,是揭示P-gp本质、 研究开发抗MDR 新药、探索克服MDR 新途径的基础。同时,TMP还具有价格低廉、 毒副作用小等优点,在临床有良好的应用前景,有待进一步研究开发。
[1] 朱兴虎,李建勇,夏学鸣.白血病细胞耐药与细胞凋亡的研究进展[J].国外医学·生理、病理科学与临床分册,2002,22(4):4012-4031.
[2] 刘玲,何玲,刘国卿.P糖蛋白与细胞凋亡及肿瘤多药耐药的关系[J].药学进展,2005,29(3):102-104.
[3] 胡艳平,刘健,王庆端,等. 川芎嗪和维拉帕米纠正阿霉素对小鼠艾氏腹水癌的抗药性[J].药学学报,1993,28(1):75-78.
[4] 解霞,郝立宏,高清波,等.川芎嗪逆转肿瘤多药耐药性及其机制的研究[J].中华肿瘤防治杂志,2006,13(18):1368-1370.
[5] Marzolini C, Paus E, Buclin T, et al.Polymorphisms in human MDR1 ( P -glycoprotein): recent advances and clinicalrelevance[J].Clin Pharmacol Ther, 2004,75(1):13-33.
[6] 刘玲,何玲,刘国卿.P糖蛋白与细胞凋亡及肿瘤多药耐药的关系[J].药学进展,2005, 29(3):101-105.
[7] Yang E,Korsmeyer J S.Molecular thanatopsis:a discourse on the bcl22 family and cell death[J].Blood,1996,88:386-401.
[8] Johnstone R W, Ruefli A A, Smyth M J.Multiple physiological functions for multidrug transporter P-glycoprotein[J].Trends Biochem Sci, 2000,25(1):1-6.
[9] Lee CH.Reversing agents for ATP-binding cassette (ABC)transporters: application in modulating multidrug resistance(MDR)[J].Curr Med Chem Anti-Canc A gents,2004,4(1):43-52.
[10] 宋娟,唐靖,何娟,等.川芎嗪对 Caco-2 细胞 P-糖蛋白功能和表达的影响[J].中南药学,2007,5(5):440-443.
[11] 徐浩.川芎嗪心血管药理与钙拮抗作用[J].中国中西医结合杂志,2003,23(5):376-377.
[12] 刘先胜,徐永健, 张珍祥,等.川芎嗪对人外周血淋巴细胞蛋白激酶 C通道的影响[J].中国病理生理杂志,2003,19(4):507-510.
[13] Hanauske AR,Sundell K,Lahn M. The role of protein kinase C-alpha (PKC-alpha) in cancer and its modulation by thenovel PKC-alpha-specific inhibitor aprinocarsen [J].Curr Pharm Des,2004,10(16):1923-1936.
[14] Zhan M,Yu D,Liu J,et al.Transcriptional repression of protein kinase Calpha via Sp1 by wild type p53 is involved in inhibition of multidrug resistance1 P-glycoprotein phosphorylation[J].J Biol Chem,2005,280 (6):4825-4833.

