PEP-1-SOD1预处理对脑梗死后小鼠海马神经元的保护*
董 敏,席刚明,张正洪
(郧阳医学院附属人民医院神经内科,湖北十堰 442000)
PEP-1-SOD1预处理对脑梗死后小鼠海马神经元的保护*
董 敏#,席刚明△,张正洪
(郧阳医学院附属人民医院神经内科,湖北十堰 442000)
目的研究PEP-1-铜,锌超氧化物歧化酶(PEP-1-SOD1)预处理对脑梗死后小鼠海马神经元的保护作用。方法健康雄性成年昆明小鼠随机分为假手术组、模型组以及PEP-1-SOD1预处理组。线栓法制作永久性大脑中动脉闭塞(PMCAO)模型。假手术组以及模型组在手术前30 min腹腔注射生理盐水200 μ L,PEP-1-SOD1预处理组手术前30 min注射PEP-1-SOD1 200 μ g。手术后24 h分离梗死侧海马组织,TUNEL染色测定细胞凋亡,黄嘌呤氧化酶法测定SOD1活性,TBA法测定丙二醛(MDA)含量。结果手术后24 h与模型组相比,PEP-1-SOD1预处理组凋亡细胞数量明显减少(P<0.01),SOD1活性升高,MDA含量下降(P<0.05)。结论PEP-1-SOD1预处理可以有效减轻小鼠脑梗死后海马神经元损伤。
PEP-1-SOD1;脑梗死;保护作用
铜,锌超氧化物歧化酶(SOD1)是体内重要的氧自由基清除剂,广泛参与中枢神经系统炎症、缺血等一系列病理过程,对神经元具有保护作用[1]。病理状态下,内源性SOD1无法清除短时间内大量产生的氧自由基;而外源性SOD1分子量过大,不能自由通过血脑屏障,应用受到限制。PEP-1-铜,锌超氧化物歧化酶(PEP-1-Cu,Zn-superoxide dismutase,PEP-1-SOD1)是一种利用基因工程技术合成的融合蛋白,与单纯SOD1相比,其穿透生物膜或者血脑屏障的能力得到很大程度的提高[2-3],为利用SOD1治疗与氧自由基产生过多的疾病提供了新的途径。脑组织血液循环中断后,大量自由基产生,细胞出现结构破坏、功能障碍。因此,清除自由基是脑梗死的有效治疗靶点之一。作者前期的研究已经证实PEP-1-SOD1可以成功转导入永久性大脑中动脉闭塞后的小鼠海马组织[4],但其对脑梗死是否具有保护作用,目前没有报道。本实验制作小鼠永久性大脑中动脉闭塞模型,探索PEP-1-SOD1预处理是否可以减轻海马神经元缺血损伤,为利用PEP-1-SOD1治疗脑梗死等与氧化应激相关的中枢神经系统疾病提供依据。
1 材料与方法
1.1 试剂与仪器 SOD1活性测定试剂盒,MDA检测试剂盒(建成生物工程研究所,南京);一步法TUNEL细胞凋亡检测试剂盒(Beyotime Biotechnology公司,江苏);4,6-二氨基-2-苯基吲哚(4,6-Diamidino-2-phenylinole,DAPI)(Sigma化学公司,美国);PEP-1-SOD1蛋白(郧阳医学院附属人民医院临床研究所,十堰),紫外分光光度计(CE 2041,北京),恒冷箱冰冻切片机(Leica CM1900,德国),倒置荧光显微镜(Nikon,日本)。
1.2 实验动物与分组 健康雄性成年昆明小鼠,由郧阳医学院实验动物中心提供,体质量 35~40 g,自然光线下饲养 1周以适应环境。动物自由食水,维持室温25℃,相对湿度60%。小鼠随机分为假手术组、模型组及PEP-1-SOD1预处理组。假手术组及模型组在手术前30 min腹腔注射生理盐水200 μ L,PEP-1-SOD1预处理组手术前30 min注射 PEP-1-SOD1 200 μ g。
1.3 小鼠永久性大脑中动脉闭塞(permanent middle cerebral artery occlusion,PMCAO)模型的制作 小鼠称重后腹腔注射10%水合氯醛(300 mg/kg),颈部正中切口,暴露右侧颈总、颈内、颈外动脉,枕动脉以及翼腭动脉,分离并结扎颈外动脉起始部及颈总动脉近心端,颈总动脉分叉套线备用;在距离分叉处约2 mm左右剪一小口,插入标记好的,用硅胶处理过的头端光滑,直径约0.104 mm的线栓,深度约(10.88±0.61)mm,稍有阻力即止。结扎套线,剪除多余线栓,缝合切口并再次消毒[5]。假手术组除不插线外,余操作同上。动物清醒后按8级行为评分法进行神经功能缺损评分[6]:0级为无神经缺失症状;1级为左前爪不能完全伸展;2级为轻微向后牵拉鼠尾并将后肢提起,左前爪抓力明显减低;3级为运动自如,但牵拉鼠尾时会向左侧倾斜或转圈;4级为向左侧倾斜或划圈运动;5级为刺激后运动;6级为刺激无运动,伴有意识障碍;7级为死亡;以上0~7级分别为 0~7分。本研究选取 1~6分者作为成功模型继续下一步实验,并经T TC染色证实右侧大脑中动脉供血区脑组织有明确的梗死灶。
1.4 T UNEL染色 手术后24 h,每组各取造模成功的小鼠5只,麻醉后迅速开胸,升主动脉置管,预冷0.1 M PBS灌流至肝脏发白,4%多聚甲醛继续灌注约150 mL,再以同样试剂后固定4 h,流水漂洗过夜,梯度蔗糖(5%、10%、15%、20%、25%以及30%)脱水,用冰冻切片机作连续脑冠状切片(片厚6 μ m)。用含0.1%Triton的0.01 M PBS洗涤10 min×2次,按一步法TUNEL试剂盒说明配置检测液,37℃避光孵育60 min,于最后15 min加入DAPI染色。0.01 M PBS漂洗 10 min×3次,甘油封片后用倒置荧光显微镜照相。每组5张切片,每张切片随机取右侧海马区5个互不重叠的视野,图片输入计算机,Image Pro Plus软件计算特异性染色阳性细胞百分比。
1.5 SOD1活性以及丙二酫(malondialdehyde peroxidase,MDA)含量检测 手术后24 h,每组各取造模成功的小鼠5只,深度麻醉后断头取脑,冰盘中分离海马组织,预冷0.1 M PBS漂洗,称重后按1∶9质量容积比加入 0.1 M PBS,制成10%匀浆,以牛血清清蛋白(1 mg/mL)作为对照,采用Bradford法测定蛋白含量,依据试剂盒说明用黄嘌呤氧化酶法测定SOD1活性,TBA法测定MDA含量。
2 结 果
2.1 细胞凋亡 荧光显微镜下观察DAPI标记细胞核为蓝色,凋亡细胞发出特异性绿色荧光,二者重叠后为青色。假手术组凋亡细胞较少,约为(1.50±0.35)%,模型组凋亡细胞明显增多,达(49.98±5.08)%,给予PEP-1-SOD1预处理后凋亡细胞的数量明显减少,约为(32.72±4.01)%,与模型组相比差异有统计学意义(P<0.01),见彩插Ⅰ图 1。
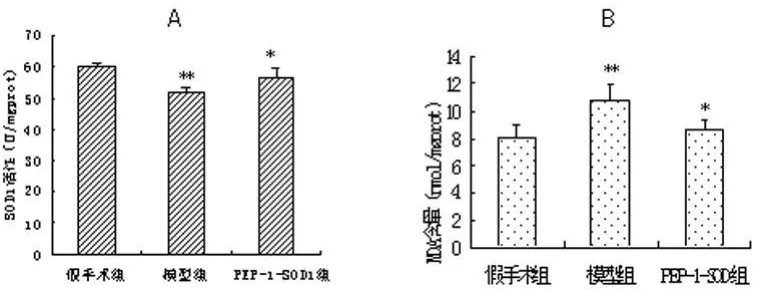
图2 SOD1活性及MDA含量
2.2 SOD1活性以及MDA含量 手术后24 h,假手术组海马组织SOD1活性为(60.06±3.26)U/mgprot,模型组为(50.02±1.40)U/mgprot,与假手术组相比明显下降,差异具有统计学意义(P<0.01);PEP-1-SOD1预处理后SOD1活性为(55.99±3.59)U/mgprot,高于模型组,二者相比差异具有统计学意义(P<0.05)。手术后24 h,假手术组MDA含量为(8.06±0.94)nmol/mgprot,模型组为(10.83±1.79)nmol/mgprot,与假手术组相比明显升高(P<0.01);PEP-1-SOD1预处理组MDA含量为(8.32±0.98)nmol/mgprot,与假手术组相比差异无统计学意义,但与模型组相比明显下降,差异具有统计学意义(P<0.05),见图 2。
3 讨 论
作为有机体重要的氧自由基清除剂,多年来人们一直在探索利用外源性SOD1治疗与氧化应激有关的疾病。但其属于大分子物质,在体内没有相应的受体和通道,也不能通过内吞作用等入胞方式进入细胞内,因此应用受到限制[7]。通过与细胞穿透肽——PEP-1进行融合,外源性SOD1的转导能力得到提高[8]。作者前期的研究已经证实PEP-1-SOD1可以成功进入小鼠海马组织并表现出一定的时间依赖性,转导后酶的活性可维持24 h以上[4],为进一步观察PEP-1-SOD1对海马神经元的保护作用提供了实验基础。
脑组织血液循环中断后大量氧自由基产生,细胞结构破坏,功能受损,海马组织对缺血尤为敏感[9]。大量研究已经证实清除氧自由基是减轻缺血损伤的有效途径之一[10-11]。为探索PEP-1-SOD1对海马神经元的保护作用,本研究用线栓法建立小鼠永久性大脑中动脉闭塞模型,并在手术前30 min腹腔注射200 μ g PEP-1-SOD1。研究结果显示模型组海马组织在脑梗死后24 h出现大量凋亡神经元,而PEP-1-SOD1组凋亡神经元则明显减少。EUM等[12]的研究显示短暂性脑缺血手术前或手术后腹腔注射PEP-1-SOD1可有效提高海马区神经元存活率,与本研究结果相似。
为进一步研究PEP-1-SOD1保护神经元的途径,本文对SOD1活性以及MDA含量也进行了检测。研究结果显示与模型组相比,PEP-1-SOD1预处理可使SOD1活性维持于较高水平,从而提高其清除氧自由基的能力[13]。MDA是脂质代谢的最终产物,通过测定其水平可以反映机体脂质过氧化程度。PEP-1-SOD1预处理可以减轻脂质过氧化,降低MDA含量,从另一方面反映了其对神经元的保护效应。
总的来说,本研究证实PEP-1-SOD1可以有效减轻脑梗死后海马神经元损伤,为利用其治疗与氧自由基产生过多有关的中枢神经系统疾病提供了实验依据。值得注意的是这一保护效应是在单次腹腔注药的情况下取得的,其长期用药效果如何,有待进一步研究。
[1]Hwang IK,Eum WS,Yoo KY,et al.Copper chaperone for Cu,Zn-SOD supplement potentiates the Cu,Zn-SOD function of neuroprotective effects against ischemic neuronal damage in the gerbil hippocampus[J].Free Radic Biol Med,2005,39(3):392.
[2]丁鹏,王家宁,黄永章,等.PEP-1肽介导Cu,Zn-SOD转导入人脐静脉内皮细胞[J].第四军医大学学报,2006,26(9):855.
[3]Cho JH,Hwang IK,Yoo KY,et al.Effective delivery of PEP-1-cargo protein into ischemic neurons and long-term neuroprotection of PEP-1-SOD1 against ischemic injury in the gerbil hippocampus[J].Neurochem Int,2008,52(4):659.
[4]董敏,席刚明,张正洪,等.PEP-1-SOD1融合蛋白转导入小鼠海马组织的能力及时间关系[J].第四军医大学学报,2009,30(13):1184.
[5]Xi GM,Wang HQ,He GH,et al.Evaluation of murine models of permanent focal cerebral ischemia[J].Chinese Medical Journal,2004,117(3):389.
[6]Mackay KB,Bailey SJ,King PD,et al.Neuroprotective effect of recombinant neutrophil inhibitory factor in transient focal cerebral ischaemia in the rat[J].Neurodegeneration,1996,5(4):319.
[7]Arslantas A.Development of functional models for a SOD[J].Met Based Drugs,2002,9(1):9.
[8]柯尊平,王家宁,郭凌郧,等.PEP-1肽介导Cu,Zn-SOD转导入大鼠离体缺血/再灌注损伤心脏[J].武汉大学学报(医学版),2007,28(4):450.
[9]吴江.神经病学[M].北京:人民卫生出版社,2005:150.
[10]严丽荣,周宏图,陈爱娟,等.老年脑梗死患者高压氧治疗前后血清一氧化氮、过氧化物歧化酶、丙二醛含量的变化[J].重庆医学,2004,33(3):330.
[11]劳之勇,曾琦,邢柏.依达拉奉联合纤溶酶治疗急性脑梗死的临床效果和分析[J].山东医药,2009,49(24):78.
[12]Eum WS,Kim DW,Hwang IK,et al.In vivo protein transduction:biologically active intact pep-1-superoxide dismutase fusion protein efficiently protects against ischemic insult[J].Free Radic Biol Med,2004,37(10):1656.
[13]蔡志友,余昌胤,张骏,等.美满霉素对脑缺血再灌注大鼠血清SOD和M DA的影响[J].重庆医学,2007,36(17):1746.
Neuropretection of PEP-1-S OD1 fusion protein against cerebral infarction in murine hippocampal region*
DONG Min#,XI Gang-ming△,ZHANGZheng-hong
(Department of Neurology,The Af f iliated Renmin Hospital of Yunyang Medical College,Shiyan,Hubei 442000,China)
ObjectiveTo explore the neuropretection of PEP-1-SOD1 against the cerebral infarction in murine hippocampal region.MethodsThe mice were assigned randomly into sham-operated group,model group and PEP-1-SOD1 pre-treatment group,the model of permanent middle cerebral artery occlusion(PM CAO)was set up.The mice were intraperitoneally injected 200 μ L saline in sham-operated group and model group or 200μ g PEP-1-SOD1 in PEP-1-SOD1 pre-treatment group 30 min before operation,respectively.After 24 h of surgery,the animals were sacrificed and the hippocampal tissues were dissected for TUNEL stained,SOD1 activity and MDA amount.ResultsAfter 24 h of surgery,compared with model group,the apoptotic cells in PEP-1-SOD1 pre-treatment group were ameliorated(P<0.01),the activity of SOD1 was increased and the amount of MDA was decreased(P<0.05).ConclusionPretreatment with PEP-1-SOD1 fusion protein can attenuate the neurons damage resulted from the cerebral infarction.
PEP-1-SOD1;cerebral infarction;protection
R743.33;R-332
A
1671-8348(2010)12-1487-02
湖北省高等学校科学研究青年发展项目(98B042)。△< class="emphasis_bold">通讯作者,
,E-mail:xgmsys@21cn.com。#现湖北省襄樊市中医院麻醉科工作。
2009-07-27
2009-11-17)
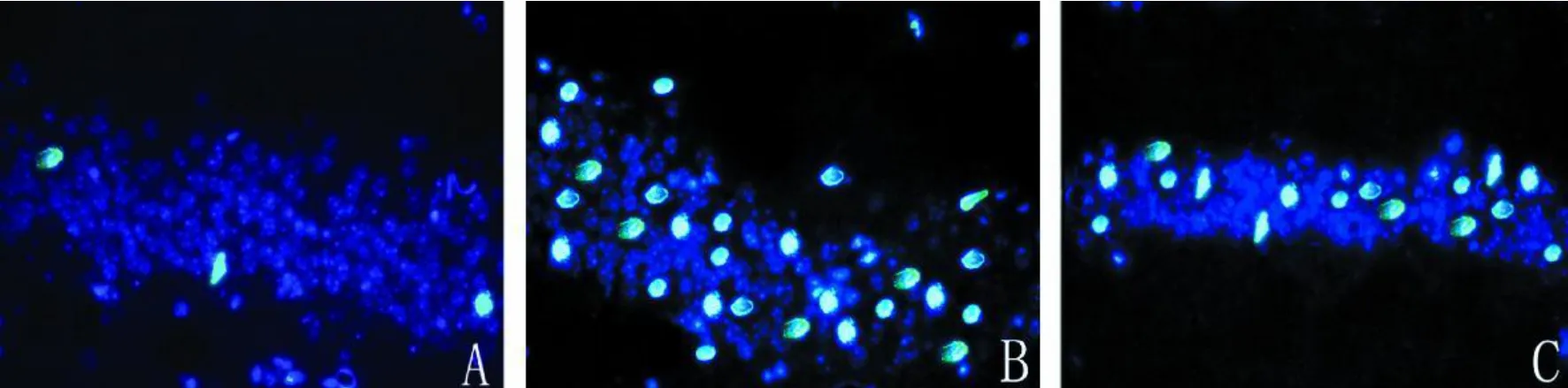
图1 24 h后凋亡海马神经元(×400)
·经验交流·

