响应面法优化酿酒酵母谷胱甘肽的提取条件
郑丽雪,王立梅,梅艳珍,齐 斌*
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
响应面法优化酿酒酵母谷胱甘肽的提取条件
郑丽雪,王立梅,梅艳珍,齐 斌*
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
利用Box-Benhnken中心组合设计和响应面法优化乙醇提取酿酒酵母胞内谷胱甘肽的条件。结果表明,谷胱甘肽最佳提取条件为乙醇体积分数43.7%、乙醇添加量7.03mL/0.1g干酵母粉、抽提时间80min、谷胱甘肽提取率达最大为9.54mg/g。
谷胱甘肽;乙醇;酿酒酵母;响应面分析
谷胱甘肽(glutathione,GSH)是一种由L-谷氨酸、L-半胱氨酸和甘氨酸经肽键缩合而成的生物活性三肽化合物,其广泛分布于动物、植物和微生物细胞内,以酵母、小麦胚芽以及人和动物的肝脏、肾、红细胞和眼睛晶状体中含量较为丰富[1-4]。GSH分子中含有一个特异的γ-肽键[5],且半胱氨酸侧链基团上连有一个活泼的巯基,这些结构决定了其在生物体内具有重要的生理功能。例如,它可以迅速提高机体免疫力,在抗氧化、抗辐射、消除自由基、解毒、促进铁质吸收等方面具有良好效果,另外,它还具有增强食品营养价值和强化食品风味等功能[6-7]。
目前,GSH的生产方法主要有溶剂萃取法、化学合成法、酶转化法和发酵法[8]。其中,利用酵母发酵生产谷胱甘肽是最具潜力的方法[9]。但由于GSH为胞内产物,采用有效的提取手段使GSH从酵母细胞内溶出十分重要,一些化学破壁法(酸解、碱解)、物理破壁法(液体剪切、固体剪切)、生物破壁法(酶解、自溶)被广泛应用,这些方法将细胞内的谷胱甘肽释放出来的同时,细胞内的其他物质如蛋白质、核酸、氨基酸等物质也一起释放出来,不利于后续的分离工作[10]。抽提液中GSH的分离纯化是当前研究的技术难题之一。
本实验采用低体积分数乙醇可以改变细胞壁通透性、使细胞内的部分物质如谷胱甘肽通过细胞壁扩散到胞外的特点[11],利用Box-Benhnken中心组合设计和响应面法对乙醇提取酿酒酵母胞内谷胱甘肽的条件进行优化,确定其提取条件。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)CS10515-1为本实验室保存。
GSH标准品(色谱纯)、ALLOXAN试剂(分析纯) 美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本岛津公司;3-30K台式高速冷冻离心机 德国Sigma公司; CHRIST冻干机 德国默克公司。
1.3 方法
1.3.1 GSH抽提方法
取0.1g干酵母粉置于离心管底部,分别加入体积分数为15%、25%、35%、45%、55%的乙醇溶液,加入量为4~16mL,于30℃振荡抽提45~105min,4℃离心分离,取上清液1mL测GSH含量。
1.3.2 GSH提取的单因素试验
分别以不同的乙醇体积分数、乙醇添加量和抽提时间为因素,考察各因素对GSH提取率的影响,反应温度为30℃。
1.3.3 响应面分析
在单因素试验结果的基础上,采用响应面(response surface methodology,RSM)分析法对乙醇提取谷胱甘肽的条件进行优化。
1.3.4 GSH含量的测定
采用ALLOXAN法[12]。

2 结果与分析
2.1 GSH提取的单因素试验
2.1.1 不同乙醇体积分数对GSH提取率的影响
分别考察了15%、25%、35%、45%、55%的乙醇对GSH 提取率的影响,其他条件保持不变(乙醇加入量20mL,抽提时间120min(图1)。
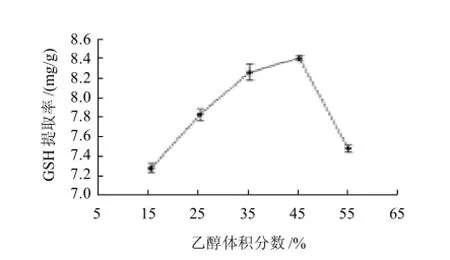
图1 不同乙醇体积分数对GSH提取率的影响Fig.1 Effect of ethanol concentration on glutathione yield
由图1可见,随着乙醇体积分数的增加,GSH提取率逐渐增加,当乙醇体积分数为45%时,提取率达到最大,继续增加乙醇的体积分数,GSH提取率迅速下降。Xiong等[11]研究发现乙醇体积分数25%是提取冻干的高密度发酵后的酵母细胞胞内GSH最佳体积分数,最高提取率达到0.31%。25%乙醇可以使GSH顺利通过酵母细胞的三层生物膜即线粒体内膜、外膜以及细胞质膜而不破坏细胞壁[13]。舒媛等[14]等确定50%乙醇能有效地提取湿酵母中GSH,折合成干酵母计算,最高提取率达到2.01%。安贤惠[15]研究了提取市售的安琪活性酵母胞内GSH,结果表明,乙醇体积分数越小,提取酵母中GSH的效果越好,最高提取率为1.15%。本实验结果表明,45%乙醇能有效提取胞内的GSH,一方面可能由于试验过程中使用的干酵母来源不同,造成试验原料本身的细胞壁的通透性就有差异;而料液比不同可能是导致试验结果有差异的另一个原因。
2.1.2 乙醇添加量对GSH提取率的影响
考察了45%乙醇的添加量对GSH提取率的影响,添加量分别为4、7、10、13、16mL,抽提时间120min (图2)。
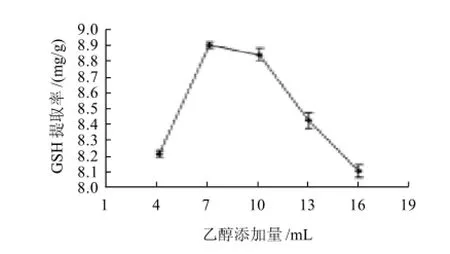
图2 乙醇添加量对GSH提取率的影响Fig.2 Effect of ethanol addition amount on glutathione yield
由图2可见,乙醇添加量对GSH的提取率影响很大,随着添加量由4mL增加到7mL,GSH提取率急剧上升,当添加量为7mL时,提取率达到最大,从7mL到10mL时,GSH提取率缓慢下降,二者之间的提取率仅相差0.06mg/g,而添加量从10mL增加到16mL时,GSH提取率又急剧下降。可能由于在乙醇添加量较小时,不能完全将细胞内的GSH抽提出来,而添加量较大时,可能是位于酵母细胞胞膜上的γ-谷氨酰转肽酶(γ-GT)暴露出来,将GSH降解,γ-GT是唯一的谷胱甘肽降解酶[16]。
2.1.3 抽提时间对GSH提取率的影响
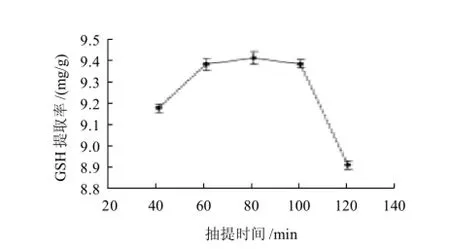
图3 抽提时间对GSH提取率的影响Fig.3 Effect of extraction time on glutathione yield
在乙醇体积分数45%,添加量7mL的前提下,考察了不同抽提时间对GSH提取率的影响,抽提时间分别为40、60、80、100、120min(图3)。
由图3可见,抽提时间为40min时,GSH提取率较低,而抽提时间为60、80、100min时,GSH提取率相差不大,80min时达到最大,而在120min时,GSH提取率又急剧下降。这与 Xiong等[11]得出最佳提取时间为60min基本相符。由于乙醇在细胞内溶解了包括GSH在内的一些物质后,细胞内溶液浓度显著提高,使细胞内外出现浓度差和渗透压差,细胞内高浓度的溶液不断向低浓度方向扩散,而45%乙醇为稀溶液,由于渗透压的作用,又不断进入细胞内,以平衡其渗透压,但经一定时间后,扩散达到平衡时,时间就不再起作用。所以在40~80min时,抽提量和时间呈正比,而抽提时间超过80min时,由于GSH不稳定导致其提取率的下降[15]。
2.2 响应面法对乙醇提取酿酒酵母中谷胱甘肽条件的优化
在单因素试验基础上,以GSH提取率为响应值,采用Box-Benhnken的中心组合试验设计,进一步进行三因素三水平的RSM分析试验。编码与因子对应关系见表1,试验设计及结果见表2。

表1 Box-Benhnken中心组合试验因素水平编码Table 1 Factors and levels in Box-Behnken design
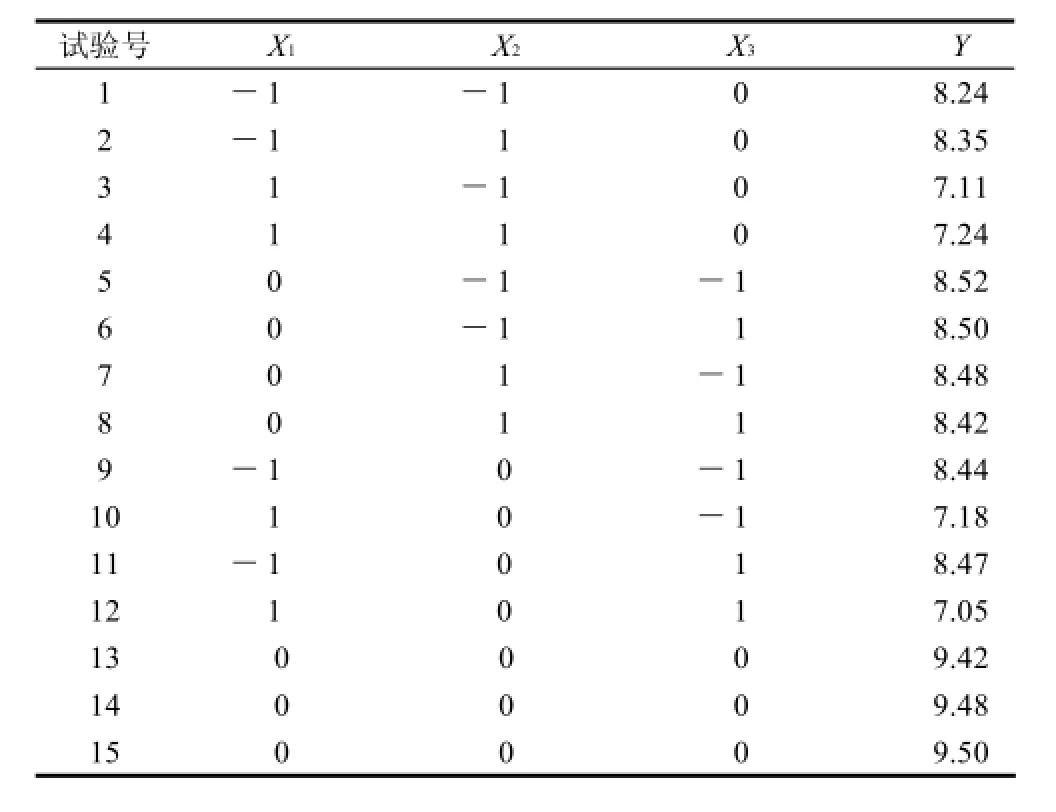
表2 Box-Benhnken的中心组合试验设计及GSH提取率Table 2 Box-Behnken design matrix and experimental values of glutathione yield
运用SAS程序对回归方程进行方差分析(表3)。分析结果表明,X1、X12、X22、X32项对GSH提取率影响极显著,由此所建立的模型也是极显著;其他项影响不显著。
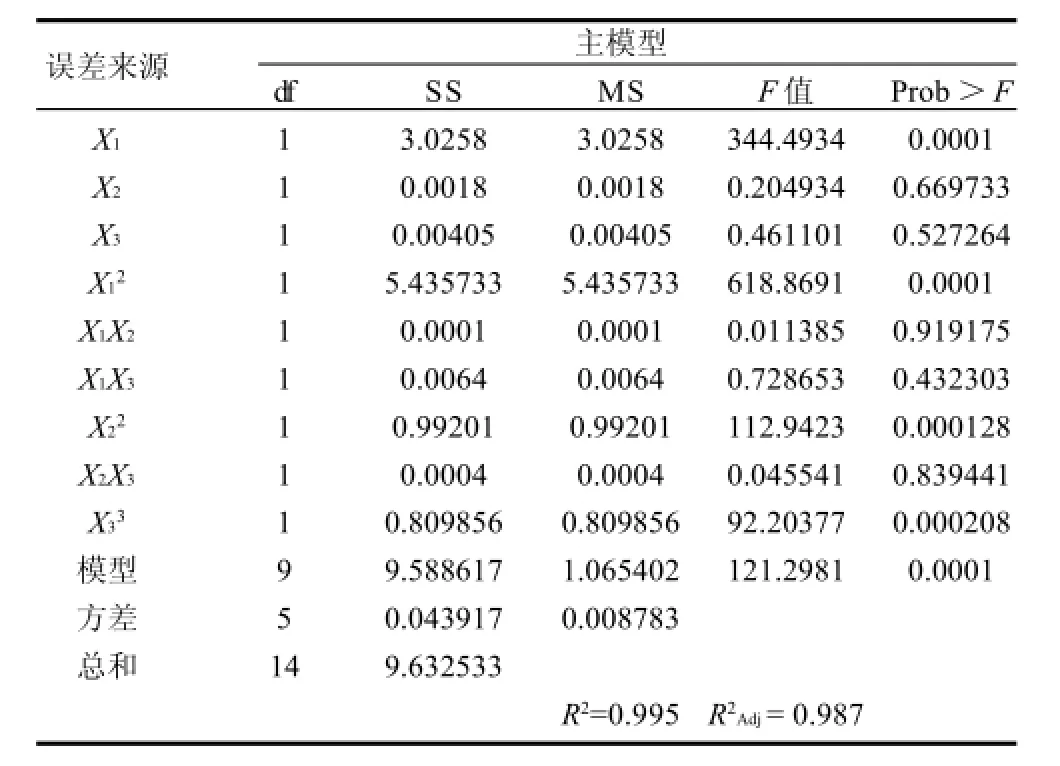
表3 响应面试验方差分析Table 3 Variance analysis for fitted regression model

图4 Y=(X2,X3)的响应面分析图Fig.4 Response surface plot of glutathione yield as a function of amount of added ethanol and extraction time
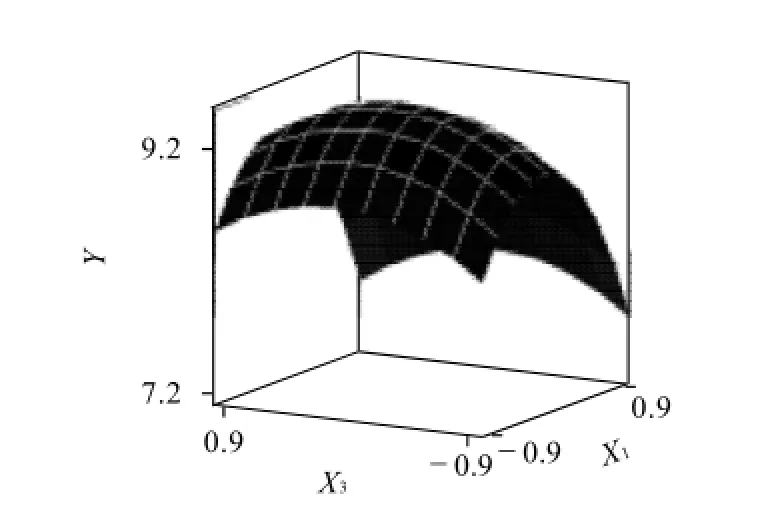
图5 Y=(X1,X3)的响应面分析图Fig.5 Response surface plot of glutathione yield as a function of ethanol concentration and extraction time
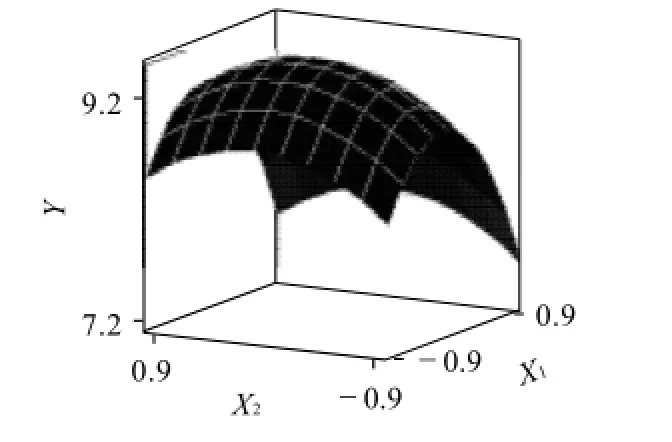
图6 Y=(X1,X2)的响应面分析图Fig.6 Response surface plot of glutathione yield as a function of ethanol concentration and amount of added ethanol
从图4~6可以直观地看出,各因素对响应值的影响变化趋势。以GSH提取率为响应值,运用SAS程序进行回归拟合后回归方程如下:
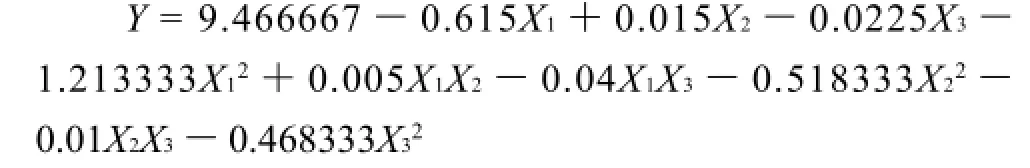
对回归方程求解得:X1=-0.253、X2=0.013、X3=-0.010,即当乙醇体积分数43.7%、乙醇添加量7.03mL/ 0.1g干酵母粉、抽提时间80min时,GSH提取率为9.54mg/g。3次验证实验结果与预测值拟合较好,说明回归方程为胞内GSH的提取提供了一个合适的模型。
3 结 论
采用响应面分析法优化了乙醇提取酿酒酵母中GSH的最佳条件,最佳的提取条件为乙醇体积分数43.7%、乙醇添加量7.03mL/0.1g干酵母粉、抽提时间80min,GSH提取率为9.54mg/g。通过对预测模型的验证实验,实际实验值与模型预测值基本一致,说明模型能较好的反应实际情况。
[1]刘振玉. 谷胱甘肽的研究与应用[J]. 生命的化学, 1995, 15(1): 19-21.
[2]SPECTOR D. LABARRE J. TOLEDANO M. et al. A genetic investigation of the essential role of glutathione[J]. J Biol Chem, 2001, 276: 7011-7016.
[3]UDEH K O, ACHREMOWICZ B. High-glutathione containing yeast Saccharomyces cerevisiae: optimization of production[J]. Actamicrobial Pol, 1997, 46: 105-114.
[4]陈金永, 李朕杰. 谷胱甘肽: 一种新型饲用添加剂[J]. 中国动物保健, 2005(5): 40-41.
[5]沈同, 王镜岩. 生物化学[M]. 2版. 北京: 高等教育出版社, 2000: 114-116.
[6]王大慧, 卫功元. 谷胱甘肽的应用前景及生产研究现状[J]. 化学与生物工程, 2004(3): 10-12.
[7]蔡俊. 谷胱甘肽的研究进展[J]. 粮食与饲料工业, 2000(10): 41-42.
[8]MRATA K , KIMURA A. Overproduction of glutathione and its derivatives by genetically engineered microbial cells[J]. Biotechnol Adv, 1990, 8(1): 59-96.
[9]KIMURA H, INOUE Y, KOBAYASHI S. Production of glutathione: Japan, 08-707884[P]. 1996-03-19.
[10]胡静. 还原型谷胱甘肽分离纯化方法及其稳定性的研究[D]. 武汉: 湖北工业大学, 2007: 1-53.
[11]XIONG Zhiqiang, GUO Meijin, GUOYuanxin, et al. Efficient extraction of intracellular reduced glutathione from fermentation broth of Saccharomyces cerevisiae by ethanol[J]. Bioresource Technology, 2009, 100: 1011-1014.
[12]李寅, 陈坚, 周楠迪, 等. 氨基酸的酵母膏对谷胱甘肽发酵的影响[J].中国医药工业杂志, 1998, 29(12): 537-542.
[13]INOUE Y, NOMURA W, TAKEUCHI Y, et al. Efficient extraction of thioreodoxin from Saccharomyces cerevisiae by ethanol[J]. App Environ Microb, 2007, 73: 1672-1675.
[14]舒媛, 王家骐, 朱立江, 等. 酵母中还原型谷胱甘肽的提取方法研究[J]. 发酵科技通讯, 2008, 37(3):16-19.
[15]安贤惠. 还原型谷胱甘肽提取方法初探[J]. 淮海工学院学报, 2003, 12(3): 49-52.
[16]MEISTER A, ANDERSO M E. Glutathione[J]. Annu Rev Biochem, 1983, 52: 711-712.
Optimization of Glutathione Extraction from Saccharomyces cerevisiae Using Response Surface Methodology
ZHENG Li-xue,WANG Li-mei,MEI Yan-zhen,QI Bin*
(College of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Box-Behnken design and response surface methodology were applied to maximize the glutathione yield from Saccharomyces cerevisiae extracted with alcohol. Results showed that the optimum conditions of glutathione extraction were as follows: ethanol concentration 43.7%, amount of added ethanol 7.03 mL/ 0.1 g yeast powder and extraction time 80 min. Under such optimal conditions, a maximal glutathione yield of 9.54 mg/g were obtained.
glutathione;ethanol;Saccharomyces cerevisiae;response surface analysis
TQ926.4
A
1002-6630(2010)10-0060-04
2009-08-01
苏州市科技发展计划应用基础研究项目(YJG0913);江苏省高校“青蓝工程”中青年学术带头人项目
郑丽雪(1982—),女,助理实验师,硕士,研究方向为食品生物技术。E-mail:lixue9418@163.com
*通信作者:齐斌(1965—),男,教授,博士,研究方向为粮食油脂与植物蛋白工程。 E-mail:qibin65@126.com

