几种肿瘤特异性启动子在人肝癌细胞系中的活性比较*
况 舸,唐 霓,陶 鹏,吴 莹,张 君,黄爱龙△
(重庆医科大学:1.药学院药理教研室 400016;2.教育部感染性疾病分子生物学重点实验室,病毒性肝炎研究所 400016;3.附属第二医院感染科 400010)
原发性肝癌是一种常见的恶性肿瘤,适于手术切除的病例很少,常规的手术、化疗、放疗疗效较差。肝癌基因治疗是研究的热点,多种基因治疗手段已经被证实具有良好的肿瘤杀伤作用,但由于目前采用的基因治疗载体缺乏肿瘤靶向性,因此限制了基因治疗方法的临床应用。
利用肿瘤特异性启动子调控治疗基因表达是解决基因治疗靶向性的方法之一,目前研究最多的是甲胎蛋白(AFP)启动子在肝癌的基因治疗中的应用。多项研究已经证实AFP基因的调控区能够在肝癌细胞内特异性激活外源基因的转录,并在肝癌的靶向性基因治疗中取得一定疗效[1-2]。但AFP启动子存在转录活性低、阳性率低的弱点。因此,肝癌的靶向性基因治疗需要寻找更加广谱、有效的启动子来调控目的基因的表达。
端粒酶的激活是细胞发生永生化及癌变过程中极为重要的步骤。人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)仅在端粒酶阳性的肿瘤细胞和永生化细胞中表达,是端粒酶的催化亚基,决定了端粒酶的活性[3]。在所有肝细胞癌(hepatocellular carcinoma,HCC)中均有hT ERT表达,其中74%为强表达[4]。hTERT基因上游调控区具有强启动子活性,且仅表现于端粒酶阳性的永生化及癌细胞系,提示hTERT基因启动子具有肿瘤特异性的转录活性[5]。
survivin(SUR)是一类仅在肿瘤细胞中表达的凋亡抑制因子(inhibitor of apoptosis,IAP),在终末分化的成人组织不表达[6]。在12种常见的肝癌细胞株中SUR mRNA均有表达,SUR蛋白在70%肝癌中呈强阳性,其表达在肝癌组织与癌旁肝组织间存在显著性差异[7-9]。因此,SUR启动子被认为是一种肝癌特异性的启动子,能够实现治疗基因在肝癌中的选择性转录,避免损伤正常肝组织。
作者用PCR方法从人类基因组中克隆了hTERT、SUR、AFP基因 ATG上游的启动子序列,分别构建了 hTERT、SUR、AFP驱动的含有报告基因虫荧光素酶(luciferase,Luc)的真核表达载体,通过测定在人HCC细胞系和正常原代培养细胞中的Luc的表达,评价并比较hTERT、SUR、AFP启动子的转录活性,为进一步应用于肝癌靶向性基因治疗打下基础。
1 材料与方法
1.1 材料
1.1.1 质粒和细胞 pGL3-Basic和 pRL-tk购自 Promega公司,前者为无启动子的含有Luc基因的质粒,后者为含有单纯疱疹病毒胸苷激酶(HSV-TK)启动子控制的海洋腔肠荧光素酶基因(renilla luciferase,RL)的质粒。肝癌细胞系HepG2、QGY7701和SMMC7721均由本研究所保存。
1.1.2 主要试剂 T4DNA连接酶、各种限制性内切酶、双荧光检测系统Dual-Luciferase Reporter Assay System购自Promega公司,脂质体转染试剂Lipofectamine2000购于Invitrogen公司。
1.2 方法
1.2.1 HepG2细胞基因组DNA的提取 单层培养的HepG2细胞长至80%融合,PBS洗3次后用细胞刮子刮下收集于1.5 mL的EP管中。按DNA提取试剂盒操作说明制备基因组DNA。
1.2.2 AFP、SUR、hTERT巨细胞病毒和巨细胞病毒(CM V)启动子引物设计 根据GenBank中SUR基因和AFP基因序列以及pEGFP质粒中CMV启动子序列设计引物并分别在各上下游引物5′端引入BglⅡ和HindⅢ酶切位点。hTERT启动子的引物序列:上游5′-CGC AGA TCT CAG CTG CGC TGT CGG GGC CAG G-3′;下游 5′-CGC AAG CT T GCT GCC TGA AAC TCG CGC CGC GA-3′。SU R启动子的引物序列:上游 5′-CGC AGA TCT ATT ACA GGC ATG CAC CAC-3′;下游 5′-GCG AAG CTT AAT CTG GCG GTT AA T GGC-3′。AFP启动子的引物序列:上游 5′-GCG AGA TCT TCT GCA ACT TAG GGA CAA-3′;下游 5′-GCG AAG CT T GT T ATT GGC AGT GGT GGA-3′。 CM V 启动子引物序列:上游 5′-GCG AGA TCT AA T CAA TTA CGG GGT CAT-3′;下游 5′-GCG AAG CT T GGA TCT GAC GGT TCA CTA-3′。
1.2.3 AFP、SUR、hTERT和 CMV启动子片段的PCR扩增采用50 μ L 体系。以 1 μ g DNA 为模板;分别加入 Taq酶1.5 u;上下游引物各50 pmol;dNTPs 10 nmol。以 HepG2基因组DNA为模板扩增 AFP、SUR、hTERT启动子片段,以质粒pEGFP为模板扩增 CMV启动子。AFP、SUR、hT ERT启动子片段扩增采用热启动法。AFP启动子扩增条件为:95℃,4 min,加入Taq酶。94℃,45 s;60℃,50 s;72℃,1 min。25个循环后,72℃延伸10 min。PCR产物为330 bp。hT ERT启动子扩增条件为:95℃,4 min,加入 Taq酶。94℃,45 s;72℃,50 s;72℃,60 s。25个循环后,72℃延伸10 min。PCR产物为280bp。SUR启动子扩增条件为:95℃,4 min,加入Taq酶。94℃,45 s;62.5℃,50 s;72℃,60 s。25个循环后,72℃延伸10 min。PCR产物为414 bp。CM V启动子扩增采用普通PCR法,扩增条件为:94℃,5 min。94℃,45 s;56℃,50 s;72℃,60 s。25个循环后,72℃延伸10 min。PCR产物为594 bp。
1.2.4 报告基因真核表达载体 pGL3-AFP、pGL3-SUR、pGL3-hTERT和 pGL3-CMV的构建 PCR产物经回收和BglⅡ-HindⅢ双酶切后,克隆至pGL3-Basic载体的相应位点。重组质粒经XhoⅠ/HindⅢ双酶切鉴定后送上海博亚公司测序。测序正确的克隆分别命名为pGL3-AFP和pGL3-SUR、pGL3-hTERT和pGL3-CMV。构建过程见图1。
1.2.5 细胞转染和荧光素酶报告基因检测 以pGL3-Basic为阴性对照,以 pGL3-CMV为阳性对照,将 pGL3-Basic、pGL3-SUR、pGL3-AFP、pGL3-hT ERT 和 pGL3-CM V 各 1ug分别与 pRL-tk 0.1 μ g 共转染 HepG2、SM MC7721、QGY7701细胞和原代培养的成纤维细胞。HepG2、QGY7701和SMMC7721均培养于含10%热灭活小牛血清的RPM I1640培养基,原代成纤维细胞培养于含10%胎牛血清的DMEM培养基。于37 ℃,5%CO2恒温培养箱培养。将 HepG2、QGY7701、SMMC7721和原代成纤维细胞按0.6×105/孔种于24孔板中,用无抗生素的培养液培养24 h后,换无血清培养液,用脂质体(Lipofectamin2000)转染,每种质粒转染 4孔。转染6 h后换掉转染培养液,用含10%小牛血清的RPMI1640培养液继续培养。24 h后,用裂解液裂解转染细胞,测定Luc和RL活性。后者的活性反映每孔细胞的转染效率。各启动子的相对活性以Luc/RL的比值来比较的,同一转染实验的4孔所得Luc/RL的比值求平均值和标准差,并据此作图。
2 结 果
2.1 AFP、hTERT、SUR和CMV 基因启动子的扩增 以HepG2基因组DNA为模板进行PCR扩增。所获PCR产物进行1%琼脂糖凝胶电泳分析(图1)。结果表明,PCR扩增产物分别位于约330、280、465 bp及约595 bp处。

图1 AFP、hTERT、SUR、CM V启动子 PCR产物琼脂糖凝胶电泳
2.2 重组质粒的鉴定 酶切鉴定结果见图2、3。所有质粒均送上海博亚公司测序。测序结果证实此4个启动子序列与目的启动子序列完全一致,无碱基突变。
2.3 细胞转染和荧光素酶报告基因的检测 检测结果见表1。
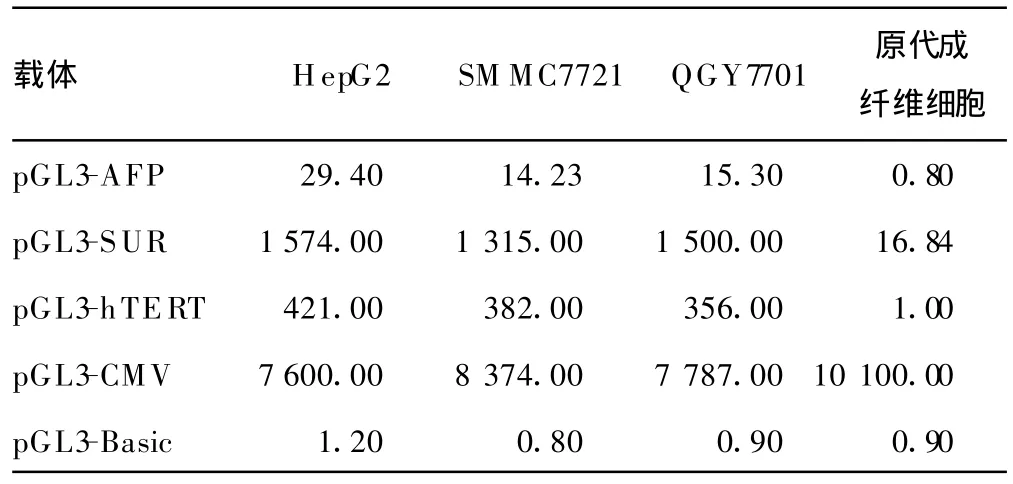
表1 AFP、hTERT、SUR和CMV启动子的相对活性(%)

图2 BglⅡ+HindⅢ双酶切鉴定重组质粒pGL3-AFP、pGL3-SUR、pGL3-CMV

图3 BglⅡ+HindIII双酶切鉴定重组质粒 pGL3-hTERT
结果显示:AFP、hTERT和SU R的启动子均是有肿瘤特异性转录活性。CM V启动子的转录活性没有肿瘤特异性。在3种具有肿瘤特异性转录特性的启动子中,SUR启动子活性最高,hTERT启动子次之,AFP启动子活性最低(图4)。在HepG2细胞中,SUR启动子活性是AFP的53倍,是hT ERT启动子活性的3.7倍,相当于CMV的21%;在SM MC7721细胞中,SUR启动子活性是AFP的92倍,是hT ERT启动子活性的3.4倍,约占CMV的 16%;在QGY7701细胞中SU R启动子活性是AFP的98倍,是hTERT启动子活性的4.2倍,达到CMV的19%(表1)。而hTERT启动子在三种肝癌细胞系中的活性分别为AFP启动子的14倍、30倍和24倍,相当于CM V启动子活性的5.5%、4.6%、4.6%。SUR和hTERT启动子的活性较最常用的肝癌特异性启动子AFP启动子有显著增加,即使在高表达AFP的HepG2细胞中,其启动活性也比AFP启动子活性高数十倍。以上结果提示SUR和hTERT启动子在肝癌细胞中均能够高度激活外源基因表达,在高表达AFP的肝癌细胞中,其启动子活性也优于AFP启动子,见图4。

图4 AFP、hTERT和 SUR启动子在 HCC细胞中的转录活性比较
3 讨 论
基因治疗能否成功应用于临床实践最为关键的问题是如何提高治疗基因的靶向性和表达效率,以保证治疗的安全性和有效性。利用肿瘤特异性启动子调控目的基因在肿瘤细胞中的表达是实现靶向性基因治疗的重要手段。目前肝癌的靶向基因治疗中应用最多的是AFP启动子。但AFP启动子仅在高表达AFP的肝癌细胞中具有一定的治疗效果;对低表达AFP的肝癌无效[1-2]。而在人类肝癌中,高表达AFP的仅占40%左右。因此,对于肝癌的基因治疗需要寻找更加广谱、有效的启动子来调控目的基因的表达。
端粒酶是一种新的广谱的肿瘤标志物,约90%的肿瘤中端粒酶的活性显著增高。人类的端粒酶有三个亚基,包括人端粒酶RNA、端粒酶相关蛋白1和 hTERT,hTERT是端粒酶活性的决定因素。其表达水平在肿瘤中增加而在正常细胞中几乎没有表达[3]。
Horikawa等[5]克隆了hTERT上游调控区,发现该区域缺乏典型真核启动子的核心元件TA TA盒和CAAT盒而富含GC,具有强启动子活性,并与端粒酶的活性一致。hTERT启动子中ATG上游-208~-150 bp的59个碱基是hTERT启动子转录活性的基本单位,在转录起始位点上游含有几个公认的细胞增殖和肿瘤发生相关的转录因子的结合位点,包括3个SP1元件,2个 E box及数个Myc相关锌指蛋白(Myc-associated zinc finger protein,MAZ)和激活蛋白-2(activator protein-2,AP-2)结合位点[5]。先前的研究证实myc-max异二聚体就是与E box结合而激活hTERT启动子的转录[10]。对启动子CpG岛的研究显示其甲基化水平与启动子活性有关[11]。以上研究说明hTERT的表达是在转录水平被调控的。
SUR是1997年由Ambrosini等[6]发现的一种细胞凋亡抑制因子,具有肿瘤特异性表达的特性。Bao等[12]证实SUR蛋白在肿瘤组织中的表达调控是发生在转录水平,因此认为,SUR基因的启动子可能是一种肿瘤特异性的启动子,能够选择性地在肝癌组织中激活其后的外源基因的转录,从而实现对治疗基因在肝癌中的选择性表达,避免损伤周围正常肝组织。
Li等[13]通过分析Hela细胞中SUR基因的调控区,证实在SUR基因起始密码子上游约0.4 kb的片段具有基本的启动子活性。该区域缺乏TATA盒,但在基因读码框上游含有一段GC丰富的区域。在上游-6、-12、-171位,有 3个CDE元件(cell-cycle dependent element),在-42位,有 1个CHR区域(cell-cycle genes homology region)。有证据表明,上述元件在转录水平参与SU R在G2-M期特异性表达的调控。这与之前多项研究已经证实了的SUR的表达受细胞周期的调控,在G2-M期高表达相符。因此具有高度增殖活性的肿瘤细胞能够比正常细胞表达更多的SUR转录产物[6]。
最近,Zhu等[14]研究证实,SU R启动子在人类恶性黑素瘤、乳腺癌、卵巢癌的数个细胞系中具有相当高的启动子活性,而在正常的人纤维母细胞和乳腺上皮细胞中其启动子活性相当低,进一步证实了SUR启动子具有肿瘤特异性转录的特性。
在本研究中,扩增了hTERT基因翻译起始位点上游约0.3 kb的片段、SUR基因翻译起始位点上游约0.4 kb的片段和AFP编码区上游约0.3 kb的片段,结果证实:自人HepG2细胞克隆得到的启动子序列与GenBank中源于其他肿瘤细胞的hTERT、SUR和AFP启动子序列完全相同,说明这3种基因的基本启动子在不同肿瘤细胞中具有高度保守性。
实验证实在人肝癌细胞中AFP、hTERT和SUR启动子均具有肿瘤特异性转录活性。将hTERT和SUR启动子与AFP启动子活性相比较,本研究发现,SUR和hTERT启动子在肝癌细胞系中具有较AFP启动子更强的转录活性,即使是在高表达AFP的HepG2细胞中,其启动活性也比AFP启动子活性高数十倍。结合SUR和hTERT在肝癌中极高的阳性率,本研究认为,利用SUR和hTERT启动子调控治疗基因转录,可望实现对肝癌靶向性的基因治疗。
[1]Hallenbeck PL,Chang YN,Hay C,et al.A novel tumorspecific replication-restricted adenoviral vector for gene therapy of hepatocellular carcinoma[J].Hum Gene Ther,1999,10(10):1721.
[2]Huang X,Zhang W,Wakimoto H,et al.Adenovirus-mediated tissue-specific cytosine deaminase gene therapy for human hepatocellular carcinoma with different AFP expression levels[J].J Exp Ther Oncol,2002,2(2):100.
[3]Soder AI,Hoare SF,Muir S,et al.Amplification,increased dosage and in situ expression of the telomerase RNA gene in human cancer[J].Oncogene,1997,14(9):1013.
[4]Toshikuni N,Nouso K,Higashi T,et al.Expression of telomerase-associated protein1 and telomerase reverse transcriptase in hepatocellular carcinoma[J].Br J Cancer,2000,82(4):833.
[5]Horikawa I,Cable PL,Afshari C,et al.Cloning and characterization of the promoter region of human telomerase reverse transcriptase gene[J].Cancer Res,1999,59(4):826.
[6]Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis geng,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917.
[7]Ikeguchi M,Ueta T,Yamane Y,et al.Inducible nitricoxidesynthase and surviving messenger RNA expression in hepatocellular carcinoma[J].Clin Cancer Res,2002,8(10):3131.
[8]Moriai R,Asanuma K,Kobayashi D,et al.Quantitative analysis of the anti-apoptotic gene surviving expression in malignang haematopoietic cells[J].Anticancer Res,2001,21(1B):595.
[9]Ito T,Shiraki K,Sugimoto K,et al.Survivin promotes cell proligeration in huaman hepatocellular carcinoma[J].Hepatology,2000,31(5):1080.
[10]Wu KJ,Grandori C,Amacker M,et al.Direct activation of TERT transcription by c-MYC[J].Nat Genet,1999,21(2):220.
[11]Devereux TR,Horikawa I,Anna CH,et al.DNA methylation analysis of the promoter region of the human telomerase reverse transcriptase(hTERT)gene[J].Cancer Res,1999,59(24):6087.
[12]Bao R,Connolly DC,Murphy M,et al.Activation of cancer-specific gene expression by the survivin promoter[J].J Natl Cancer Inst,2002,94(7):522.
[13]Li F,Altieri DC.T ranscriptional analysis of human survivin gene expression[J].Biochem J,1999,344(Pt 2):305.
[14]Zhu ZB,Makhija SK,Lu B,et.al.Transcriptional targeting of tumors with a novel tumor-specific survivin promoter[J].Cancer Gene Ther,2004,11(4):256.

