前列腺特异的转录因子NKX3.1上调Dicer1基因的表达*
张 菊, 关恒云, 张鹏举, 陈蔚文, 陈兆波, 倪娜娜, 朱闻捷,王 坤, 胡小燕, 姜安丽△
(山东大学1医学院生物化学与分子生物学研究所,2医学院,山东 济南 250012)
同源盒基因(homeobox genes)最早在果蝇中发现,是一类编码同源域蛋白调控胚胎发育分化的基因。NKX3.1是从小鼠基因组克隆出的新的同源盒基因NK家族成员,位于鼠的14号染色体。人类的同源盒基因 NKX3.1,定位于8p21[1],长度为3.5 kb,有2个外显子,第2个外显子含有同源框序列。NKX3.1在功能上属于核转录因子,特异亲和的序列为TAAGAA[2]。研究表明NKX3.1基因在前列腺上皮及前列腺癌组织特异表达,并与前列腺癌的进展、转型有关,可能作为抑癌基因发挥作用[3]。
Dicer首先也是在果蝇中发现的,由DCR基因编码。在果蝇中有Dcr-1,Dcr-22种亚型,但在人类只有Dicer1基因[4]。人的Dicer1基因定位于染色体14q32.13,全长52.3 kb,包括28个外显子和27个内含子。Dicer1编码蛋白属于RNaseⅢ家族[5],在许多组织中广泛表达,在miRNA的成熟过程中起着重要的作用。miRNA是一类长度很短的非编码单链小分子RNA,参与体内多种代谢过程,包括细胞分化、生物发育、癌症等[6]。miRNA let-7a是 miRNA 家族中已发现的成员之一,包括miRNA let-7a-1、miRNA let-7a-2、miRNA let-7a-3[7]。最近研究显示miRNA let-7a-1在多种肿瘤,包括前列腺癌中表达是下调的,与肿瘤的发生、发展密切相关[8]。
本研究采用基因芯片检测NKX3.1对前列腺癌细胞基因表达谱的影响,发现NKX3.1可上调前列腺癌细胞中Dicer1基因的表达,进一步通过RTPCR和Western blotting检测证实 NKX3.1可上调Dicer1基因表达。为了检测成熟miRNA let-7a-1作用,构建了miRNA let-7a-1靶序列-报告基因重组质粒。同时将miRNA let-7a-1靶序列-报告基因重组质粒转染前列腺癌细胞PC3细胞和PC3(+)细胞中,结果显示,PC3(+)细胞中荧光素酶活性明显下降,表明Dicer1基因能有效促进miRNA let-7a-1的成熟,成熟的miRNA let-7a-1结合靶序列后,抑制了报告基因荧光素酶活性表达。为今后进一步探讨NKX3.1上调Dicer1的具体机制及其miRNA let-7a-1在前列腺癌中作用奠定了基础。
材料和方法
1 材料
质粒 pcDNA3.1(+)(本实验室构建)[9]、Trizol试剂购自Invitrogen;质粒pMIR-reportTM购自Ambion;限制性内切酶、Taq酶、PCR试剂盒购于大连宝生物工程公司;M-MLV逆转录酶购自Fermentas;前列腺癌PC3细胞株购自中科院上海细胞所;鼠抗人Dicer1抗体购自Zamed,羊抗鼠lgG购于北京中杉金桥公司;RPMI-1640培养基购于Gibco;基因组芯片,上海康成生物有限公司;其余试剂为国产分析纯。
2 方法
2.1 PC3稳转细胞系的构建 前列腺癌PC3细胞以1×107cells/L接种于24孔板中,当细胞汇合至约90%时,将 NKX3.1真核表达载体 pcDNA3.1-NKX3.1纯化定量后用FuGENE®HD试剂转染前列腺癌PC3细胞,对照组转染pcDNA3.1空载体。转染24 h后,换用200 mg/L G418的 RPMI-1640筛选,10-14 d后可见阳性克隆,有限稀释法克隆培养获得NKX3.1稳定转染的前列腺癌PC3细胞,稳定转染pcDNA3.1-NKX3.1的前列腺癌PC3细胞命名为PC3(+)。
2.2 基因芯片检测 分别用Trizol试剂提取PC3细胞和PC3(+)细胞总RNA。对样品RNA进行荧光标记,取 10 μg RNA,以 T7 -Oligo(dT)5'-AAACGACGGCCAGTGAATTGTAATAGACTCACTATAGGCGCTTTTTTTTTTTTTTTTV-3'为引物(V可以是 G、C和A),用cDNA synthesis kit合成双链cDNA。双链合成以后用QIAquick PCR purification kit(Qiagen)纯化;用T7 riboMAX express large scale RNA production system(Promega)将双链cDNA进行体外转录合成cRNA;然后用RNeasy mini kit(Qiagen)纯化;随机引物反转录。取2 μg cRNA,用 superscriptⅡ反转录酶20×108U/L(Invitrogen),9 random primer进行反转录,反转录产物用QIAquick PCR purification kit(Qiagen)纯化;取2 μg cRNA反转录产物,以6 random primer为引物进行Klenow标记,标记产物用QIAquick PCR purification kit(Qiagen)纯化,纯化后抽干。标记过程中 dATP、dCTP、dGTP、dTTP使用浓度为 120 μmol/L,dCTP 使用浓度为 60 μmol/L,Cy5-dCTP、Cy3 -dCTP 使用浓度为 40 μmol/L。在本实验中,PC-3细胞的cDNA用Cy5荧光素酶标记,PC-3(+)细胞的cDNA用Cy3荧光素酶标记。标记的DNA溶于30 μL杂交液中(3×SSC,0.2%SDS,5×Denhart’s,25%甲酰胺),于42 ℃杂交过夜。杂交结束后,先在42℃左右含0.2%SDS、2×SSC的液体中洗5 min,而后在0.2×SSC中室温洗5 min。玻片甩干后即可用于扫描。扫描芯片用ScanArray Express双通道激光扫描仪(Packard Bioscience)进行。采用GenePix Pro 4.0图像分析软件(Axon Instruments)对芯片图像进行分析,把图像信号转化为数字信号;然后对芯片上的数据用Lowess方法进行归一化;最后以差异为2倍的标准来确定差异表达基因。
2.3 RT-PCR检测 Dicer1 mRNA表达 根据Dicer1序列设计引物,上游引物(F)序列为:5'-CT-CAGCCATGTGAGATTGTG -3',下游引物(R)序列为:5'-GTCCCAGAACTACCAATACG-3'。用 Trizol一步法提取人前列腺癌PC3细胞和PC3(+)细胞总RNA,用随机6聚体引物和M-MLV逆转录酶将细胞总RNA逆转录为cDNA,以cDNA为模板,以Dicer1 F和 Dicer1 R为引物,PCR扩增 Dicer1基因。PCR 条件:94 ℃ 2 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃20 s,28个循环,最后72℃ 10 min。
2.4 Western blotting检测Dicer1蛋白表达 用细胞裂解液[50 mmol/L Tris- HCl(pH8.0),150 mmol/L NaCl,0.1%SDS,1%NP - 40,100 mg/L PMSF]收集PC3细胞和PC3(+)细胞总蛋白,BCA法蛋白定量后,按30 μg上样电泳,Westhern blotting检测Dicer1蛋白表达,Ⅰ抗为1∶1000稀释的鼠抗人Dicer1,Ⅱ抗为1∶2000稀释的HRP标记的羊抗鼠IgG,以β-actin为内参照,加ECL显色剂显色,暗室中曝光X光观察。
2.5 miRNA let-7a-1靶序列-报道基因融合质粒的构建 根据miRBase Targets数据库查找hsa-let7a-1靶序列(UGAGGUAGUAGGUUGUAUAGUU),人工合成其DNA序列及其互补序列,两端分别加HindⅢ和SacⅠ酶切位点,7a1TF 5'-agcttTGAGGTAGTAGGTTGTATAGTTgagct-3';7a1TR 3'-aACTCCATCATCCAACATATCAAc-5'。等摩尔比混合2条链,95℃加热5 min后,自然冷却至室温。将退火双链克隆到pMIR-reportTMluciferase载体中构成miRNA let-7a-1靶序列-报道基因融合质粒 pMIR-reportlet7a-1T。限制性内切酶MluⅠ酶切及测序鉴定阳性重组体。pMIR-reportTMluciferase vector中内切酶MluⅠ的切点位于片段插入处HindⅢ和SacⅠ切点之间。
2.6 细胞培养及转染实验 前列腺癌PC3细胞和PC3(+)细胞分别接种于24孔板,用含10%小牛血清、1×105U/L青霉素及1×105U/L链霉素的RPMI-1640培养基,37℃、5%CO2条件下培养。当细胞融合度﹥80%时,换用无抗生素RPMI-1640培养基,用FuGENE®HD试剂转染细胞(4复孔),每孔1μL FuGENE® HD+0.5 μg pMIR - report- let7a1T+0.05 μg pMIR - report β - gal control+25 μL opti-MEM。对照组转染等剂量 pMIR-reportTMluciferase空载体。
2.7 荧光素酶活性测定 按试剂盒(Promega)说明进行,弃掉细胞培养基,PBS冲洗细胞1次,加入1×RLB裂解液,放置室温10 min后,吹打细胞,收集细胞裂解液。荧光素酶活性测定:荧光测定管中加100 μL LARⅡ(luciferase assay reagent),再加细胞裂解液20 μL,放置发光仪中,测定pGL3中的firefly荧光素酶活性,读数为M1。β-半乳糖苷酶活性测定:30 μL细胞裂解液+20 μL 1×RLB裂解液+50 μL 2×AB检测缓冲液,37℃保温30 min,加150 μL 1 mol/L碳酸钠终止反应,420 nm检测,计算得到的β-半乳糖苷酶活性为M2。用M1/M2比值表示相对荧光素酶活性。
3 统计学处理
结 果
1 芯片结果
结果显示,Dicer1基因在前列腺癌PC3细胞和PC3(+)细胞表达有明显差异,Cy3/Cy5的比值为3.59,见图1。
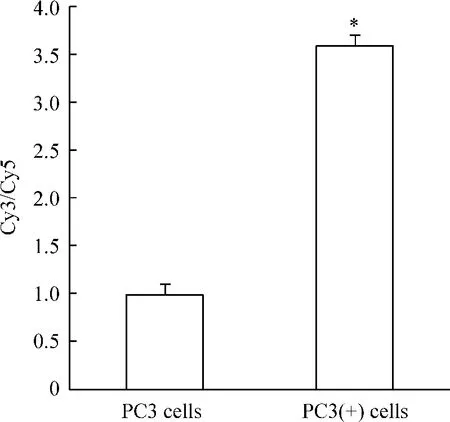
Figure 1.The differential expression of Dicer1 in PC3(+)and PC3 cells detected by gene chip..n=3.*P<0.05 vs PC3 cells.图1 基因芯片检测Dicer1基因在PC3(+)和PC3细胞中的表达
2 NKX3.1对Dicer1 mRNA表达的影响
Dicer1 mRNA在PC3(+)细胞中表达较在PC3细胞的表达明显增加,见图2。
3 NKX3.1对Dicer1蛋白表达的影响
Dicer1蛋白质在PC3(+)细胞中表达较在PC3细胞的表达明显增加,见图3。
4 miRNA let-7a-1靶序列-报道基因融合质粒酶切鉴定及测序
人工合成hsa-let7a-1靶序列的DNA序列及其互补序列,2端分别加HindⅢ和SacⅠ酶切位点。退火克隆到pMIR-reportTMluciferase载体中成功构成miRNA let-7a-1靶序列-报道基因融合质粒pMIR-report-let7a-1T。经MluⅠ酶切pMIR-report-let7a-1T和pMIR-reportTMluciferase空载体后,琼脂糖凝胶电泳结果与预期结果相符,见图4。

Figure 2.The expression of Dicer1 mRNA in PC3(+)and PC3 cells..n=3.*P<0.05 vs PC3 cells.M:marker;1:PC3(+)cells 2:PC3 cells.图2 Dicer1 mRNA分别在PC3(+)和PC3细胞中表达

Figure 3.The expression of Dicer1 protein in PC3 cell and PC3(+)cell by Western blotting..n=3.*P<0.05 vs PC3 cells.1:PC3(+)cells;2:PC3 cells.图3 Western blotting检测Dicer1蛋白质在PC3(+)和PC3细胞中表达
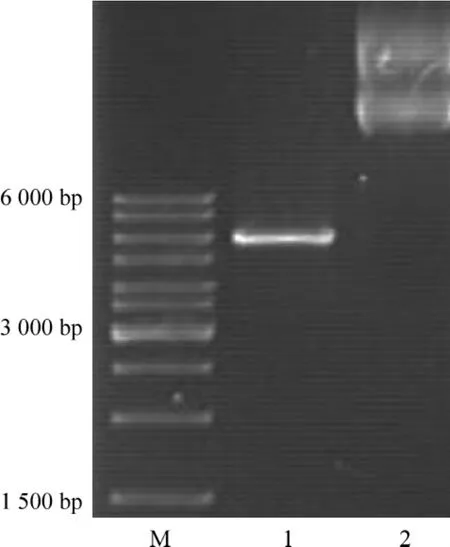
Figure 4.Identification of cloned pMIR -report-let7a-1T by restriction enzyme digestion.M:marker;1:pMIR -reportTMluciferase vector digested by MluⅠ;2:pMIR-report-let7a-1T digested by MluⅠ.图4 let-7a-1靶序列-报道基因融合质粒酶切电泳鉴定
5 成熟miRNA let-7a-1对其靶序列的作用
pMIR-report-let7a-1T转染PC3和PC(+)细胞后,相对荧光素酶活性(Ml/M2)分别为14.2和6.4,两者差异显著(P<0.05),表明pMIR-reportlet7a-1T转染PC3(+)细胞后,NKX3.1上调Dicer1的表达,有效促进miRNA let-7a-1的成熟。pMIR-reportTMluciferase空载体转染 PC3细胞和 PC3(+)细胞后,M1/M2分别为150.4和150.5,两者没有明显差异,见图5。
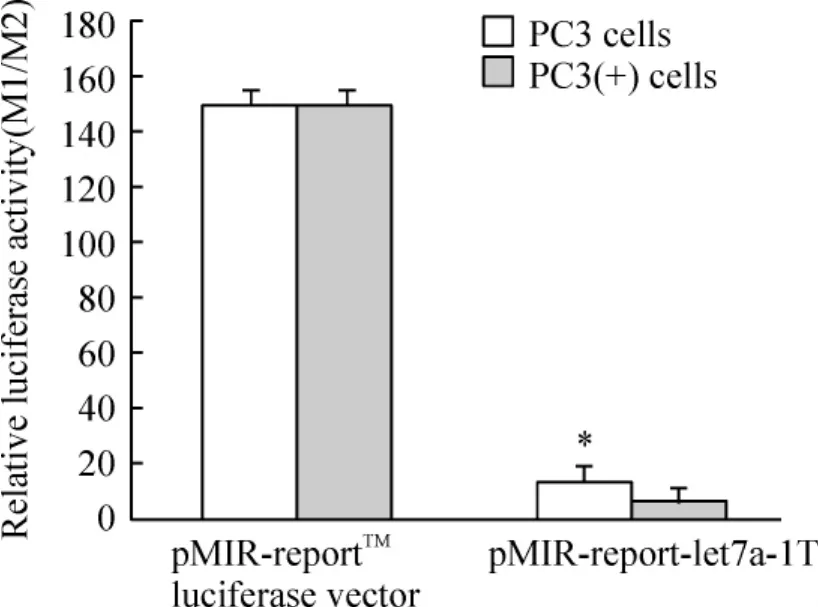
Figure 5.The effects of mature let-7a-1 on its target sequence detected by luciferas assay..n=4.*P<0.05 vs PC3(+)cells in the same group.图5 荧光素酶活性检测成熟let-7a-1对靶序列的作用
讨 论
NKX3.1是前列腺特异表达的同源盒基因,受雄激素调节,其产物在结构与功能上属于核转录因子[10],具有抑制前列腺上皮生长及维持分化的作用,与前列腺的发育成熟以及前列腺癌的发生发展密切相关[11]。Dicer是RNaseⅢ家族成员,在进化上高度保守[12]。Dicer蛋白为一种约200 kD的多结构域蛋白质,含有5个结构域:1个DexH型ATP依赖的N末端解旋结构域;1个PAZ结构域;2个RNaseⅢ结构域;1个dsRNA结合结构域[13]。Dicer主要凭借其RNaseⅢ结构域发挥作用。研究发现:Dicer1对形成miRNA成熟产物是必需的,其PAZ结构域的作用可能是促进Dicer1与miRNA前体分子结合,对miRNA介导的转录后基因沉默是必不可少的[14]。miRNA分子是一类长约18-25个核苷酸的非编码小分子RNA,在转录后水平通过阻遏局部碱基互补配对的mRNA的翻译而抑制靶基因的表达[15]。miRNA的成熟需要经历3个过程:首先在细胞核中最原始的编码miRNA的基因组DNA转录成miRNA的原始转录物(pri-miRNA),在Drosha酶作用下生成pre-miRNA;然后pre-miRNA被转运到细胞质;最后,在细胞质中pre-miRNA在Dicer酶作用下被剪切成双链成熟的miRNA。成熟miRNA通过与靶基因mRNA的3'非翻译区结合,抑制mRNA的翻译。
本实验首次报道了NKX3.1上调Dicer1的表达,与miRNA的成熟与功能有密切关联。目前研究表明miRNA表达在多种肿瘤的发生发展中发挥重要作用[16],可以起到“癌基因”或者“抑癌基因”的功能[17]。miRNA let-7a-1 是目前研究最为广泛的miRNA之一,研究显示miRNA let-7a-1在前列腺肿瘤中表达是下调的,与前列腺肿瘤的发生、发展密切相关。NKX3.1是前列腺特异性同源框基因,目前认为NKX3.1为前列腺特异的抑癌基因,它的缺失或突变,可能是前列腺癌发生和雄激素非依赖等恶性表型的原因[18]。NKX3.1是否通过调节Dicer1表达间接调控miRNA let-7a-1的功能,从而抑制前列腺肿瘤的发生发展?有待于在大量临床标本中进一步实验研究。同时,本实验研究也为前列腺癌的治疗开辟了新途径。
[1]Liu W,Zhang P,Chen W,et al.Characterization of two functional NKX3.1 binding sites upstream of the PCAN1 gene that are involved in the positive regulation of PCAN1 gene transcription[J].BMC Mol Biol,2008,9:45.
[2]Bowen C,Stuart A,Ju JH,et al.NKX3.1 homeodomain protein binds to topoisomerase I and enhances its activity[J].Cancer Res,2007,67(2):455 -464.
[3]Ouyang X,DeWeese TL,Nelson WG,et al.Loss-offunction of Nkx3.1 promotes increased oxidative damage in prostate carcinogenesis[J].Cancer Res,2005,65(15):6773-6779.
[4]Ye X,Liu Q.Expression,purification,and analysis of recombinant Drosophila Dicer-1 and Dicer-2 enzymes[J].Methods Mol Biol,2008,442:11 -27.
[5]Jin L,Kryukov K,Suzuki Y,et al.The evolutionary study of small RNA-directed gene silencing pathways by investigating RNase Ⅲ enzymes[J].Gene,2009,435(1 -2):1-8.
[6]Skaftnesmo KO,Prestegarden L,Micklem DR,et al.MicroRNAs in tumorigenesis[J].Curr Pharm Biotechnol,2007,8(6):320 -325
[7]Roush S,Slack FJ.The let- 7 family of microRNAs[J].Trends Cell Biol,2008,18(10):505 -516.
[8]Shi XB,Tepper CG,White RW.MicroRNAs and prostate cancer[J].Cell Mol Med,2008,12(5A):1456 -1465.
[9]刘闻闻,于春晓,崔福爱,等.人同源盒基因NKX3.1对前列腺癌细胞的诱导凋亡作用[J].中国生物化学与分子生物学报,2006,22(12):996-1002.
[10]Holmes KA,Song JS,Liu XS,et al.NKX3.1 and LEF.1 function as transcriptional inhibitors of estrogen receptor activity[J].Cancer Res,2008,68(18):7380 -7385.
[11]Asatiani E,Huang WX,Wang A,et al.Deletion,methylation,and expression of the NKX3.1 suppressor gene in primary human prostate cancer[J].Cancer Res,2005,65(4):1164-1173.
[12]Forman JJ,Legesse-Miller A,Coller HA.A search for conserved sequences in coding regions reveals that the let-7 microRNA targets Dicer within its coding sequence[J].Proc Natl Acad Sci USA,2008,105(39):14879-14884.
[13]Peng JJ,Yan F,Chen HR,et al.Progress of studies on Dicer structure and function[J].Yi Chuan,2008,30(12):1550-1556.
[14]Lee H,Lee HS,Yoon SY,et al.Contributions of 3'-overhang to the dissociation of small interfering RNAs from the PAZ domain:molecular dynamics simulation study[J].Mol Graph Model,2007,25(6):784 -793.
[15]Ramiro G,Muller F,Amellia C,et al.MicroRNA expression and function in cancer[J].Trends Mol Med,2006,12(12):580-587.
[16]曲昌菊,王旭丹,杨惠玲,等.相同遗传背景下同辐射抗拒鼻咽癌细胞miRNA差异表达的研究[J].中国病理生理杂志,2009,25(3):484 -488.
[17]Finoux AL,Chartrand P.Oncogenic and tumour suppressor microRNAs[J].Med Sci(Paris),2008,24(12):1049-1054.
[18]Wang P,Ma Q,Luo J,et al.NKX3.1 and p27(KIP1)cooperate in proliferation inhibition and apoptosis induction in human androgen-independent prostate cancer cells[J].Cancer Invest,2009,27(4):369 -375.

