糖尿病大鼠肾脏肾素及其受体表达改变*
高 召,任志龙,丁国华,梁 伟,杨红霞(武汉大学人民医院肾内科,武汉 430060)
肾素-血管紧张素系统(renin-angiotensin system,RAS)在糖尿病肾病进展过程中发挥着关键的作用,阻断RAS成为目前治疗糖尿病肾病的重要措施[1-3]。然而临床上作用于RAS的药物会引起血浆肾素水平升高,减弱治疗效果[4]。近年来肾素及肾素受体成为研究的热点,人们希望通过此靶点从源头阻断RAS以获得更佳疗效。目前,有关糖尿病模型肾脏中肾素和肾素受体表达水平的研究较少。为了进一步研究糖尿病模型肾素与肾素受体表达变化与糖尿病肾病之间的联系,本研究拟通过建立链脲佐菌素(streptozotocin,STZ)糖尿病大鼠模型,观察糖尿病大鼠肾脏肾素及肾素受体表达变化。
1 材料与方法
1.1 主要试剂与仪器 STZ(Sigma);多克隆兔抗大鼠肾素/肾素抗体(renin/renin receptor antibody,Santa Cruz公司);SP免疫组化染色试剂盒(北京博奥森生物技术有限公司);浓缩型DAB试剂盒(北京中杉公司);Trizol试剂(Invitrogen公司);RT-PCR逆转录试剂盒(东洋坊上海生物科技有限公司);PCR试剂盒(Fermentas)、renin/renin receptor引物和β-actin引物(上海英骏);DNA M arker(SABC公司);BCA试剂盒(Pierce);125I血管紧张素Ⅰ放射免疫分析试剂盒(北京科美东雅生物技术有限公司);紫外可见分光光度计(北京莱伯泰科仪器有限公司);BX51显微摄像系统(Olympus);PCR仪(T-personal,Biometra);ZF-258全自动凝胶成像分析系统(上海嘉鹏科技有限公司)。
1.2 糖尿病大鼠模型建立 12只体质量180~220 g的SPF级雄性Wistar大鼠(湖北省预防医学科学院实验动物中心),随机分为正常对照组(N组)6只和模型组(DM组)6只。DM组禁食36 h后在大鼠左下腹腔注射STZ 60 mg/kg。N组腹腔注射等量柠檬酸缓冲液。DM组于72 h后尾静脉取血测定血糖,以血糖大于或等于16.7 mmol/L,确定为糖尿病大鼠。未达标准者,重复上述方法、剂量,至模型成功[5]。实验期间两组均自由饮食。
1.3 标本采集与检测 造模成功后第 4周、8周收集24 h尿液检测尿总蛋白和尿肌酐;8周后乙醚麻醉动物,心脏采血,检测血糖、血肌酐(SCr)、血钠(Na)、血钾(K)。肾脏常规石蜡包埋,切片,用于PAS染色及免疫组化。血糖、肌酐、血钠(Na)、血钾(K)由Beckman自动生化分析仪进行检测。免疫透射比浊法检测尿蛋白(上海太阳生物技术有限公司)。
1.4 肾组织病理学分析 肾组织石蜡切片(2~3μ m)常规脱蜡入水,行PAS染色,普通光镜下观察肾组织病理改变[6]。肾小球损伤程度采用肾小球损伤指数进行半定量分析,评分标准如下:病变范围未见明显改变计0分,病变范围占肾小球面积小于25%计1分,25%~50%之间计2分,50%~75%之间计3分,大于75%计4分。每张切片200倍镜下观察50个正切肾小球,肾小球损伤指数计算公式为:1×N1+2×N2+3×N3+4×N4,式中N1代表1分的损害肾小球个数,…,N4为代表4分的损害肾小球个数。
1.5 免疫组化法检测肾素及肾素受体表达 石蜡切片常规脱蜡入水,柠檬酸缓冲液(pH 6.0)微波修复,3%H2O2阻断,5%BSA封闭,加一抗(兔肾素和肾素受体多克隆抗体,santa cruz公司)4℃过夜,滴加二抗IgG及SP复合物,DAB显色,苏木素复染盐酸分化,脱水,封片。以PBS代替一抗设置阴性对照,以细胞浆棕黄色为阳性表达。每张切片400倍镜下随机摄取20个肾小球,采用Image-pro plus6.0软件分析,以肾小球切面肾素和肾素受体积分光密度(IOD)表示阳性物质的相对含量。
1.6 逆转录多聚酶链反应(RT-PCR)检测肾素/肾素受体mRNA表达 取100 mg肾组织加入T rizol试剂1 mL,参照说明书提取总RNA。2μg RNA在 20μ L逆转录体系中扩增合成cDNA。模板进行肾素及肾素受体PCR扩增反应,用Primer5.0软件设计引物。肾素上游引物:5′GAG TCA TCC CTG TCT TCG 3′;下游引物:5′GTG TCC ACC ACT GCC ATA 3′。产物为256 bp。肾素受体上游引物:5′GGG AAG CGT TAT GGAG 3′;下游引物:5′CGC AAG GTT GTA GGGA 3′。产物为219 bp。用β-actin作为内参,其上游引物为:5′AGC CAT GTA CGT AGC CAT CC 3′;下游引物为:5′TCT CAG CTG TGG TGG TGA AG 3′,产物为 220 bp。PCR反应体系 25μ L:cDNA 1μ L,上下游引物1μ L,2 ×PCR mix 12.5μ L,去核酸水9.5μ L。扩增条件为:预变性94 ℃3 min,变性94℃45 s,退火温度:肾素54.1℃45 s、肾素受体50.1℃45 s,延伸72℃45 s,循环35次,72℃延伸3 min。PCR产物用2%琼脂糖凝胶电泳,ZF-258全自动凝胶成像分析系统进行摄影并采用Gel-pro Analyzer version 4.5行半定量分析。用renin/renin receptor与β-actin比值表示 renin/renin receptor的mRNA表达水平。
1.7 放射免疫法检测肾脏肾素活性 PBS缓冲液中加入1μg/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)蛋白酶抑制剂,100 mg肾组织加1 mL缓冲液,玻璃匀浆器匀浆,匀浆液在4℃下2000 r/min离心20 min,取上清液用放射免疫法检测血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)的含量。肾素活性是以AngⅠ的产生速率来衡量[7]。同时用BCA法检测上清液总蛋白含量,放射免疫法测量值与总蛋白含量值相比得出含量百分比。具体方法参照试剂盒说明书。
1.8 统计学方法 数据采用SPSS13.0统计软件进行统计学处理。数据用表示,两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠生化指标检测 DM组大鼠血糖明显高于N组。DM组4周始尿蛋白较N组升高,8周时DM组24 h尿蛋白高于N组。DM组SCr较N组明显升高,差异有统计学意义(P<0.01),见表1。DM组肾质量/体质量比值与N组相比明显升高,差异有统计学意义(P<0.05)。两组间 SCr和血钠、血钾水平相比较,差异无统计学意义(P>0.05),见表2。
2.2 大鼠肾脏病理改变 DM组PAS染色可见节段性的系膜基质和系膜细胞的增生,DM组肾小球损伤指数显著高于N组,见彩插Ⅰ图1。
2.3 肾脏肾素和肾素受体表达改变 肾素主要分布于肾小管,以肾小球周围近曲小管为主;肾素受体在肾脏表达广泛,在肾小球系膜细胞、足细胞、近端小管、远端小管均有表达,见彩插Ⅰ图2、3。
2.4 肾素及肾素受体mRNA表达 DM组肾素mRNA较N组明显升高,差异有统计学意义(P<0.05),肾素受体 mRNA与N组相比较,差异无统计学意义(P>0.05),见图 4、图5。

表1 各组大鼠血糖、尿蛋白量(24 h)和SCr的比较
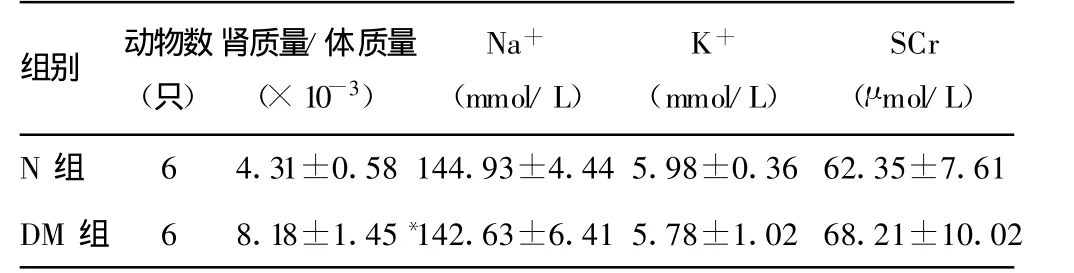
表2 各组大鼠肾肾质量/体质量指数、生化指标的比较

图1 两组肾小球病理变化(PAS×400)
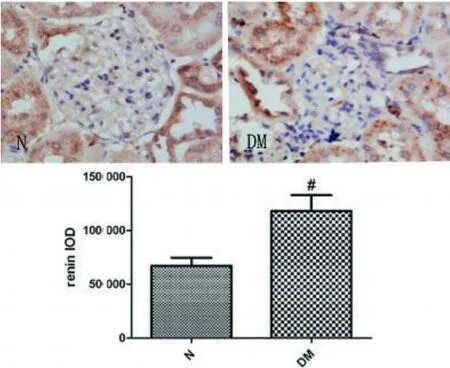
图2 两组肾素表达光密度值(IHC×400)
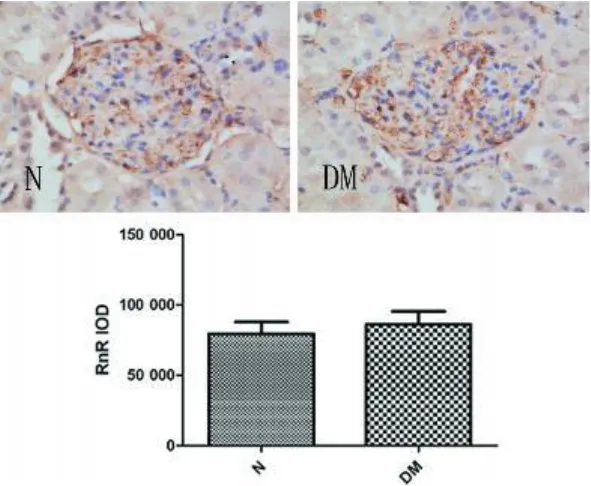
图3 两组肾脏肾素受体表达光密度值(IHC×400)

图4 两组肾脏肾素mRNA表达
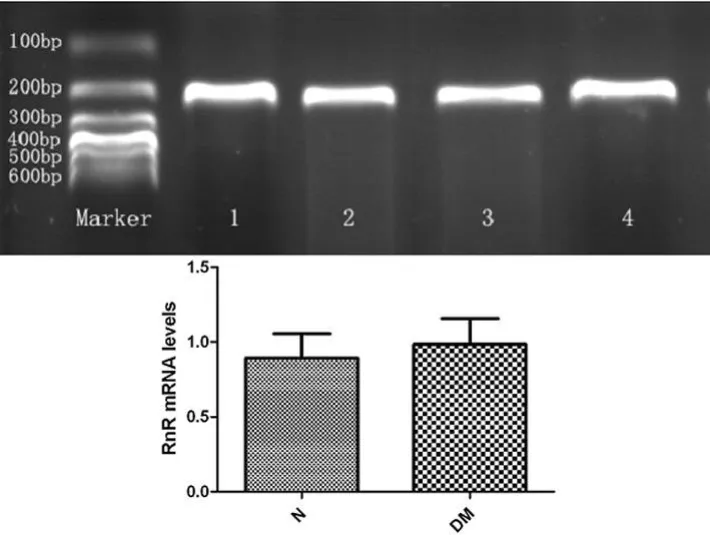
图5 两组肾脏肾素受体(RnR)mRNA表达
2.5 肾脏肾素活性变化 DM组AngⅠ的含量较N组明显升高[(5.14±1.05)×10-6比(2.12±0.58)×10-6,P<0.05]。
3 讨 论
本实验观察到肾素在肾小球周围区域如肾小管高表达,肾小球表达较弱。这可能与肾小球旁器是肾素的主要来源有关。以往认为肾素原不过是肾素的前体,没有生物学作用,而不被重视,肾素受体的发现改变了人们的认识。2002年肾素受体被发现,它能够增加肾素和肾素原的活性并诱导自身活化[8]。肾素/肾素原结合肾素受体激发2条通路:肾素原能够催化血管紧张素产生激活传统的 RAS,同时还能激活细胞内丝裂素激活蛋白激酶(mitogen-activated protein kinases,M APK)通路,上调促纤维化基因表达诱导肾小球硬化[9]。本研究发现肾素受体在肾内广泛表达,肾小球的系膜细胞、足细胞、近端小管、远端小管均有表达。这预示着肾素受体在机体的病理生理过程中发挥重要作用。糖尿病大鼠肾脏病进展与肾组织RAS激活有关,研究肾素受体在该系统的地位具有重要意义。目前,已有阻断肾小球系膜细胞肾素受体可以延缓细胞外基质蓄积的报道[10]。
已有研究表明糖尿病状态下肾内 RAS激活[11],局部RAS激活被认为与糖尿病肾病肾功能恶化有关[12]。本研究发现模型组肾素水平升高,放射免疫法证实糖尿病模型组肾脏肾素活性升高,Takahashi等[13]用实时定量PCR检测17和29周糖尿病大鼠肾脏肾素受体表达变化,发现正常对照与糖尿病模型组肾素受体表达差异无统计学意义,本研究模型组肾素受体表达变化与Takahashi等人研究一致。Schefe等[14]认为肾素表达增加可通过短负反馈机制抑制肾素受体表达,即高肾素水平会抑制肾素受体的表达,防止肾素受体过度激活。Siragy和Huang[15]研究发现糖尿病大鼠肾素受体表达增加,并提出该效应可能是通过增强血管紧张素受体-1(AT1)-NADPH氧化酶活性,上调肾素受体表达。与本研究不同的是Siragy检测的是6周糖尿病大鼠肾素受体表达情况,目前有关肾素受体的调节机制还不清楚,有待探讨。尽管在本研究中两组间肾素受体表达没有差异,但是肾素活性增高可以通过激活RAS途径,造成肾脏损害,在本实验中观察到糖尿病大鼠肾小球系膜细胞增生,系膜区基质沉积,同时产生大量蛋白尿。
综上所述,本研究发现在STZ诱导的糖尿病大鼠模型中,肾素在肾小球周围区域高表达,肾小球表达较弱。肾素受体在肾小球系膜细胞、足细胞、近端小管、远端小管均有表达。糖尿病大鼠肾脏肾素表达增加,可能与肾脏损伤有关,但肾素受体表达无改变,其分子机制有待进一步研究。
[1]Shah IM ,Mackay SP,McKay GA.Therapeutic strategies in the treatment of diabetic nephropathy a translational medicine approach[J].Curr Med Chem,2009,16(8):997.
[2]Sarafidis PA,Bakris GL.Renin-angiotensin blockade and kidney disease[J].Lancet,2008,372(38):511.
[3]申兵冰,赵洪雯,干磊,等.螺内酯联合厄贝沙坦对早期糖尿病肾病患者微量清蛋白尿影响[J].重庆医学,2008,37(8):812.
[4]Zhang Z,Zhang Y ,Ning G,et al.Combination therapy with AT1 blocker and vitamin D analog markedly ameliorates diabetic nephropathy:blockade of compensatory renin increase[J].Proc Natl Acad Sci USA,2008 ,105(41):15896.
[5]陈幼发,熊羽.全反式维甲酸对糖尿病大鼠肾小管-间质纤维化的作用及机制[J].重庆医学,2009,38(15):1902.
[6]刘雷,甘华,王辉,等.活性维生素D3抗炎机制对糖尿病大鼠肾脏保护作用[J].广东医学,2008,29(12):1975.
[7]王晓霞,黄伟,刘金萍,等.依那普利联合伊贝沙坦对慢性心力衰竭左室重构的作用观察[J].海南医学,2005,16(12):47.
[8]Schefe JH ,Unger T,Funke-Kaiser H.PLZF and the(pro)renin receptor[J].J Mol Med ,2008,86(6):623.
[9]Ichihara A ,Sakoda M ,Mito-Kurauchi A ,et al.Activated prorenin as a therapeutic target for diabetic nephropathy[J].Diabetes Res Clin Pract,2008 ,82(Suppl 1):63.
[10]He M ,Zhang L ,Shao Y,et al.Inhibition of renin/prorenin receptor attenuated mesangial cell proliferation and reduced associated fibrotic factor release[J].Eur J Pharmacol,2009 ,606(1):155.
[11]Vidotti DB,Casarini DE,Cristovam PC,et al.High glucose concentration stimulates intracellular renin activity and angiotensin II generation in rat mesangial cells[J].Am J Physiol Renal Physiol,2004,286(2):1039.
[12]Konoshita T ,Wakahara S,Mizuno S,et al.Tissue gene expression of renin-angiotensin system in human type 2 diabetic nephropathy[J].Diabetes Care,2006,29(4):848.
[13]Takahashi H ,Ichihara A,Kaneshiro Y ,et al.Regression of nephropathy developed in diabetes by(Pro)renin receptor blockade[J].J Am Soc Nephrol,2007,18(7):2054.
[14]Schefe JH ,Menk M ,Reinemund J,et al.A novel signal transduction cascade involving direct physical interaction of the renin/prorenin receptor with the transcription factor promyelocytic zinc fingerprotein[J].Circulation Resrarch ,2006 ,99(12):1355.
[15]Siragy HM,Huang J.Renal(pro)renin receptor upregulation in diabetic rats through enhanced angiotensin A T1 receptor and NADPH oxidase activity[J].Exp Physiol,2008,93(5):709.

