灰毡毛忍冬次皂苷乙抑制白血病细胞HL-60的增殖及其机制研究
管福琴,冯 煦,彭 峰,单 宇,王 鸣,赵兴增
江苏省中国科学院植物研究所 (南京中山植物园)江苏省药用植物研究开发中心,南京 210014
灰毡毛忍冬次皂苷乙抑制白血病细胞HL-60的增殖及其机制研究
管福琴,冯 煦*,彭 峰,单 宇,王 鸣,赵兴增
江苏省中国科学院植物研究所 (南京中山植物园)江苏省药用植物研究开发中心,南京 210014
研究了灰毡毛忍冬次皂苷乙(MB)在体外对白血病细胞 HL-60和结肠癌细胞 LOVO增殖的抑制作用,并初步探讨其分子机制。采用MTT法检测MB的增殖抑制作用;利用 RT2ProfilerTMPCR Array芯片实时定量PCR扩增肿瘤发生中 84个关键基因。结果表明MB对两种肿瘤细胞生长均有抑制作用,且对 HL-60效果更好。以 HL-60作为细胞模型,总共发现差异基因 20个,其中上调基因 14个,下调基因 6个,主要作用是阻滞细胞周期和降低细胞侵袭转移。
灰毡毛忍冬次皂苷乙;MTT;基因芯片;细胞周期;侵袭转移;HL-60
灰毡毛忍冬Lonicera m acranthoidesHand.Mazz.为忍冬科忍冬属植物,具有清热解毒、抗菌消炎的功效,在临床上广泛用于痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温热发病等疾病的治疗。中华人民共和国 2005版药典将其作为新增品种收载,与红腺忍冬、华南忍冬一同列入山银花项下。虽然其在西南地区被广泛的应用,但针对它的有效成分和药理作用研究报道零星可见[1-7]。近年来,本课题组利用现代色谱分离技术,以药理作用研究为指导,对灰毡毛忍冬化学成分进行系统研究,从灰毡毛忍冬干燥花蕾的乙醇提取物中分离得到三萜皂苷类成分 19个[8-10],其中包括灰毡毛忍冬次皂苷乙 (MB)。韩国的 Ahn教授曾经报道,从白头翁花Pulsatilla koreanaN.分离出的次皂苷乙,体内体外有一定的抗肿瘤活性,对 Lewis肺癌的抑瘤率达到 50.3%[11]。因此,本课题组在验证了次皂苷乙有一定的抗肿瘤活性的报道的基础上[12],又首次研究其对非实体瘤的作用;同时从分子水平上,应用人肿瘤信号通路发现者芯片对次皂苷乙作用前后非实体瘤细胞 HL-60的基因表达差异进行检测,并对差异基因进行功能分类,研究次皂苷乙的抗肿瘤作用机制。
1 材料与方法
1.1 试剂与仪器
灰毡毛忍冬次皂苷乙 (纯度大于 99%)本实验室生产[8];HL-60细胞购自中科院上海细胞库; IMDM培养基,购自 G IBCO公司;小牛血清和青霉素、链霉素,购自南京生兴公司;焦炭酸二乙酯 (diethyl pyrocarbonate,DEPC)购自 Sigma公司,TR IZOL试剂购自 Invitrogen公司;RNeasy?MinEluteTM纯化试剂盒购自 Qiagen公司;RT2ProfilerTMPCR Array芯片、Supe rArray PCR混合液、以及 RNA逆转录试剂盒均购自美国 SuperArray公司。RT2ProfilerTMPCR Array芯片是专为荧光定量 PCR设计的 96孔微流卡,每孔中预置了 Super Array基因表达试剂,即经过优化设计的用以扩增目的 cDNA片段的上、下游引物和相关的荧光标记探针。肿瘤信号通路发现者 RT2ProfilerTMPCR Array可以同时测定 84个与转化和肿瘤发生密切相关的代表性的六个信号通路有关的关键基因。6孔和 96孔细胞培养板 (Greiner);酶标仪(Tecan);实时定量 PCR仪 (Applied Biosystems)。
1.2 细胞培养
HL-60和LOVO细胞分别常规培养(37℃,5% CO2)于含 10%的小牛血清和青霉素、链霉素各 100 U/mL的 IMDM和DMEM培养基中。LOVO细胞每48 h用胰蛋白酶消化传代。
1.3 MTT法检测MB作用后细胞存活率
取对数生长期 HL-60和 LOVO细胞接种到 96孔板中。用不同浓度的灰毡毛忍冬次皂苷乙 (0~20μM)处理 48 h后进行检测。通过酶标仪测吸光度值(A),测量波长 570 nm,参考波长 690 nm,并计算细胞存活率。

1.4 基因芯片分析差异表达基因
1.4.1 细胞总 RNA提取和纯化
取对数生长期 HL-60细胞以 2×105/mL的浓度接种 6孔板,加人灰毡毛忍冬次皂苷乙MB,使其最终浓度为 10μM(处理组),对照组是正常培养的HL-60细胞。48 h后离心弃掉培养液上清,以磷酸盐缓冲液 (PBS)洗涤 2次。每个样品加入 1 mL TRIZOL试剂完全裂解细胞,氯仿抽提,异丙醇沉淀回收总 RNA,贮存于-70℃。取 Dnase I处理后 RNA,用 RNeasy?MinElute纯化试剂盒纯化回收 RNA,去除RNA中可能存在的DNA污染。以 1%琼脂糖凝胶电泳和紫外分光光度计 A260nm/A280nm鉴定 RNA纯度和浓度。RNA提取和纯化过程使用的移液器头,EP管和去离子水均经 0.1%DEPC处理,容器经高温干烤,以防止 RNase的污染。
1.4.2 荧光定量 RT-PCR
取 1.5μg纯化后总RNA,按试剂盒说明书逆转录合成单链 cDNA模板,存于-20℃备用。按照 RT2ProfilerTMPCR Array说明,在 96孔板中加入 PCR所需各种试剂,置于实时定量 PCR仪 AB I PR IS M7700 system进行 PCR反应。95℃10 min,激活DNA聚合酶;随后按以下参数进行 PCR扩增:95℃15 s、60℃1 min,40个循环。PCR完成后,在AB I PrismSDS 2.1软件上,经自动分析,查看每个基因的扩增情况,导出相应的域值循环数 (cycle at threshold),即Ct值。
1.4.3 数据分析
以看家基因 (HK基因)B2M、HGPRT/HPRT、RPL13A为阳性内对照基因,校正 cDNA模板的细胞拷贝数,计算相对量采用 2-ΔΔCt方法。

1.5 统计学分析
各组实验平行进行,每组实验至少重复 3次。所有数据均以 x ±s表示,采用 t检验进行显著性分析,*P<0.05有显著差异;**P<0.01有极显著差异。
2 结果
2.1 细胞存活率测定
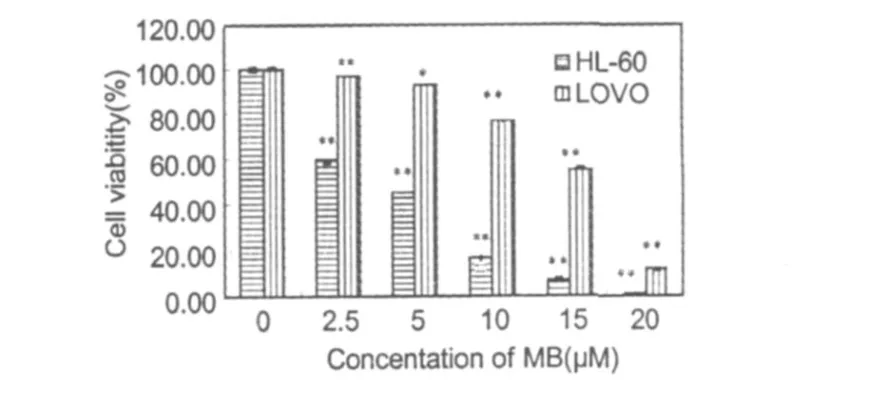
图 1 MB作用 HL-60和LOVO细胞 48 h后细胞的存活率。数值表示为平均值 ±标准差。与对照组比较*P<0.05,**P<0.01。Fig.1 The effects ofMB on the viability of HL-60 and LOVO.Cells were treated with MB for 48 h.Each data value representsmeans±SD(n=3).*P<0.05 vs. control;**P<0.01 vs.control.
根据MTT法测定不同浓度MB处理 48 h后对HL-60和 LOVO细胞存活率的影响,发现随着MB浓度的增加,两种细胞存活率均明显降低,当浓度大于20μM时,细胞几乎完全死亡。而且MB对 HL-60的细胞增殖抑制作用更明显(图 1)。
2.2 基因芯片检测结果
2.2.1 RNA质量控制结果
使用NanoDrop?ND-1000生物分析仪鉴定两份样品的 RNA质量。分别测定 28s/18s峰值的面积比值、A260/A280的 Ratio值、质量浓度,鉴定结果显示样品 RNA均无明显降解,基本符合基因芯片测定的要求。见图 2。
2.2.2 芯片杂交质控结果
基因组DNA控制显示无基因组DNA污染,逆转录控制和阳性 PCR控制显示 RNA纯度很高,完全能满足实时定量 PCR要求。
2.2.3 芯片杂交结果
以 2-ΔΔCt(加药组)/2-ΔΔCt(对照组)值作为评价标准,若大于 2,则基因表达水平上调;若小于-2,则下调。结果显示,3个看家基因在灰毡毛忍冬次皂苷乙MB作用后表达水平无明显变化;在检测的 84个基因中,共筛选出差异表达基因 20个,14个上调,6个下调 (表 1,表 2)。

图2 10μM MB处理HL-60细胞 48 h后样品 RNA的电泳结果图。Fig.2 The agarose gel electrophoresis of RNA for HL-60 cells treated with 10μM MB for 48 h.

表1 MB处理后表达上调的基因Table 1 Upregulated genes afterMB treatment.
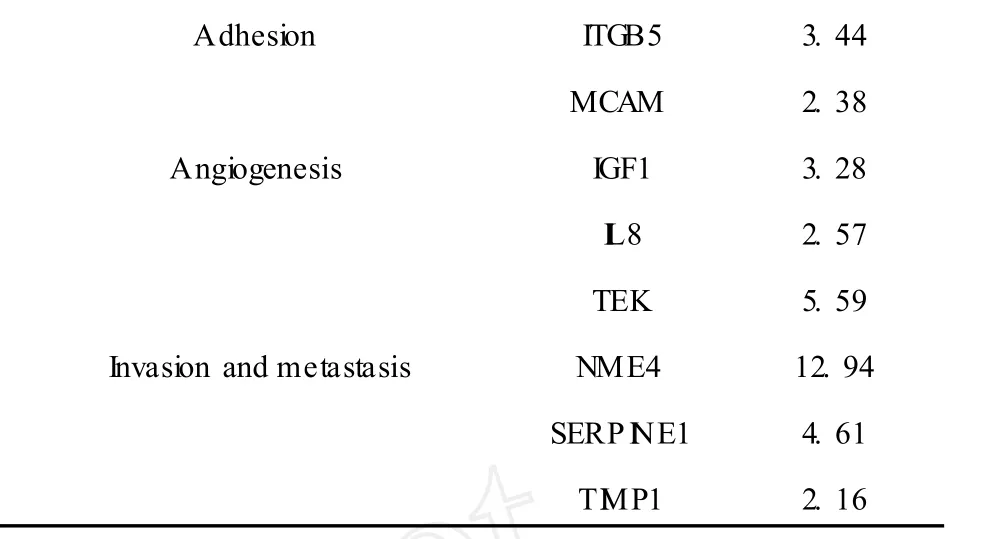
Adhesion ITGB5 3.44 MCAM 2.38 Angiogenesis IGF1 3.28 I L8 2.57 TEK 5.59 Invasion and metastasis NME4 12.94 SERP INE1 4.61 T IMP1 2.16
3 讨论
三萜皂苷在自然界分布很广泛,现代研究表明不同植物来源的多种三萜皂苷具有抗肿瘤活性,如人参、柴胡、合欢、大豆等。灰毡毛忍冬次皂苷乙,一种三萜皂苷,是本课题组从灰毡毛忍冬花蕾中分离得到,前期实验证实其对多种实体肿瘤细胞有增殖抑制作用[11]。本实验结果表明,MB体外不仅能抑制实体肿瘤细胞 LOVO生长,而且对非实体瘤细胞HL-60效果更好。为了进一步研究其分子机制,我们以 HL-60作为细胞模型。
不受控制的细胞增殖是恶性肿瘤的最重要特征。多数恶性肿瘤的发生、发展均与细胞周期调控功能紊乱有关,所以,调节或阻断细胞周期是治疗肿瘤的途径之一。Hsu等[13]在肝癌细胞系 Hep G2中发现柴胡皂苷 d诱导 p53表达、进而上调 p21/ WAF1,导致 G1期阻滞。Mujoo等[14]以合欢皮中三萜皂苷类组分 F035处理人乳腺癌细胞系MDA-MB-453发现有 G1期阻滞。本实验结果表明,AT M(毛细血管扩张性共济失调症突变蛋白)、CCNE1(细胞周期素 E1)基因表达上调,CDC25A(细胞周期调控因子 25A)、CDK2(细胞周期依赖性蛋白激酶 2)表达下调。AT M属于 PIKK(磷脂酰肌醇-3-激酶样激酶)家族,是DNA损伤检查点的主要成员。它们被DNA损伤所激活,通过磷酸化相应的下游蛋白 CHKl(检验点激酶 1)和 CHK2等,调节细胞周期各个检查点,引起细胞周期阻滞,使DNA损伤得以修复。CDC25A,是 Cdc25磷酸酶的一种亚型,对于有效地促进细胞进入 S期是必需的,在细胞周期的后期也具有作用。研究表明,CDC25A在多种癌症中过表达[15],如肝癌、肺癌、乳腺癌、卵巢癌、结肠癌等。因此,CDC25A的下调可控制癌细胞的增殖。CDK2,定位于人 12q13,编码 33 kD的蛋白质,为苏氨酸激酶;CCNE1定位于人 19q12-13,编码 50 kD的蛋白质,含一个与 CDKs相互作用的细胞周期素盒。CCNE与 CDK2结合并使之激活,形成的复合物可促进视网膜母细胞瘤蛋白 pRB的磷酸化,释放转录因子E2F,促进细胞周期 G1/S期进程。CCNE/CDK2复合物的活性受多种因素调节,如 CDC25A表达下调可抑制 CCNE/CDK2的活性[16-18],阻滞 G1/S期。本研究中,灰毡毛忍冬次皂苷乙作用 HL-60细胞,可能导致 DNA损伤,激活 AT M和 CCNE1、降解CDC25A和 CDK2,从而阻滞细胞于 G1/S期。可见,灰毡毛忍冬次皂苷乙和其类似的三萜皂苷类物质(如柴胡皂苷 d,合欢皮中三萜皂苷类组分 F035)引起的细胞周期改变是一致的。
恶性肿瘤治疗的最大障碍就是局部侵袭和远处转移,抑制肿瘤细胞侵袭转移是抗肿瘤治疗的一种重要思路。分析基因芯片筛选得到的差异表达基因,我们发现 T IMP1(组织基质金属蛋白酶抑制因子)上调,PLAUR(尿激酶型纤维蛋白酶原激活剂的受体)下调。T IMP1作为MMPs(基质金属蛋白酶)的抑制因子,其表达上调可以促进细胞外基质(ECM)、尤其是肿瘤周围纤维结缔组织的合成,使肿瘤周围包膜形成,最终局限了肿瘤的生长、侵袭与转移;其次,实验表明 T IMPl能减少血管的形成,作用一种抑制血管生成的因子,可有效抑制肿瘤血管的形成,导致肿瘤细胞坏死,抑制肿瘤细胞转移[19]。PLAUR,又称 uPAR,是 uPA(尿激酶型纤维蛋白酶原激活剂)介导的激活反应的关键,uPA只有与细胞膜表面的 uPAR特异性的结合才能激活纤溶酶,降解肿瘤细胞外基质。灰毡毛忍冬次皂苷乙上调T IMP1表达和下调 PLAUR表达,从而降低细胞的侵袭能力和远端转移能力。
与传统的研究方法相比,通过大规模、高通量的基因芯片技术研究MB对白血病细胞系 HL-60基因表达谱的影响,能同时研究大量基因的表达变化,在研究复杂生命活动时具有巨大的优势。但生命活动的执行者是蛋白质而非mRNA,基因芯片的结果只能代表转录水平的变化,因此具有一定的局限性。本研究发现MB作用 HL-60细胞引起了一些非常重要的信号通路的分子改变,如细胞周期进展中的AT M、CCNE1、CDC25A、CDK2,侵袭转移通路上的T IMP1和 PLAUR。因此推测灰毡毛忍冬次皂苷乙可能通过参与调节这些信号转导通路而发挥其抑瘤作用,但其具体机制还需进一步研究。
总之,通过本实验,我们发现灰毡毛忍冬次皂苷乙体外能降低 HL-60细胞的存活率,且通过 PCR芯片确定了 10μM处理后表达改变的基因,为进一步研究灰毡毛忍冬次皂苷乙抗肿瘤作用和分子机制提供了方向。
1 TongQZ(童巧珍),Zhou RB(周日宝),et al.Analysis of volatile oils ofLonicera macranthoidesin Hunan Province by GC-MS.Chin Tradit PatM ed(中成药),2005,27:52-55.
2 Mao Q(茅青),Cao D(曹东),Jia XS(贾宪生).Studies of the chemical constituentsofLonicera m acranthoidesHand.–Mazz.Acta Phar m Sin(药学学报),1993,23:273-281.
3 ChenM(陈敏),Wu WW(吴威巍),Sheng GQ(沈国强),et al.Chemical constituents ofLonicera macranthoidesHand.–Mazz Part V.Isolation and structures of Macranthoin F and G.Acta Phar m Sin(药学学报),1994,29:617-620.
4 Xu XF(许小方),Li HJ(李会军),Li P(李萍),et al. Chemical constituents in bud ofLonicera m acranthoides.Chin J NatM ed(中国天然药物),2006,4:45-48.
5 Chen J(陈君),Xu XF(许小方),Cai XY(柴兴云),et al. Chemical constituents in the budsofLonicera m acranthoides.Chin J NatM ed(中国天然药物),2006,4:347-351.
6 Lei ZJ(雷志钧),Zhou RB(周日宝),He YS(贺又舜),et al.Compare on antibacterial action be tween large flower-like honeysuckle flower and the certified honeysuckble.Guiding J TCM(中医药导报),2005,11(9):8-9.
7 Li Y M(李永梅),LiL(李莉),BaiC(柏川),et al.Effect of extracts from honeysuckle flower on anti-adenovirus.W est Chin J Phar m Sci(华西药学杂志),2001,16:327-329.
8 Jia XD(贾晓东),Feng X(冯煦),Dong YF(董云发),et al.Saponins from flower buds ofLonicera m acranthoides.Chin Tradit Herb D rugs(中草药),2007,38:1452-1455.
9 Chen Y(陈雨),Feng X(冯煦),Jia XD(贾晓东),et al. Triterpene glycosides from lonicera.Isolation and structural deter mination of seven glycosides from flower buds ofLonicera m acranthoides.Chem Nat Com pd,2008,44:39-43.
10 Chen Y(陈雨),Feng X(冯煦),et al.Chemical constituents in flower buds ofLonicera m acranthoides.Chin Tradit Herb D rugs(中草药),2008,39:823-825.
11 Bang S,Lee J,Song G,et al.Antitumor activity of Pulsatilla koreana saponins and their structure– activity relationship.Chem Phar m Bull,2005,53:1451-1454.
12 Wang J(王佳),Zhao XZ(赵兴增),Qi Q(齐琦),et al. Macranthoside B,a hederagenin saponin extracted from Lonicera macranthoides and its anti-tumor activities in vitro and in vivo.Food Chem Toxicol,2009,47:1716-1721.
13 Hsu YL,Kuo PL,Chiang LC,et al.Involvement of p53,nuclear factorκB and Fas/Fas ligand in induction of apoptosis and cell cycle arrest by saikosaponin d in human hepatoma cell lines.CancerLett,2004,213:213-221.
14 Mujoo K,Haridas V,Hoffmann JJ,et al.Triterpenoid saponins fromAcacia victoriae(Bentham)decrease tumor cell proliferation and induce apoptosis.Cancer Res,2001,61: 5486-5490.
15 Kristjansdottir K,Rudolph J.Cdc25 phosphatases and cancer.Chem B iol,2004,11:1043-1051.
16 Bartek J,Lukas J.Mammalian G1-and S-phase checkpoints in response to DNA damage.Cell B iol,2001,13:738-747.
17 Bartek J,Lukas C,Lukas J.Checking on DNA damage in S phase.M ol Cell B iol,2004,5:792-804.
18 DonzelliM,Draetta GF.Regulating mammalian checkpoints through Cdc25 inactivation.EMBO Rep,2003,4:671-677.
19 BakerAH,EdwardsDR,Murphy G.Metalloproteinase inhibitors:bio1ogical actions and therapeutic opportunities.J Cell Sci,2002,115:3719-3727.
Antiproliferative Effect ofMacranthoside B on Leukem ia cell lines HL-60 and ItsM echanism
GUAN Fu-qin,FENG Xu*,PENG Feng,SHAN Yu,WANGMing,ZHAO Xing-zeng
Institute of Botany,Jiangsu Province and Chinese Academ y of Sciences(Nanjing Botanical Garden,M em. Sun Yat-Sen),Jiangsu Center for Research&Developm ent of M edicinal Plants,Nanjing 210014,China
The cytotoxic effects and the molecularmechanism ofMacranthoside B(MB)were investigated in this study. The cytotoxic effects ofMB forLOVO and HL-60 cellswere detected byMTT assay.Using RT2ProfilerTMPCR Array,84 cancer-related geneswere evaluated by a high-throughput quantitative real-time RT-PCR with orwithoutMB treatment. Cell viability assay showed thatMB inhibited cell growth of two cancer cell lines,especially in human acute promyelocytic leukemia HL-60 cells.As shown in microarray,a totalof 20 differential geneswere found,14 ofwhich were upregulated and 6 were down-regulated.Their biologic functions demonstrate thatMB may exhibit anti-tumor activity against HL-60 cells by arresting cell cycle and reducing cellmetastasis.
Macranthoside B;MTT;PCR array;cell cycle;cell invasion and metastasis;HL-60 cells
R285.5;R733.7;Q946.83
A
1001-6880(2010)05-0765-05
2009-09-28 接受日期:2009-12-17
江苏省自然科学基金(BK2008353);江苏省药用植物研究开发中心开放基金(2008001)
*通讯作者 Tel:86-25-84347158;E-mail:fengxu@mail.cnbg.net

