雨生红球藻培养过程中色素动态变化与光合生理特性研究
王 群,桑 敏,李爱芬,张成武
暨南大学水生生物研究中心,广州 510632
雨生红球藻培养过程中色素动态变化与光合生理特性研究
王 群,桑 敏,李爱芬*,张成武
暨南大学水生生物研究中心,广州 510632
以雨生红球藻Haem atococcus pluvialisCG-06为实验材料,分析测定在正常培养周期内藻细胞主要色素的变化动态、光合生理特性,以及培养基中硝态氮的含量。结果表明,雨生红球藻在绿色细胞阶段的主要色素包括:叶绿素、叶黄素、β-胡萝卜素,培养至红色细胞阶段增加了角黄素、海胆酮、虾青素单酯及双酯等次生类胡萝卜素。硝态氮浓度在培养初期下降迅速,第 3 d降至 4.875 mg/L,下降了 85.3%,至第 7 d下降为 0.169 mg/ L。雨生红球藻培养至第 7 d时,细胞中开始检测出虾青素,含量为 0.159 mg/g,此时虾青素合成速度较快,至第11 d虾青素含量上升为 1.68 mg/g,在虾青素合成初期β-胡萝卜素的含量下降。藻细胞的光合速率、呼吸速率和NPQ在培养前期比较稳定,第 7 d细胞光合速率开始下降,而呼吸速率和NPQ则上升,在整个培养周期中,藻细胞的 Fv/Fm变化不明显。
雨生红球藻;虾青素;类胡萝卜素;氮素;光合特性
虾青素,一种次生类胡萝卜素,具有很强的着色及抗氧化作用,可广泛应用于食品、保健品、化妆品及养殖业[1],是一种具有高附加值和开发潜力的生物活性物质。单细胞淡水绿藻雨生红球藻 (Haem atococcus pluvialis)在生活史中的红色细胞阶段能大量积累虾青素,研究报道虾青素含量可达藻体干重的 2%~5%[2],是理想的天然虾青素来源。
目前,利用雨生红球藻生产虾青素普遍采用两步培养法,即首先在适宜条件下高密度培养雨生红球藻以获得最大生物量,然后通过改变培养条件诱导细胞积累虾青素。因此,关于雨生红球藻培养条件的优化[3-5]和虾青素积累的诱导条件[6,7]等方面做了大量工作。研究证实高光强、高盐和缺氮等胁迫条件有利于雨生红球藻积累虾青素,其中氮素对雨生红球藻的生长和虾青素积累有着显著影响。Lee等的研究表明,雨生红球藻虾青素的积累发生在细胞快速分裂和生长期[8],殷明焱和刘建国研究报道,当培养基中氮浓度降低至 50μmol以下雨生红球藻细胞开始积累虾青素[9]。微藻培养体系中氮素的消耗是一个动态变化过程,随着藻细胞密度的不断提高,培养基中的氮素浓度将随之下降。因此,本文以雨生红球藻 CG-06藻株为研究对象,分析在正常培养条件下雨生红球藻色素组成与含量的变化规律,探讨其色素组成变化与氮素浓度以及藻细胞生理活性之间的关系,初步确定培养液氮素缺乏诱导虾青素的适宜胁迫阈值等。这对于进一步阐明雨生红球藻虾青素积累机制具有一定的理论价值,同时为利用雨生红球藻高效生产虾青素技术提供参考。
1 材料与方法
1.1 藻种
雨生红球藻Haem atococcus pluvialisCG-06,由暨南大学水生生物研究中心藻种室提供。
1.2 培养条件
选用BBM培养基,培养温度为 23±1℃,整个培养周期的光照强度为 80 mol photo·m-2·s-1,采用 6 cm管径的柱状反应器,24 h通气 (VCO2:V空气= 0.5∶95.5)培养。
1.3 实验方法
1.3.1 培养液中硝态氮的测定
采用全自动连续流动化学分析仪 (Bran-Luebbe AutoAnalyzer3,德国)测定硝态氮浓度。
1.3.2 生物量的测定
定期取一定体积藻液抽滤,于 80℃烘至恒重,冷却后称量获得干重。
1.3.3 色素的提取
取 1 mL藻液,3500转离心 5 min,将离心得到的藻泥用二甲基亚砜反复震荡萃取至藻渣无色,用丙酮定容至 10 mL,萃取好的样品经 0.22μm滤膜过滤后用于 HPLC分析。
1.3.4 色素的分析与测定
采用Agilent100检测系统,DAD检测器,Kromasil C18柱 (250×4.6 mm),柱温 25℃,洗脱条件同文献[10],流速为 1 mL/min,狭缝为 1 nm。三种标样的检测波长分别为 663 nm(叶绿素 a)、476 nm(虾青素)、450 nm(β-胡萝卜素)。叶绿素a、β-胡萝卜素、虾青素根据标准样品的出峰时间确定,其它类胡萝卜素的定性参考文献[10],根据出峰时间进行比对。叶绿素a、β-胡萝卜素、虾青素用外标法进行定量,其它类胡萝卜素的定量根据峰面积比进行换算。
1.3.5 呼吸速率和光合速率的测定
用 Clark氧电极 (Hansatech Oxygraph,英国)测定。反应体系的温度由超级恒温水浴 (Grant,英国)控制。光合速率和呼吸速率用μmo lO2mg Chl-1h-1来表示,直接读取溶解氧的变化值 (mg/L),计算藻的放氧速率。公式如下:
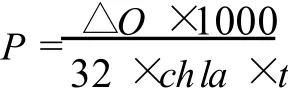
式中:P代表净光合放氧速率;ΔO代表单位时间内氧浓度变化值;chl a代表叶绿素 a的浓度;t为每两次溶解氧浓度读数间的间隔时间。
1.3.6 活体叶绿素荧光的测定
采用 XE-PAM脉冲调制式叶绿素荧光仪(Walz,德国)测定,测量前将藻液暗适应 20 min,叶绿素荧光参数 Fv/Fm和NPQ可通过叶绿素荧光仪直接读出。
2 结果分析
2.1 培养液氮素含量的变化与雨生红球藻的培养特征
在正常条件下随着培养时间的不断延长,培养基中硝态氮浓度的变化如图 1所示。由图中看出,硝态氮的含量随培养时间而逐渐降低,其中在培养初期下降迅速,至第 3 d已降至 4.875 mg/L,比原初培养基降低了 85.3%,从第 3 d至 11 d,氮浓度下降平缓,培养基在第 11 d的硝态氮含量降为 0.0214 mg/L,仅占原初培养基的 0.06%。细胞干重随着硝态氮含量的下降而不断上升,在培养初期藻细胞干重增长迅速,随着氮浓度的下降,细胞干重增长变缓,培养的第 11 d,细胞干重又出现增长,可能是与藻细胞体积增大有关。随着培养液氮素的不断消耗,雨生红球藻的培养特征亦随之变化。前 5 d的藻液颜色为绿色,此时的藻细胞为绿色游动细胞。此后藻液逐渐变为黄褐色,镜检观察大多数细胞仍为游动细胞,但细胞中央有红色色素积累,并随着红色色素面积的增大,藻液逐渐变为深褐色。至 11 d左右藻液变为棕红色,细胞进入红色孢子阶段,最终藻液变为红色。
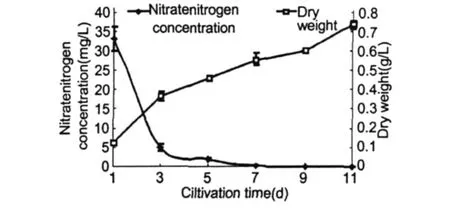
图 1 培养液中硝态氮浓度及H.pluvialisCG-06细胞干重的变化Fig.1 The change of nitrate nitrogen concentration in culture and the dryweight ofH.pluvialisCG-06
2.2 雨生红球藻培养周期内的主要色素组成
图 2是雨生红球藻红绿两种细胞阶段的主要色素组成。根据 HPLC图谱,分析雨生红球藻绿色细胞的主要色素组成有:叶绿素、叶黄素、β-胡萝卜素(图 2a,培养的第 3 d),与绿色细胞相比,红色细胞(图 2b,培养的第 19 d)还增加了角黄素、海胆酮、虾青素单酯及双酯等类胡萝卜素。表 1是两种细胞内的色素与峰号的对应关系(检测波长为 476 nm)。
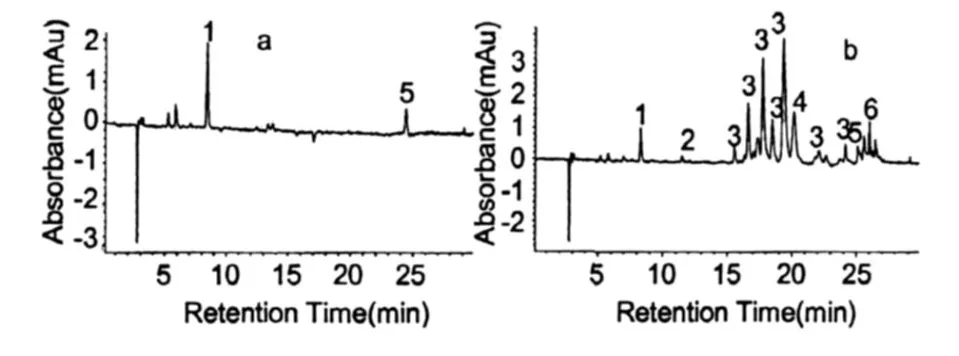
图 2 雨生红球藻 CG-06(a为绿色细胞,b为红色细胞)色素提取液的 HPLC图谱Fig.2 HPLC chromatogram of Pigment Extract fromH.pluvialis.CG-06(a:Green Cell,b:Red Cell)
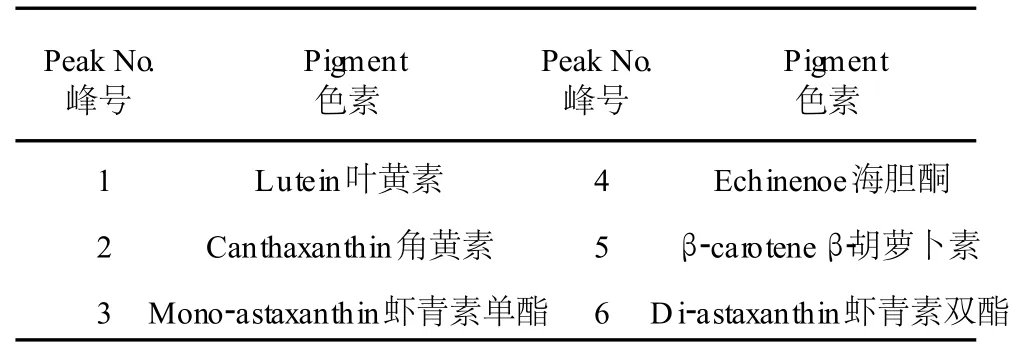
表 1 雨生红球藻色素与峰号对应关系Table 1 The relationship between the pigment ofH.pluvialisCG-06 and the peak number
2.3 雨生红球藻主要色素的动态变化
图 3反应的是雨生红球藻细胞叶绿素 a含量的变化动态。可以看出在培养的前 9 d,叶绿素含量逐渐上升,第 9 d最高为 10.95 mg/g,此时培养基中硝态氮含量为 0.0335 mg/g。此后叶绿素含量开始下降,第 21 d的含量比初始值下降了 21.2%。
类胡萝卜素的变化趋势如图 4所示。β-胡萝卜素和叶黄素的周期变化相似,培养初期它们的含量逐渐上升,第 7 d达到最大,分别为 0.533 mg/g和1.191 mg/g。此时培养基中的硝态氮含量下为0.169 mg/g。从图 4可以看出,藻细胞培养至第 7 d时开始积累次生类胡萝卜素,主要有海胆酮、角黄素和虾青素。虾青素和海胆酮的含量随着培养时间的延长一直升高,第 21 d的含量分别为 1.033 mg/g和 2.547 mg/g。其中虾青素的合成在前 4 d增长迅速,第 11 d时已达到 1.68 mg/g。角黄素含量一直比较稳定,且含量远小于海胆酮和虾青素。
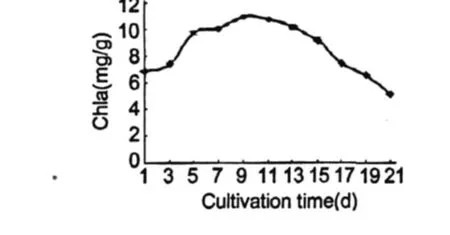
图 3 雨生红球藻 CG-06叶绿素 a含量的变化Fig.3 The change of content for Chla ofH.pluvialisCG-06
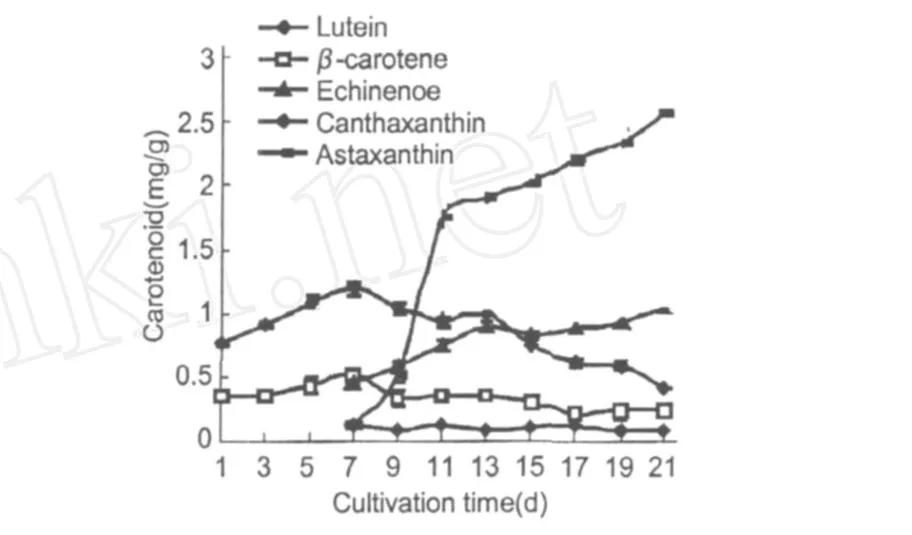
图 4 雨生红球藻CG-06类胡萝卜素含量的变化Fig.4 The change of content for Carotenoid ofH.pluvialisCG-06
2.4 雨生红球藻培养周期内的生理特性
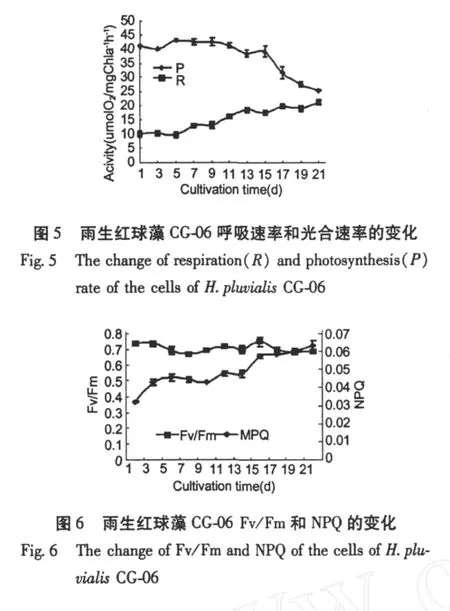
图 5是雨生红球藻在培养周期内光合与呼吸速率的变化。可以看出,藻的光合作用水平在前 11 d比较稳定,第 9 d的光合速率最高,为 42.63μmol O2(mg Chla)-1h-1,随后光合速率逐渐下降,到第 21 d为 25.14μmol O2(mg Chla)-1h-1,下降了 41.1%。藻细胞的呼吸速率在培养的前 5 d变化不明显,第 5 d为 10.19μmolO2(mg Chla)-1h-1,随后细胞呼吸加强,第 21 d的呼吸速率为 21.09μmol O2(mg Chla)-1h-1,是第 5 d的 2.1倍。Fv/Fm是 PSⅡ的最大光化学量子产量,反映 PSⅡ的最大光能转换效率,从图 6中可以看出,整个培养周期中藻细胞活体Fv/Fm比较稳定,一直持续在 0.7左右。NPQ反映的是 PSⅡ天线色素吸收的光能以热的形式耗散掉的部分,NPQ值在前 7 d变化不大,到 9 d时开始上升,13 d以后增长速度变缓 (图 6)。
3 讨论
氮是藻类等植物生长所必须的大量元素,对其生长和发育有着重要的作用。随着藻细胞密度的提高,培养基中的氮浓度消耗加大,最终将导致氮素营养的缺乏。本实验测得培养至第 11 d时培养基中的硝态氮已基本检测不出。
藻类细胞的色素组成及其动态变化与培养基的氮素含量有一定关系(表 2)。氮是组成叶绿素的基本元素,同时氮含量不足会影响蛋白质的合成,从而导致叶绿素含量下降。Boussiba等研究报道,氮源缺乏引起雨生红球藻细胞叶绿素含量下降[11]。从本实验分析得到的数据可以看出,随着培养时间的延长,培养基中的氮素急剧下降,到第 9 d时培养基中硝态氮含量只有 0.0335 mg/L,从此叶绿素含量开始下降。这一结果与 Young等对杜氏盐藻的报道一致[12]。Fabregas等的研究证实,培养液中氮完全消耗时雨生红球藻才有明显地虾青素积累[13],殷明焱和刘建国的研究也表明,当培养液的氮浓度降低至 50μmol以下时才有虾青素的积累[8]。本实验结果证实,当培养液的硝态氮含量降至 0.169 mg/L时,雨生红球藻细胞开始有虾青素等次生类胡萝卜素的合成,这个结果与上述文献报道是一致的。虾青素在开始合成的前 4 d积累速度很快,当培养基中硝酸盐含量降至 0.024 mg/L以后其合成速度减慢,这可能是因为虾青素的积累需要蛋白质的连续合成,而氮浓度已不足以合成虾青素积累所需的蛋白质[14]。次生类胡萝卜素的积累清除细胞内因为缺氮生成的氧自由基,从而保护细胞。由于次生类胡萝卜的积累使初生类胡萝卜素β-胡萝卜素含量的下降,β-胡萝卜素含量的下降又引起叶黄素含量的下降[15]。
细胞的生理特性与培养基中氮素含量也有密切的联系(表 2)。本实验在第 7 d培养基中硝酸盐含量降至 0.169 mg/L,光合速率明显下降,而呼吸速率上升。光合速率下降是因为氮含量降到一定程度,一方面影响了叶绿素的合成,另外,光合作用碳循环中各种酶及电子传递体的合成受到影响。有许多研究表明,缺氮可限制藻细胞光合作用[16]。Hagen等认为,胁迫条件下细胞代谢所需能量增加,呼吸作用显著增强[17,18]。Fv/Fm是 PSⅡ的最大光化学量子产量,反映 PSⅡ的最大光能转换效率,雨生红球藻在整个培养周期中 Fv/Fm值的变化并不明显,这与 Erica在氮限制 3 d后研究杜氏盐藻的结果不尽一致[19]。NPQ在培养后期有所上升,说明PSⅡ天线色素吸收的光能以热的形式耗散部分增加。这个结果与金月梅研究的绿色巴夫藻、小球藻、微绿球藻等 8株微藻的结果一致[20]。
细胞的生理特性与色素积累也有密切联系 (表2),当硝态氮含量下降到一定的程度,光合效率下降,呼吸速率、NPQ上升,使细胞内能量减少,细胞生长减缓,以应对胁迫条件。同时虾青素积累以清除细胞内氧自由基,对细胞有一个被动的保护作用。叶绿素含量的下降和虾青素含量的上升又加剧了光合速率的下降,虾青素的积累也是呼吸速率上升的原因之一。光抑制和呼吸作用增强导致细胞内氧自由基的大量积累,进而导致虾青素的合成及其它生理反应[17,18],细胞呼吸速率、NPQ的上升及光合速率的下降均说明细胞 PSⅡ活性下降[17,21]。雨生红球藻在氮胁迫条件下积累虾青素和细胞 PSⅡ活性下降是对环境的一种适应。
1 Martin G,Mark E.Haem atococcusastaxanthin:applications for human health and nutrition.Trends B iotechnol,2003,21 (5):210-216.
2 Lorenz RT,Cysewski GR.Commercial potential forHaem atococcus pluvialisas a natural source of astaxanthin.Trends B iotechnol,2000,18:160-167.
3 Lu F,Vonshak A,Boussiba S.Effect of temperature and irradiance on growth ofHaematococcus Pluvialis(Chlorophyceae).J Phycol,1994,30:829-833.
4 Harker M,Young AJ.Inhibition of astaxanthin synthesis in the green alge,Haematococcus pluvialis.Eur J Phycol,1995, 30:179-187.
5 Geng YH(耿予欢),Li L(李琳),Wei D(魏东).Growth and production of astaxanthin inChlamydom onas nivaliscultured in variousmedia.Nat Prod Res Dev(天然产物研究与开发),2009,21:641-644.
6 Harker M,Tsavalos AJ,Young AJ.Autotrophic growth and carotenoid production of Haematococcus pluvialis in a 30 liter air-lift photobioreactor.J Fer m ent B ioeng,1996,82:113-118.
7 OrosaM,Franqueira D,Cid A,et al.Analysis and enhancement of astaxanthin accumulation inHaem atococcus pluvialis. B ioresour Technol,2005,96:373-378.
8 Lee YK,Soh CW.Accumulation of astaxanthin inHaem atococcus lacusiris(Chlrophyta).J Phycol,1991,27:575-577.
9 YinMY(殷明焱),Liu JG(刘建国),ZhangJP(张京浦),et al.Review of studies ofHaeam tococcus pluvialisand its astaxanthin.Trans Oceanol Limnol(海洋湖沼通报),1998, 2:53-62.
10 Li FS(李福生).Changes of pigments components ofHaeamtococcus pluvialisin cultivation proccess.GuangZhou:Jinan Univ(暨南大学),PhD.2009.
11 Boussiba S,Wang B,Yuan JP,et al.Changes in pigments profile in the green algaHaeam tococcus pluvialisexposed to environmental stresses.B iotechnol Lett,1999,21:601-604.
12 Young EB,Beardall J.Photosynthetic function inDunaliella tertiolecta(Chlorophyta)during anitrogen starvation and recovery cycle.J Phycol,2003b,39:897-905.
13 Fábregas J,Otero A,Maseda A,et al.Two stage cultures for the production of astaxanthin fromHaem atococcus pluvialis.J B iotechnol,2001,89:65-71.
14 Boussiba S,Fan L,Vonshak A.Enhancement and determination of astaxanthin accumulation in green algaeHaem atococcus pluvialis.M eth Enzym ol,1992,213:386-391.
15 Grunewald K,Hirschberg J,Hagen C.Ketocarotenoid biosynthesis outside of plastids in the unicellular green alagHaematococcus pluvialis.J B iol Chem,2001,276:6023-6029.
16 Liang Y(梁英),Jin Y M(金月梅),Tian CY(田传远). Effects of different nitrogen and phosphorus concentrationson the growth and chlorophyll florescence parameters ofPavloca V iridis.Trans Oceanol Lim nol(海洋湖沼通报),2008,1: 120-126.
17 Hagen C,BrauneW,BjÊrn LO.Functional aspects of secondary carotenoids inHaem atococcus lacustris(volvocales).III. Action as a“sunshade”.J Phycol,1994,30:241-248.
18 Qin S(秦山),Liu GX(刘国祥),Hu ZY(胡郑宇).The accumulation of astaxanthin and the response of photosynthetic activity inScenedesm us obliquus.Acta Hydrobiol Sci(水生生物学报),2009,33:509-515.
19 Erica B,Beardall J.Rapid ammonium-and nitrate-induced perturbations to chla fluorescence in nitrogen-stressedDunaliella tertiolecta(Chlorophyta).J Phycol,2003,39:897-905.
20 Jin Y M(金月梅).Effects of nitrogen and phosphorus limitation on the hlorophyll fluorescence and growth of eight microalga strains.Qingdao:OUC (中国海洋大学 ),PhD. 2008.
21 Boussiba S.Carotenogenesis in the green algaHaem atococcus pluvialis:cellular physiology and stress response.Physiol Plantarum,2000,108:111-117.
The Dynam ic Change of Pigments and Photosynthetic Physiological Characteristics ofHaem atococcus pluvialisCultures
WANGQun,SANGMin,L IAi-fen*,ZHANG Cheng-wu
Institute of Hydrobiology?,Jinan University,Guangzhou 510632,China
The dynamic change of pigments,photosynthetic physiological characteristics and nitrate uptake ofHaem atococcus pluvialisCG-06 were investigated.The main pigmentsof green vegetative cellswere composed of chlorophyll,lutein andβ-carotene,however,except above pigments,astaxanthin、echinenone and canthaxanthin were detected in red immobile cells.H.pluvialisassimilated nitrate quickly during exponential growth stage.The nitrogen concentration declined to 4.875 mg/L in 3rdday and decreased to 0.169 mg/L in the 7thday.The astaxanthin inH.pluvialiscultureswas detected on day 7,its content in red cells increase dramatically,which increased from 0.159 mg/g to 1.68 mg/g from 7thday to 11thday accompanying with the dropdown ofβ-carotene.The results also demonstrated that the photosynthetic rate, respiration rate and NPQ remained stable at initial stage,and then the photosynthetic rate declined,while the respiration rate and NPQ increased on day 7.During the whole culture,the Fv/Fm ofH.pluvialisdid not appear obvious variation.
Haem atococcus pluvialis;astaxanthin;carotenoid;nitrate nitrogen;photosynthetic characteristic
1001-6880(2010)05-0850-05
Q949.21;Q17
A
2010-04-28 接受日期:2010-07-06
珠海市科技局项目(PC20081008)
*通讯作者 Tel:86-20-85224366;E-mail:tiger@jnu.edu.cn

