不同取代度N-马来酰低聚壳聚糖的抗氧化活性的研究
孙 涛,银旭红,甘建红,赖克强,周冬香
上海海洋大学食品学院,上海 201306
不同取代度N-马来酰低聚壳聚糖的抗氧化活性的研究
孙 涛*,银旭红,甘建红,赖克强,周冬香
上海海洋大学食品学院,上海 201306
低聚壳聚糖(COS)酰化得到三种取代度(DS)不同的N-马来酰低聚壳聚糖衍生物NMCOSA、NMCOSB和NMCOSC,其 DS分别为 0.25、0.67和 0.89。对其结构进行红外表征。并考察了 NMCOSA、NMCOSB和NMCOSC对羟基自由基(·OH)、1,1-二苯基苦基苯肼(DPPH)的清除活性以及还原能力。结果表明:N-马来酰衍生物有明显的抗氧化活性,随着取代度的升高,N-马来酰衍生物清除 DPPH的能力以及还原能力增强,即NMCOSC>NMCOSB>NMCOSA;清除·OH的活性顺序为NMCOSB>NMCOSA>NMCOSC,即取代度为0.67的表现出最强的活性。这可能与氨基和羟基的数目、取代基团的性质以及清除自由基的机理不同有关。
低聚壳聚糖;N-马来酰低聚壳聚糖衍生物;取代度;抗氧化
自由基是独立存在的带有未成对电子的原子或基团。当机体内自由基过多时,它可以通过氧化作用攻击生物大分子,产生氧化损伤,从而引起蛋白质损伤、酶失活、膜质过氧化等,导致疾病,加速衰老[1-3]。因此寻找能清除自由基的天然抗氧化剂有着重要的意义。
随着对多酚和黄酮类物质抗氧化作用的深入研究,天然多糖的抗氧化作用也日益受到广泛的关注[4,5]。甲壳素是自然界储量极为丰富的可再生天然多糖,其脱乙酰产物壳聚糖由于分子量大,结构紧密,水溶性差,应用受到限制。而低聚壳聚糖分子量低,水溶性好,理化性质均得以改善[6]。近年来,低聚壳聚糖及其衍生物的抗氧化性日益受到关注[7]。研究表明,低聚壳聚糖醚化衍生物,季铵盐衍生物都有明显的抗氧化活性[8,9]。但是对低聚壳聚糖酰化衍生物的抗氧化活性尚未有研究报道。本文通过对低聚壳聚糖进行酰化,制备了不同取代度的N-马来酰低聚壳聚糖,并研究了其抗氧化活性,为低聚壳聚糖的化学改性进一步研究及其产物在食品及医药领域中的应用奠定了基础。
1 实验部分
1.1 材料与仪器
低聚壳聚糖,购自浙江金壳生物化学有限公司(凝胶色谱测定其分子量为 5000 Da);鲁米诺,DPPH,购自 Sigma公司;其余试剂均为分析纯。
磁力搅拌器;pH计;分光光度计;EQUNOX55傅立叶红外-拉曼光谱仪;流动注射化学发光分析仪(IFF M-D,中国西安制造)。
1.2N-马来酰低聚壳聚糖衍生物的制备及表征
称取 5.0 g低聚壳聚糖加入 100.0 mL蒸馏水搅拌溶解,称取一定量的马来酸酐,用 20.0 mL丙酮溶解,然后缓慢加入反应器,在室温下搅拌反应 15 h,然后用丙酮沉淀,过滤,产物用丙酮反复洗涤,最后在 60℃烘干,得到N-马来酰低聚壳聚糖衍生物[10]。
红外光谱在 EQUNOX55傅立叶红外-拉曼光谱仪上进行,采用 KBr压片法制样,测定波数范围为500~4000 cm-1,分辨率为 0.8 cm-1。
1.3 取代度的测定
准确称量N-马来酰低聚壳聚糖 0.1000 g置500 mL烧杯内,准确加入 0.1038 mol/L HCl标准溶液 20.00 mL溶解样品,再加入去离子水 200 mL稀释、混匀,用 0.4685 mol/L NaOH标准溶液返滴,测定电导率值。做电导率-氢氧化钠体积关系图,添加趋势线,求其回归方程,从而计算N-马来酰低聚壳聚糖的取代度[11]。
1.4 DPPH自由基的清除
在装有 2 mL的浓度为 1×10-4mol/L DPPH无水乙醇溶液的比色管中,加入不同浓度的样品溶液2.0 mL,摇匀,33℃避光静置半小时,在 517 nm处测量吸光度Ai。用去离子水代替样品溶液,得吸光度A0,无水乙醇代替 DPPH,得吸光度 Aj。清除率=[1-(Ai-Aj)/A0]×100%[12]。
1.5 还原能力的测定
还原能力根据文献测定并稍做改进[13]。取2.0 mL不同浓度的样品,加入 pH=6.60的 0.2 mol/L磷酸缓冲液 1%及铁氰化钾溶液各 2.5 mL,混匀,50℃水浴 20 min后迅速冷却,加入 2.5 mL 10%三氯乙酸溶液,混匀后在 3000 r/min下离心 10 min,取上清液 2.0 mL,加入 2.5 mL去离子水和 0.5 mL 0.1%的三氯化铁溶液,静置十分钟后在 700 nm处测定吸光度,高吸光度表明高还原能力。
1.6 羟基自由基·OH的清除
用 pH=7.40的 0.05 mol/L KH2PO4-NaOH缓冲溶液分别配制浓度为 6.4×10-4mol/L的鲁米诺溶液、0.012 mol/L H2O2和 0.8 mg/mL亚铁氰化钾溶液。以缓冲液作为溶剂,配制成系列不同浓度的样品溶液。用流动注射化学发光分析仪依次测定从稀到浓的样品溶液,读出峰面积。清除率 =(A0-Ai)/A0×100%。式中A0为空白溶液峰面积;Ai为样品溶液峰面积。经 SOD,过氧化氢酶及甘露醇检测,该体系产生的自由基为羟基自由基·OH[14]。
2 结果与讨论
2.1 结构表征
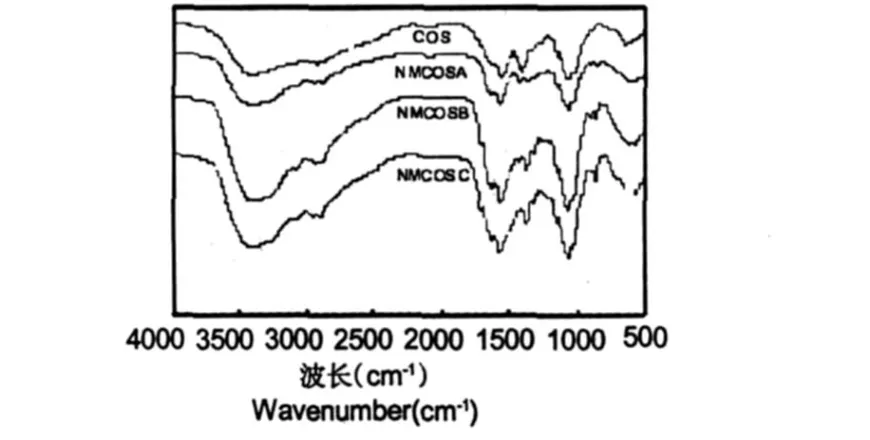
图1 COS、NMCOSA、NMCOSB和NMCOSC的红外光谱Fig.1 FTIR spectra of COS、NMCOSA、NMCOSB and NMCOSC
图 1是 COS以及其N-马来酰衍生物的红外光谱图。四种物质在 3400,1560,1155,1071,1030,894 cm-1附近都有强吸收峰,其中 3400 cm-1附近的吸收峰是壳聚糖分子中的-NH2与-OH的伸缩振动合并峰;1560 cm-1是酰胺Ⅱ的吸收峰;1157 cm-1附近及894 cm-1附近的吸收峰是壳聚糖的β-(1,4)糖苷键的特征吸收峰。1073 cm-1和 1023 cm-1处分别是 C3仲羟基和 C6伯羟基的 C-O的伸缩振动吸收峰[18]。
与低聚壳聚糖相比,N-马来酰低聚壳聚糖有以下几点变化:(1)3400 cm-1附近的吸收峰发生马来酰化后变窄,且取代度越高越向低波数方向位移,这由于低聚壳聚糖中-NH2被马来酸酐取代,-NH2数目减少;(2)1630 cm-1附近出现为共轭烯烃的 C=C振动吸收峰,且取代度越大,吸收峰越强;(3)1707 cm-1附近出现为不饱和羧基因共轭作用的 C=O振动吸收峰;(4)860 cm-1附近为双建中 C-H面外振动吸收峰,在低聚壳聚糖中未见此吸收峰。这些吸收峰证实了衍生物中马来酸酐的存在[10]。而衍生物中 1073 cm-1和 1023 cm-1处的 C3仲羟基和 C6伯羟基的 C-O的伸缩振动吸收峰与低聚壳聚糖相比没有明显变化,说明衍生物是发生-N位马来酰化。用电导滴定法测得NMCOSA、NMCOSB和NMCOSC的取代度分别为 0.25、0.67和 0.89。
2.2 DPPH的清除活性

图2 COS A、NMCOS B和NMCOSC对DPPH自由基的清除Fig.2 Scavenging effect of NMCOSA、NMCOSB and NMCOSC on DPPH radical
DPPH体系是一种广泛用于评价抗氧化剂自由基清除能力的方法。其主要原理为DPPH接受自由基清除剂提供的电子或氢从而形成稳定分子。图 2是N-马来酰衍生物清除 DPPH的曲线图。所有样品对DPPH的清除能力随着浓度的升高而增强。NMCOSA、NMCOSB和NMCOSC对DPPH的半抑制浓度 I C50(清除率达到 50%时所需自由基清除剂的浓度)依次是 0.70、0.64和 0.54 mg/mL。N-马来酰衍生物清除DPPH的活性大小次序依次为NMCOSC>NMCOSB>NMCOSA,即取代度升高,清除DPPH的活性增强。
2.3 还原能力
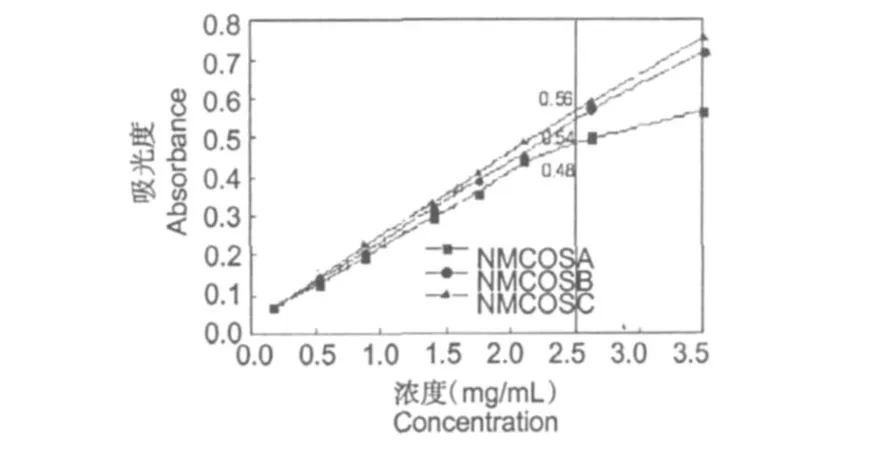
图3 NMCOSA、NMCOSB和NMCOSC的还原能力Fig.3 Reducing power of NMCOSA、NMCOSB and NMCOSC
还原能力和抗氧化活性之间有着密切的关系[15]。抗氧化物质通过提供电子可阻断 Fe2+向Fe3+的转变,表现出一定的还原能力,同样也可以通过提供电子和自由基反应,表现出抗氧化活性。
图 3是N-马来酰低聚壳聚糖衍生物的还原能力曲线图。由图可以看出,随着浓度的升高,所有样品的还原能力增强。在浓度为 2.5 mg/mL时, NMCOSA、NMCOSB和NMCOSC的吸光值依次是: 0.48、0.54和 0.56。N-马来酰低聚壳聚糖衍生物的还原能力随着取代度的升高而增强,即NMCOSC>NMCOSB>NMCOSA。
2.4 羟基的清除活性
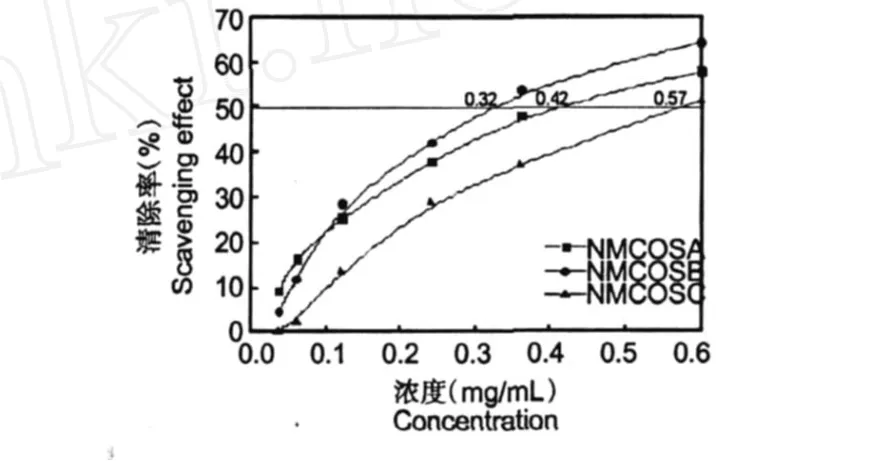
图4 NMCOSA、NMCOSB和NMCOSC对羟基自由基的清除Fig.4 Scavengingeffects of NMCOSA、NMCOSB and NMCOSC on hydroxyl radical
图 4是N-马来酰衍生物对羟基自由基·OH的清除能力曲线图。从图上可以看出,随着样品浓度升高,NMCOSA、NMCOSB和NMCOSC对·OH的清除能力逐渐增强。NMCOSA、NMCOSB和NMCOSC对·OH的半抑制浓度 IC50分别为 0.42、0.32和0.57 mg/mL。他们清除·OH的活性顺序依次是NMCOSB>NMCOSA>NMCOSC。三种N-马来酰低聚壳聚糖衍生物中,取代度为 0.67的 NMCOSB表现出最强的活性。
N-马来酰低聚壳聚糖衍生物的对自由基的清除能力及还原能力均受到下面几个因素的影响:(1)氨基和羟基的数目。在N-马来酰低聚壳聚糖中,部分氨基被马来酸酐取代,与 COS相比,氨基数目减少;使抗氧化活性下降。(2)取代基团的性质。低聚壳聚糖引入马来酰基-COCH2=CH2COO-是吸电子基团,吸电子基团对于自由基的清除起着双重作用。一方面,它能降低 COS分子中电子云密度,从而降低了分子内、分子间的成键几率,释放出更多的氨基和羟基与自由基反应;同时,也会使N-H和OH键更易断裂,使氨基和羟基的活性提高,从而有利于清除自由基。(3)-COCH2=CH2COO-会增加氨基和羟基与自由基反应的空间位阻,从而不利于清除自由基。此外,不同的反应机理也会影响N-马来酰壳聚糖的抗氧化活性。
当取代度从 0.25上升到 0.67,继而上升到0.89时,N-马来酰低聚壳聚糖对DPPH的清除活性依次增强,这可能是由于随着取代度的增大,尽管氨基数目减少,但-COCH2=CH2COO-吸电子作用占主导地位。且DPPH是一种很稳定的自由基,因此受空间位阻的影响不大,故对 DPPH的清除能力随取代度的上升而增强。同样,还原能力主要受-COCH2=CH2COO-吸电子作用的影响,故表现出与 DPPH相同的规律。而·OH是一种非常活波的自由基,它对空间位阻很敏感。在对·OH的清除过程中,当取代度从 0.25升高到 0.67,-COCH2=CH2COO-吸电子作用占主导地位,故对·OH的清除能力增大,即NMCOSB>NMCOSA;当取代度继续升高至0.89时,氨基数目的下降和空间位阻的增加占主导地位,故对 ·OH的清除能力急剧下降,导致NMCOSC<NMCOSA.
3 结论
本实验通过对低聚壳聚糖进行酰化,制备了三种不同取代度的N-马来酰低聚壳聚糖,并考察了其抗氧化活性。结果表明:随着取代度的增加,N-马来酰低聚壳聚糖清除 DPPH的活性以及还原能力增强;而清除羟基的活性的顺序依次为:NMCOSB>NMCOSA>NMCOSC,其中取代度为 0.67的NMCOSB表现出最强的活性。这可能与氨基和羟基的数目、取代基团的性质以及清除不同自由基的机理不同所致。本实验对壳聚糖衍生物的开发为寻找和应用天然抗氧化剂提供了新的思路。
1 Nordberg J,Arner ESJ.Reactive oxygen species,antioxidants,and the mammalian thioredoxin system.Free Radic B iol and M ed,2001,31:1287-1312.
2 Joshua AS,John CB,Mark AL,et al.Free radical-mediated damage to brain in alzheimer’s disease and its transgenic mouse models.Free Radic B iol and M ed,2008,45:219-230.
3 Sanjeev Sh,Sanjay G.ApigeniN-induced prostate cancer cell death is initiated by reactive oxygen species and p53 activation.Free Radic B iol&M ed,2008,44:1833-1845.
4 Chen Y,XieMY,Nie ShP,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanoder ma atrum.Food Chem,2008,107: 231-241.
5 Yuan QF,Zhang ZQ,Fan ZC,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides fromLigusticum chuanxiongHort.Carbohydr Polym,2008,74:822-827.
6 Peng YQ(彭益强),Zhu LP(朱丽萍),Liu X(刘雯),et al.Study on preparation and ant imicrobial activity of chitosan oligomers.Food Sci(食品科学),2007,28:98-101.
7 Yao Q(姚倩),Sun T(孙涛),Xu YX(徐轶霞).Preparation of chitosan oligosaccharide derivatives and their antioxidant activity.Nat Prod Res Dev(天然产物研究与开发),2008, 20:530-533.
8 Sun T,Yao Q,Zhou DX.Antioxidant activity ofN-carboxymethyl chitosan oligosaccharides.B ioorg&M ed Chem Lett, 2008,18:5774-5776.
9 Guo ZY,Xing RG,Liu S,et al.Synthesis and hydroxyl radicals scavenging activity of quaternized carboxymethyl chitosan.Carbohydr Polym,2008,73:173-177.
10 Wang ZY(王周玉),Jiang ZJ(蒋珍菊),Hu XQ(胡星琪). Synthes is of water-solubleN-maleoyl chitosan.Chin J Applied Chem(应用化学),2002,19:1002-1004.
11 Huo XY(霍秀颖),Zhang XH(张小华),Wu Q(吴清).Determination of substitution degree ofN-succinyl-chitosan by conductometric titration.J Beijing Univ Tradit Chin M ed(北京医药大学学报),2007,30:700-702.
12 Lu ZG(陆占国),Guo HZ(郭红转),Feng D(封丹). Study on chemical constituent of coriander leaf essential oil and scavenging capacity against the DPPH radical.Food Fer m Indus(食品与发酵工业),2006,32:24-27.
13 Yen GC,Chen HY.Antioxidant activityof various tea extracts in relation to their antimutagenicity.J Agric Food Chem, 1995,43:27-32.
14 Sun T,XieWM,Xu PX.Superoxide anion scavenging activity of graft chitosan derivatives.Carbohydr Polym,2004,58:379-382.
15 Duh PD,Du PC,Yen GC.Action of methanolic extract of mung bean bulls as inhibitors of lipid peroxidsation and noN-lipid oxidative damage.Food and Chem Tox,1999,37:1055-1061.
Antioxidant Activity ofN-Maleoyl Chitosan O ligosaccharide with D ifferent Substituting Degrees
SUN Tao*,YIN Xu-hong,GAN Jian-hong,LA I Ke-qiang,ZHOU Dong-xiang
College of Food Science,Shanghai Ocean University,Shanghai 201306,China
N-maleoyl chitosan oligosaccharides(NMCOSA,NMCOSB and NMCOSC)with different substituting degrees (DS were 0.25,0.67 and 0.89,respectively)were prepared by chemical modification of chitosan oligosaccharide (COS).The chemical structures of the chitosan oligosaccharides derivatives were characterized by FTIR.Their antioxidant activitieswere evaluated by the scavengingof hydroxyl radical(·OH),1,1-Diphenyl-2-picrylhydrazyl radical2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl(DPPH)and reducing power.The results indicated that theN-maleoyl chitosan oligosaccharides derivatives have obvious antioxidant activity,the scavenging effects on DPPH and the reducing powerwere all increased with the increasing of the substituting degree:the orders of their scavenging effects on·OH wasNMCOSB>NMCOSA>NMCOSC,the NMCOSB showed the best scavenging effects on·OH.That may be related with the number of the amino and hydroxyl groups,the properties of the substituting groups and the different scavenging mechanis ms against free radicals.
chitosan oligosaccharide;N-maleoyl chitosan oligosaccharide;substituting degree;antioxidant
Q946.91;R285;TS202.3
A
1001-6880(2010)05-0890-04
2009-04-30 接受日期:2009-06-17
上海市教育委员会科研项目 (07zz134);上海市教委重点学科建设项目专项基金 (J50704)
*通讯作者 Tel:86-21-61900363;E-mail:taosun@shou.edu.cn

