水溶性壳聚糖与牛血清白蛋白相互作用的研究
冯小强,伏国庆,李小芳,杨 声*
1天水师范学院生化学院;2天水市中医医院化验科,甘肃天水 741001
水溶性壳聚糖与牛血清白蛋白相互作用的研究
冯小强1,伏国庆2,李小芳1,杨 声1*
1天水师范学院生化学院;2天水市中医医院化验科,甘肃天水 741001
采用紫外和荧光光谱研究了水溶性壳聚糖 (CS)与牛血清白蛋白 (BSA)之间的相互作用。结果表明:随 CS浓度的增加,BSA的紫外吸收光谱表现出明显的增色效应和较小的紫移;CS可以猝灭 BSA的内源荧光,其猝灭机理是 CS与BSA形成复合物的静态猝灭。并且测定了在不同温度下,该反应的结合常数 KA分别为6.92×106(298 K),5.01×106(308 K),3.31×106(318 K),CS与 BSA以摩尔比 1∶1结合。同时采用同步荧光光谱法探讨了 CS对BSA构象的影响。
水溶性壳聚糖;牛血清白蛋白;紫外光谱;荧光光谱
壳聚糖(简称CS)是甲壳素脱乙酰基后的产物,具有无毒、生物相溶、可降解、广谱抑菌等特性,在医学、食品营养学、环境保护、轻工业等领域有着极为广泛的应用[1]。血清白蛋白能和许多内源性和外源性物质结合,携带这些物质在体内进行转运、分配和代谢,在体内起着酸度保持、金属离子、氨基酸、脂肪酸、药物等的贮存、运载等重要的作用[2],是基础科学研究中最常用的药物靶蛋白之一[3,4]。有关蛋白质的结构和功能研究,是目前生命科学、化学和医学界共同关注和感兴趣的课题[5],因此研究药物与血清白蛋白的相互作用对阐明药物的作用机制具有重要的理论意义。关于 CS与BSA的相互作用未见文献报道。本文在生理 pH条件下研究 CS与 BSA的相互作用,讨论了 CS对 BSA内源荧光的猝灭机制,经过计算得到了 CS与 BSA之间的结合常数和结合位点数。
1 实验部分
1.1 材料与仪器
壳聚糖 (水溶性 60目济南海德贝海洋生物工程有限公司);0.05 mo1/L的 Tris-HCl缓冲溶液(pH 7.4,含 0.1 mo1/L NaCl以维持溶液离子强度),并以此为溶剂配制 1.0×10-5mo1/L的牛血清白蛋白 (BSA,北京奥博星生物技术责任有限公司)标准溶液。
RF-5301PC型荧光分光光度计 (日本岛津); UV-2450紫外可见分光光度计 (日本岛津);Spectrum One傅立叶红外光谱仪 (Perkin E lmer)。
1.2 实验方法
在 10 mL比色管中依次加入 2.0 mL Tris-HCl缓冲溶液,2.0 mL BSA溶液和一定量的 CS溶液,以Tris-HCl缓冲溶液定容为 10 mL,分别在 25、35、45℃下作用 30 min。设定激发和发射狭缝宽度均为 3 nm,λex=280 nm,在 300~450 nm范围内测定的BSA及 CS作用下 BSA的荧光光谱;固定激发和发射波长间隔Δ λ=60 nm,记录同步荧光光谱;在 220~500 nm范围内测定其紫外吸收光谱。
2 结果与讨论
2.1 BSA与 CS相互作用的紫外光谱
动态猝灭只影响荧光分子的激发态,并不改变荧光物质的吸收光谱;在静态猝灭中,由于猝灭剂与猝灭物质的基态分子发生相互作用,形成基态配合物,从而引起紫外吸收光谱的变化[6]。由图 1可见,随着 CS的加入,BSA在 280 nm处吸收强度逐渐增强,峰位缓慢紫移,在 280 nm处吸收峰位紫移到277 nm,表明 CS与BSA混合后发生了相互作用,生成了一种复合物。BSA在 280 nm处的吸收峰是其肽链上的色氨酸和酪氨酸的苯杂环π-π*跃迁引起的,吸收强度随 CS浓度的增加而增强,说明 CS配位诱导BSA分子发生类似降 pH值所出现的蛋白质肽链伸展现象[7],使包围在 BSA分子内部的色氨酸和酪氨酸残基的芳杂环疏水基团裸露出来,使吸收强度增强,同时疏水基团之间的疏水作用减弱,ππ*跃迁能量增大,使吸收峰发生蓝移。
2.2 BSA与 CS相互作用的红外光谱
在 4000~600 cm-1区域测定了 CS、BSA和BSA/ CS配合物的 I R光谱。配合物与 BSA的 IR光谱相比较,某些吸收峰的振动频率和强度有明显的区别。BSA中νN-H伸缩的 3413 cm-1带,在配合物中变成宽峰;BSA中νC-H伸缩的 2929 cm-1带,在配合物中发生巨大的变化。这表明BSA与 CS作用形成配合物时,端基及残基上的氮原子参与成键且有氢键缔合作用。BSA酰胺Ⅰ带的νCOO-的反对称伸缩振动的 1638 cm-1带,在配合物中变成 1646 cm-1;酰胺Ⅱ带的νCOO-的反对称伸缩振动的 1618 cm-1带,在配合物中移至 1598 cm-1。由此可知,BSA羟基上的氧和酰胺带Ⅰ的氮与 CS有直接的键合作用。
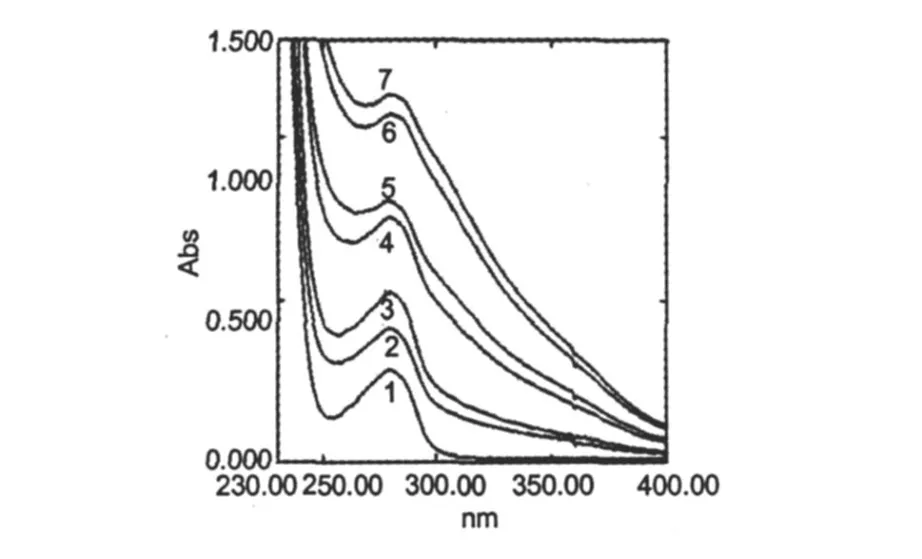
图 1 CS对BSA的紫外吸收光谱的影响Fig.1 Effect of CS on the absorption spectra ofBSA. CCS1~7∶0,0.125,0.25,0.375,0.5,0.625 and 0.75 mg/mL,respectively.

图 2 CS、BSA和BSA/CS配合物的 I R光谱Fig.2 IR spectra of CS,BSA and BSA/CS.
2.3 荧光光谱
2.3.1 荧光猝灭光谱
蛋白质分子中因含有色氨酸 (Trp)、酪氨酸(Tyr)和苯丙氨酸 (Phe)等氨基酸残基而产生内源性荧光,而 CS不发荧光。在大多数情况下,蛋白质的荧光主要来自色氨酸残基的贡献,且含色氨酸残基的天然荧光及变化直接反映了蛋白质中色氨酸残基本身及其周围环境的变化。当某些小分子如药物与蛋白质结合后,导致其荧光强度下降,称为荧光猝灭作用。
固定BSA溶液浓度不变,向其中加入不同浓度的 CS溶液,结果发现:在激发波长为 280 nm时, BSA的最大发射波长为 339 nm;而壳聚糖在λem= 339 nm无荧光产生。随着 CS浓度的增加,BSA内源荧光强度有规律地降低,但发射峰位的位置和峰形变化不大(图 3),这说明 CS对 BSA的荧光有猝灭作用。且随着 CS浓度的增加,荧光的最大发射波长逐渐蓝移,表明色氨酸疏水性增强。
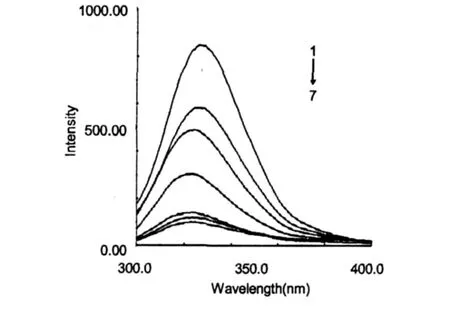
图3 CS对BSA的荧光猝灭图Fig.3 The effect of CS on the fluorescence spectra ofBSA CCS1~7∶0,0.125,0.25,0.375,0.5,0.625 and 0.75 mg/mL,respectively.
2.3.2 荧光猝灭机理
荧光猝灭分为 3种:动态猝灭、静态猝灭和发生非辐射能量转移。动态猝灭只影响荧光分子的激发态,并不改变荧光物质的吸收光谱;在静态猝灭中,由于猝灭剂与猝灭物质的基态分子发生相互作用,形成基态配合物。动态猝灭符合 Stern-Vo lmer方程:
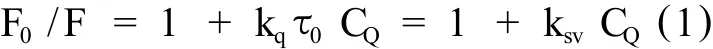
其中 F0为未加猝灭剂时的荧光强度;F为加入猝灭剂后的荧光强度;kq为双分子猝灭过程的速率常数;τ0为没有猝灭剂存在下荧光分子的平均寿命;ksv为 Stern-Vo lmer猝灭常数,是双分子猝灭速率常数与单分子衰变速率常数的比率;CQ为猝灭剂的浓度,mol.l-1。
静态猝灭是猝灭剂和荧光物质分子在基态时生成不发光的缔合物,从而导致荧光物质荧光强度降低的过程.若 KSV为动态猝灭常数,由于生物大分子的荧光寿命τ0约为 10-8s,各类猝灭剂对生物大分子的 Kq最大值为 2.0×1010L·mol-1·s-1[8]。
对不同温度下BSA相对荧光强度 F0/F对猝灭剂 CS的浓度作 Stern-Volmer曲线 (图 4),发现 BSA相对荧光强度 F0/F与 CS浓度呈良好的线性关系。直线斜率为 Stern-Volmer荧光猝灭常数 ksv,结果列于表 1。由表 1结果可知,在不同温度下,CS对BSA的猝灭速率常数远远大于最大扩散控制的速率常数,可以初步判断 CS对BSA的荧光猝灭可能是属于生成复合物的静态猝灭。
此外,动态与静态猝灭也可依据不同温度下的猝灭常数得以区别。对动态猝灭,温度升高将有利于荧光体和荧光猝灭剂分子之间的有效碰撞,并可以促进电子的转移过程,Ksv随温度的升高而增大;若是静态猝灭,温度升高,产物的稳定性降低,静态猝灭常数 Ks减小[9]。在该研究体系中,CS对 BSA的荧光猝灭曲线斜率随温度的升高而降低,即猝灭常数随温度的升高而减小,这进一步表明 CS对BSA的荧光猝灭作用不是由扩散和碰撞引起的动态猝灭,而是生成复合物的静态猝灭[10]。
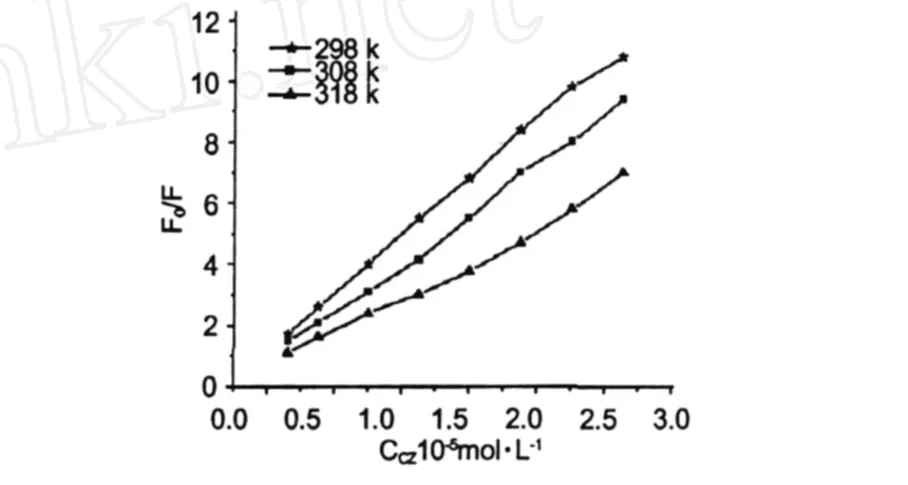
图 4 不同温度下 CS与BSA作用的 Stern-Vo lmer图Fig.4 Stern-Volmer plots of the interaction of CS and BSA at different temperatures

表 1 不同温度下 CS对 BSA荧光猝灭的 Stern-Volmer方程与猝灭常数Table 1 Stern-Volmer equation s and quenching constants for BSA fluorescence quenchingwith chitosan at different temperatures
荧光能量转移可分为辐射能量转移和非辐射能量转移。若发生辐射能量转移,会导致物质的荧光光谱畸形。图 4中BSA的荧光光谱都没有畸变,因此BSA与 CS之间的能量转移不应为辐射能量转移。同时 CS的荧光被敏化 (图 5),在 562 nm左右出现一个荧光发射峰。相应的荧光强度随与 CS结合的BSA的量增加而增加,这说明BSA分子与 CS之间存在能量转移,即 BSA与 CS有配位作用。非辐射能量转移包括分子内能量转移和分子间能量转移。若供能体与受能体结合生成了复合物,则两者之间的能量转移为分子内能量转移,否则为分子间能量转移。由上述分析可知,BSA与 CS之间的能量转移应属于分子内的非辐射能量转移。
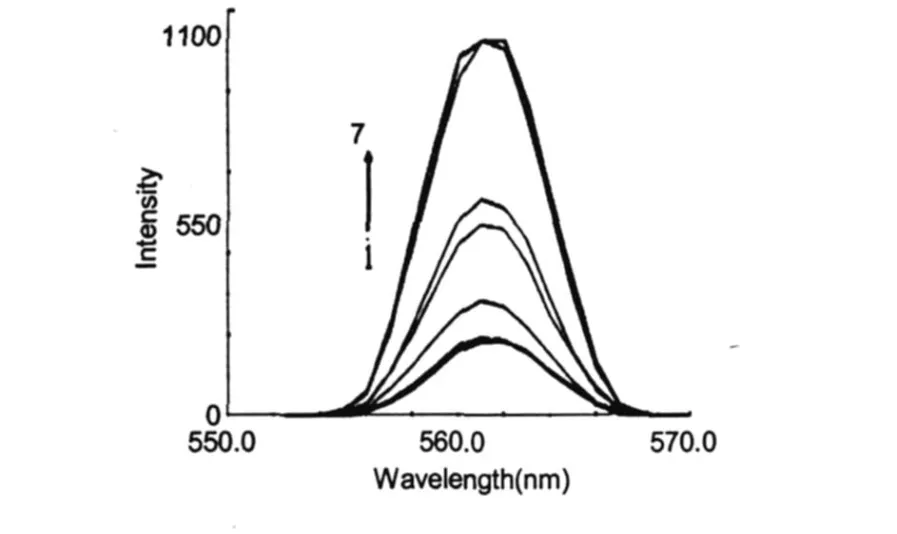
图 5 BSA溶液对CS荧光光谱的影响Fig.5 Emission spectra of CS in the presence and absence of BSA(CCS=0.5 mg/mL)
在 CS对BSA的荧光静态猝灭过程中,假设生物大分子BSA有n个相同且独立的结合位点,可与猝灭剂 CS结合常数为 kA,则BSA与 CS的配合反应可表示为:

当 CS的浓度远远大于 BSA浓度时,荧光体系的荧光强度和 CS的浓度满足以下关系:
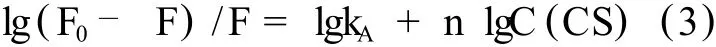
一定浓度的BSA溶液中加入不同浓度的 CS溶液,根据方程 (3),由图 6 lg(F0– F)/F~lgC(CS)曲线拟合得到方程、平衡常数和结合位点数列于表2。可以看出,CS与BSA的结合位点数均等于 1,说明每一个BSA分子与一个 CS分子结合形成配合物,其结合常数随温度升高而减小,这是因为当温度升高,有利于BSA与 CS结合产物的解离,使得平衡常数减小。
2.4 同步荧光光谱
药物分子与蛋白质分子结合,不但直接猝灭了氨基酸残基的荧光,而且还与周围邻近的氨基酸残基相互作用,导致蛋白质构型和构象的改变。这种作用的结果可能阻断氨基酸残基之间能量转移的途径并影响氨酸残基周围的微环境,从而使蛋白质的荧光强度改变且使荧光峰发生位移。
BSA的空间结构由 3个结构域组成,每个结构域由 2个亚结构域以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨基酸残基都包埋在圆筒内部,构成疏水腔[11]。对于蛋白质的同步荧光光谱,Δ λ =60 nm时仅表现出色氨酸残基的荧光[9]。因为氨基酸残基的最大发射波长与其所处环境的疏水性有关,所以由发射波长的改变可判断蛋白质构象的变化。在室温下,固定 BSA浓度,逐渐增大 CS的浓度,记录Δ λ=60 nm时的同步荧光光谱(图 7)。发现随 CS浓度的逐渐增大,色氨酸残基的最大发射波长峰位置都略蓝移且强度逐渐降低,表明 CS的加入使BSA的构象发生变化,色氨酸残基所处环境的亲水性减小,导致 BSA腔内疏水环境增强[12]。这与吸收光谱和荧光发射光谱蓝移相吻合。
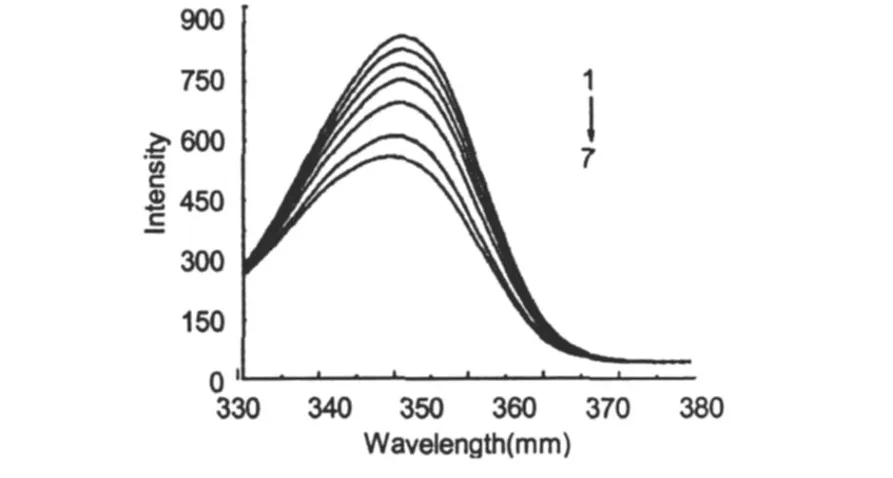
图 7 CS对BSA同步荧光光谱的影响Fig.7 Effects of CS concentrations on synchronous fluorescence spectra ofBSA
3 结论
采用吸收光谱和荧光光谱法研究了 CS与BSA相互作用,确定了 CS对 BSA的猝灭过程为静态猝灭机制。CS可能进入BSA内而与BSA的 Trp残基间发生非辐射能量转移,形成弱的荧光体,阻碍BSA内部 Tyr残基与 Trp残基间的能量转移,猝灭了BSA的内源荧光,导致BSA发生荧光猝灭。在不同温度下CS与BSA的结合常数 KA分别为 6.92×106(298 K),5.01×106(308 K),3.31×106(318 K), CS与BSA以摩尔比 1∶1结合。
1 JumaaM,Furkert FH,MullerBW.A new lipide emulsion for mulation with high ant imicrobial efficacy using chitosan.Eur J Phar m B iophar m,2002,53:115-123.
2 Sugio S,Kashima A,Mochizuki S,et al.Crystai.structure of human serum albumin at 2.5 nm resolution.Protein Eng, 1999,12:439-446.
3 Li Famei,MingxiQiao,Xingjie Guo.Specific deter mination of unbound oxacillin in protein solution with cefoperazone by high-performance frontal analysis with chemiluminescence detection.B iom edical Chromatography,2003,17:53-57.
4 Liu XF(刘雪峰),Xia Y M(夏咏梅),Fang Y(方云),et al.Interaction between bovine serum albumin and berberine chloride extracted from Chinese herbs ofCoptis chinensis Franch.ChemJ Chin Univ(高等学校化学学报),2004,25: 2099-2103.
5 Feng XZ(冯喜增),Jin RX(金瑞样),Qu Y(曲芸),et al, Studies on the ions’effect on the binding interaction between HP and BSA.Chem J Chin Univ(高等学校化学学报),1996,17:866-869.
6 HuangB(黄波),Zou GL(邹国林),Yang T M(杨天鸣). Studies on the interaction between adriamycin and bovine sermn albumin.Acta Chim Sin(化学学报),2002,60:1867-1871.
7 Xuan GS(玄光善),Wu XN(吴效楠),Li YP(李玉平). Fluorescence study on the interaction of acetylsalicylic acid and bovine Serum albumin.Chin J Spectroscopy Laboratory(光谱实验室),2005,22:861-864.
8 Xie MX(谢孟峡),Xu XY(徐晓云),Wang YD(王英典),et al.Spectroscopic investigation of the interaction between 2,3-Dihydro-4,5,7-trihydroxyflavone and human serum albumin;Acta Chim Sin(化学学报),2005,63:2055-2062.
9 Chen GZ(陈国珍),Huang XZ(黄贤智),Zheng ZZ(郑朱梓),et al,Fluorescence Analytical Method(荧光分析方法).Beijing:Science Press,1990.122.
10 Li GZ(李桂芝),Liu Y M(刘永明),Guo XY(虢新运),et al.Study on the Interaction between bovine serum albumins and topotecan hydrochloride or Irinotecan hydrochloride.Acta Chim Sin(化学学报),2006,64:679-685.
11 ZhangBL(张保林),WangWQ(王文清),Yuan RY(袁荣尧),et al.Spectroscopic studies on binding of anthraquinones and flavonoids to bovine serum albumin.Acta Chim Sin(化学学报),1994,52:1213-1217
12 Wei YL,Li JQ,Dong C,et al.CarmenW Investigation of the association behaviors between biliverdin and bovine serum albumin by fluorescence spectroscopyTalanta,2006,70: 377-382
The Interaction of Chitosan with Bovine Serum Album in
FENG Xiao-qiang1,FU Guo-qing2,L IXiao-fang1,YANG Sheng1*
1College of B iology and Chem istry,Tianshui Nor m al Univerity;2Tianshui Traditional ChineseM edical Hospital,Tianshui 741001,China
The interaction between chitosan(CS)and Bovine Serum Albumin(BSA)was studied via ultraviolet-visible absorption and fluorescence spectra.The results showed that the ultraviolet absorption intensity ofBSA increased as the concentration of CS increased.The fluorescence of BSA is quenched regularly by CS,which belonged to static fluorescence quenching.The binding constants(KA)were 6.92×106(298 K),5.01×106(308 K)and 3.31×106(318 K), respectively,and they reacted at a molar ratio of 1∶1.CS on the confor mation ofBSA was analyzed by synchronous fluorescence spectra.
water-solubility chitosan;bovine serum albumin;ultraviolet spectrum;fluorescence spectrum
O636.1
A
1001-6880(2010)05-0894-05
2009-09-04 接受日期:2009-12-08
甘肃天水师范学院物理无机化学重点学科基金资助
*通讯作者 Tel:86-532-88963253;E-mail:ysh@mail.tsnc.edu.cn

