非洲山毛豆种子蛋白质组分分析
李小华,于 新,毕 阳 (.甘肃农业大学食品科学与工程学院,甘肃兰州 730070; 2.仲恺农业工程学院轻工食品学院,广东广州 50225)
非洲山毛豆种子蛋白质组分分析
李小华1,2,于 新2,*,毕 阳1(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070; 2.仲恺农业工程学院轻工食品学院,广东广州 510225)
以山毛豆种子为原料,对其蛋白质进行分级分离,测定了各组分蛋白含量、等电点和溶解度。结果表明,脱脂山毛豆粉的总蛋白含量为 47.11%(m/m)。其中,清蛋白、球蛋白、醇溶蛋白和谷蛋白的相对百分含量分别为 64.04%、8.83%、11.06%和 14.50%,另外含有 1.57%难溶的复合蛋白。清蛋白、球蛋白和醇溶蛋白的等电点为 pH 4.3、pH5.1和pH 4.7,谷蛋白的等电点为 3.5~3.8。它们在等电点附近溶解度较小,偏离等电点之后即 pH>5或 pH<4清蛋白和球蛋白的溶解度增大,而醇溶蛋白和谷蛋白的溶解度增加较小。SDS-PAGE电泳表明,非洲山毛豆种子总蛋白的相对分子量差异较大,在 20.1~97.2kDa及小于 20.1kDa的均有分布,但其谱带分布不明显。清蛋白谱带变化范围为主要有 6条,变化区域集中在 20.1~66.4kDa及小于 20.1kDa的范围。球蛋白在 20.1~66.4kDa大约出现了 10条谱带。醇溶蛋白在 20.1、29.0、44.3kDa分别有3条明显的谱带。谷蛋白在 20.1~97.2kDa大约有 10条以上的谱带,说明非洲山毛豆种子总蛋白及各组分蛋白均有不同的分子组成。
山毛豆种子,蛋白质组成,等电点,溶解性,SDS-PAGE电泳
1 材料与方法
1.1 材料与仪器
非洲山毛豆种子 2008年 1月 20日采自广州市花都区北兴镇山坡(北纬 23°27’,东经 113°26’),通过索氏抽提油脂得到山毛豆粕(粉末)。
电子天平 德国 Sartorial公司;岛津 UV-2550紫外可见分光光度计 岛津苏州工厂;M ini-PROTEAN4电泳仪 美国B IO-RAD公司;TGL-16C型台式离心机 上海安宁科学仪器厂;PHS-25型酸度计 上海伟业仪器厂;85-2型恒温磁力搅拌器上海司乐仪器有限公司;G-9140A型电热恒温干燥箱 广东环凯微生物科技有限公司;数显恒温水浴锅 金坛市金城国胜实验仪器厂;SD-1500喷雾干燥机 上海沃迪科技有限公司;LGJ-12冷冻干燥机北京松源华兴科技发展有限公司;凯氏定氮装置。
1.2 实验方法
1.2.1 双缩脲试剂的配制 将 10mol/L氢氧化钾10mL和 25%酒石酸钾钠溶液 20mL加入到 930mL蒸馏水中,剧烈搅拌,同时慢慢加入 4%硫酸铜溶液40mL,以免生成氢氧化铜沉淀[7]。
1.2.2 蛋白质组分的分级分离 称取一定量的脱脂山毛豆粉,置于烧杯中,按豆粉和水比例为 1∶10(m/v)加入去离子水,在室温下强力搅拌 1h,离心,得到的上清液为清蛋白组分。向烧杯中的残渣中加入 10% (m/m)的NaCl溶液(与上述去离子水等体积),室温下搅拌 1h,离心,得到的上清液为球蛋白组分。向上述盐溶液提取后的残留物中加 75%乙醇(与上述去离子水等体积),用玻棒搅拌,将混合液置于 80℃的水浴中 5min,在此期间不停搅拌。其后取出烧杯,继续搅拌 5min,离心 (4000r/min,10min),收集上清液,即为谷蛋白组分。向上述乙醇溶液提取后的残留物中加入 0.2%的 NaOH溶液 (与上述去离子水等体积),搅拌 15min,离心 (4000r/min,10min),收集上清液,作为谷蛋白待测分析[8]。
1.2.3 山毛豆清蛋白和球蛋白的制备
1.2.3.1 清蛋白制备 清蛋白提取液经喷雾干燥得粉状清蛋白制备物。
1.2.3.2 球蛋白制备 球蛋白提取液经蒸馏水透析72h后,离心收集沉淀,冻干备用。
1.2.3.3 球蛋白和醇溶蛋白的制备 各组分提取液对蒸馏水透析 72h后,离心收集沉淀,冻干备用。
1.2.3.4 谷蛋白组分的制备 谷蛋白提取液用2mol/L HCl调 pH至 4.5,离心收集沉淀,水洗 3次,冻干备用。
1.2.4 蛋白质含量的测定 微量凯氏定氮法[7]。
1.2.5 等电点测定
1.2.5.1 等电点范围的预实验 称取 5.00g组分蛋白溶于 500mL去离子水,得到 1.00%样品提取液,分别取 1%样品提取液 10mL于 5支标有管号和管种的20mL离心管中,分别依次调 pH为 2、3、4、5、6,然后在离心机上以 3000r/min离心 15min后,小心倒去清液,烘干一定程度,称其沉淀质量。
1.2.5.2 双缩脲法测等电点 将各组分蛋白分别用去离子水配制成 0.5%、1%和 2%的样品液。分别取样品液 10mL于 50mL比色管中,分别依次调 pH为等电点周围 7~9个点,然后在离心机上以 3000r/min离心 15min后,小心收集上清液,用双缩脲法测吸光度值。分别依次取 10mL上清液于对应号数的 25mL容量瓶,加 0.5mL四氯化碳,用双缩脲试剂定容至刻度。静置 1h后,取上清液 12mL离心,取离心分离后透明液于比色皿中,在 560nm下测定吸光值[9]。
1.2.6 溶解性实验[5]样品的溶解性用氮溶解指数(NSI)来评价。分别用去离子水配制 1%(m/v)蛋白样品溶液 8mL,用 0.05mol/L HCl或 0.05mol/L NaOH溶液调 pH至 3.0、4.0、5.0、6.0、7.0、8.0、9.0,磁力搅拌120min,离心 15min,采用凯氏定氮法测定上清液中的蛋白含量。
1.2.7 SDS-PAGE电泳分析 参照 Lemion的方法[10]进行电泳。聚丙烯酰胺凝胶电泳分离胶浓度为10.0%,浓缩胶浓度 4%,每管点样 20μL,在 15mA恒压电泳 45min,用考马斯亮蓝染色 30min,用脱色液脱色至背景无色,拍照保留。标准分子量购于宝生物工程有限公司。
2 结果与分析
2.1 山毛豆蛋白质组分测定
根据蛋白质在不同溶剂中溶解度不同的性质,可以将山毛豆种子蛋白质分为清蛋白、球蛋白、醇溶蛋白、谷蛋白等。测定不同蛋白组分,了解山毛豆种子蛋白的基本组成,表 1表示山毛豆种子各组分蛋白的含量。
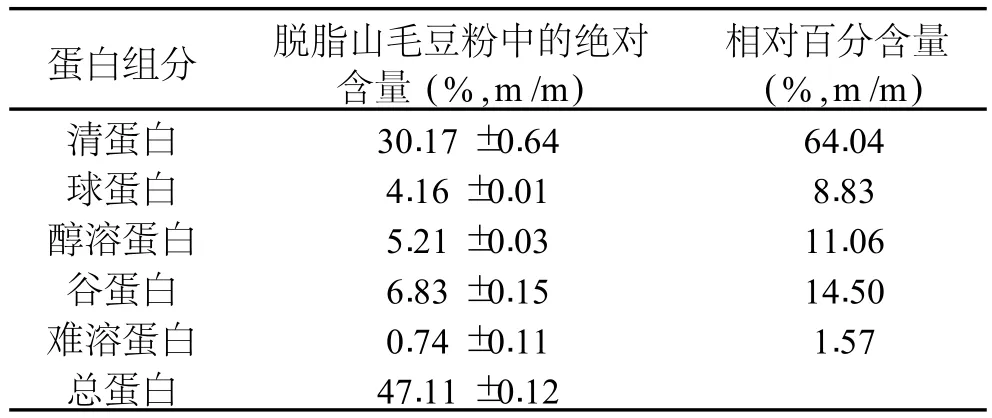
表 1 各组分蛋白在山毛豆种子中的分布
表 1表明,山毛豆种子的清蛋白含量最高,占山毛豆种子总蛋白的 64.04%,为组成山毛豆种子蛋白的主要成分。另外含有球蛋白、醇溶蛋白和谷蛋白,分别占总蛋白的 8.83%,11.06%和 14.50%左右,以及少量难溶的复合蛋白(1.57%)。
2.2 等电点测定结果
2.2.1 等电点预实验结果 沉淀结果表明,山毛豆清蛋白的最佳沉淀结果应在 pH4~5,球蛋白最佳沉淀结果在 pH5左右。醇溶蛋白较优沉淀结果在 pH5左右,谷蛋白较优沉淀结果为 pH3~4左右。
2.2.2 双缩脲法测定 为了较准确地测出山毛豆组分蛋白的等电点,根据植物性蛋白质等电点大部分呈酸性特点,以 2.2.1的结果为依据,分别设定不同pH间隔,利用双缩脲法准确测定其等电点,结果如图1~图 4所示。
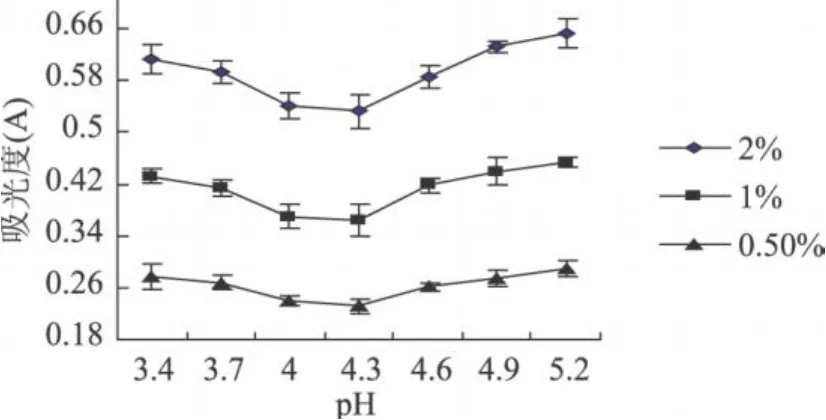
图1 清蛋白在不同 pH下离心液吸光度
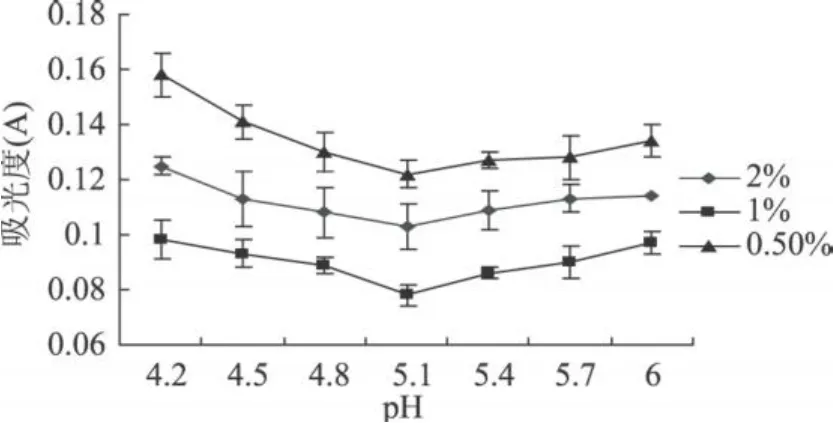
图2 球蛋白在不同 pH下离心液吸光度
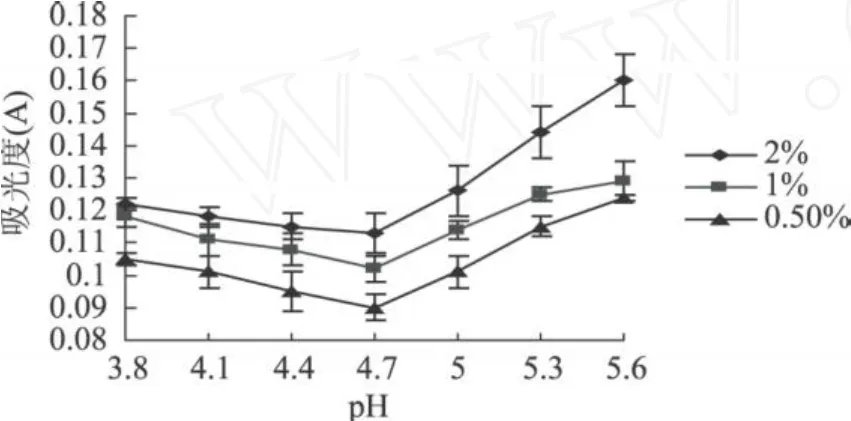
图 3 醇溶蛋白在不同pH下离心液吸光度
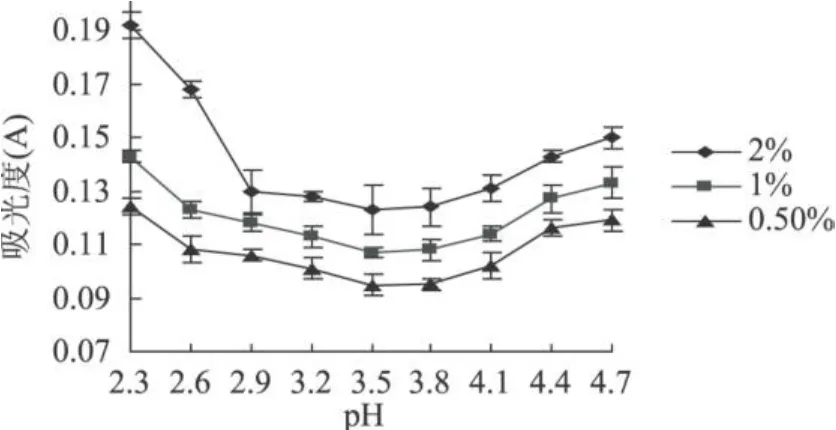
图4 谷蛋白在不同 pH下离心液吸光度
本实验得到的山毛豆清蛋白、球蛋白、醇溶蛋白、谷蛋白离心液的吸光度随 pH变化的趋势明显不同;而同种蛋白的不同浓度的的吸光度随 pH变化的趋势相同,而且随着蛋白浓度的增加,离心液的吸光度明显增大。清蛋白离心液的吸光度变化基本呈“U”型,球蛋白的变化呈“V”型,醇溶蛋白离心液的吸光度变化基本呈“√”型,谷蛋白离心液的吸光度变化基本呈反的“√”型。由图 1可知,清蛋白离心液吸光值最小在pH4.3,这可能是由于在此pH下,蛋白质多肽键之间的静电推斥作用受到抑制,以及蛋白质间的相互作用超过了蛋白质与溶剂间的相互作用而引起了聚集反应,破坏了蛋白质的空间结构,使蛋白质溶解度最低[14]。利用双缩脲法所测吸光值与蛋白质量成正比的关系,可知在 pH为 4.3时离心液中蛋白质含量最少,即在 pH4.3时清蛋白沉淀量最大,因此可确定山毛豆清蛋白等电点为 pH4.3。同理可确定山毛豆球蛋白、醇溶蛋白等电点分别为pH5.1,pH4.7,谷蛋白的等电点为 3.5~3.8。
2.3 溶解性
植物蛋白的溶解性是蛋白质最重要的一个功能性质,蛋白质的其它功能性质如乳化性、起泡性、凝胶性等都与其溶解性有关。蛋白质的溶解性受加工条件的影响很大,特别是 pH,在不同的 pH下,其溶解度有较大的差异。实验表明,山毛豆种子的清蛋白和球蛋白分别在 pH4和 pH5附近溶解度均较小, pH>4时,清蛋白的溶解度随 pH的增大而增大,在当pH4~5之间时,球蛋白的溶解度较小,pH<4或 >5时,球蛋白的溶解都比较大,其中清蛋白的 pH-NSI曲线形状跟大豆蛋白相类似[11]。在实验 pH范围内,醇溶蛋白和谷蛋白其溶解度都比较小 (NSI<30%),其中醇溶蛋白在 pH5时溶解度最小,而谷蛋白在pH4溶解度较小 (图 5),这和 2.2测得的组分蛋白的等电点是一致的,即山毛豆组分蛋白的溶解度在等电点附近最低,离开等电点之后随着碱量的增加(增大 pH)和酸量的增加 (减小 pH)其溶解度增强。原因是在等电点附近蛋白质多肽链之间的静电推斥作用受到抑制,以及蛋白质间的相互作用超过蛋白质与溶剂间的相互作用引起聚集反应,从而破坏了蛋白质的空间结构。蛋白质分子电荷密度及疏水性是影响蛋白质溶解度的主要因素,较高的电荷密度和较低的疏水性才能有较高的溶解度[12]。
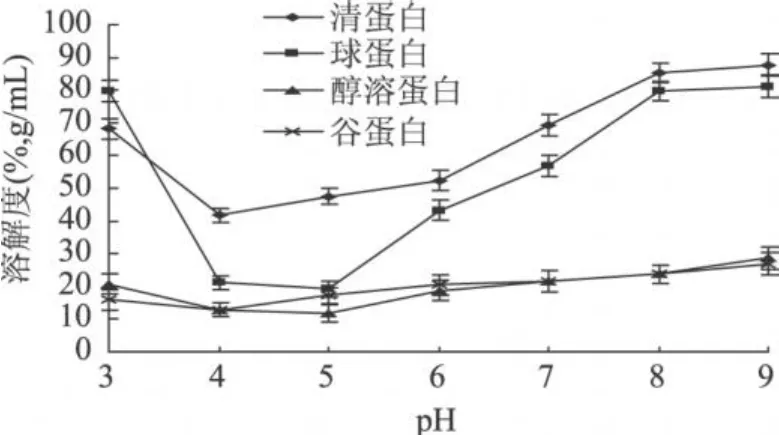
图5 山毛豆中各组分蛋白的pH-NSI曲线
2.4 SDS-PAGE电泳
由图 6可知,非洲山毛豆种子总蛋白的相对分子量差异较大,在 20.1~97.2kDa及小于20.1kDa的均有分布,但其谱带分布不明显,说明其总蛋白的组成相对较复杂。清蛋白谱带变化范围为主要有 6条,变化区域集中在 20.1~66.4kDa及小于 20.1kDa的范围,说明山毛豆清蛋白主要由低分子量亚基构成。球蛋白在 20.1~66.4kDa大约出现了 10条谱带,说明了球蛋白组成的不均一性。醇溶蛋白在 20.1、29.0、44.3kDa分别有 3条明显的谱带,其中 29.0kDa的谱带颜色最深,说明醇溶蛋白中此分子量的亚基含量最高,和前两种蛋白比较,其组成相对较简单,而且其相对分子量较小。谷蛋白在 20.1~97.2kDa大约有10条以上的谱带,其组成也相对比较复杂。在山毛豆种子的分离提取中,采用连续提取法。由于清蛋白水溶性蛋白且含量高,所以采用直接提取法或提取清蛋白后依次提取其他蛋白。则各组分的谱带都具有相似性。实验发现,经 3~4次重复提取后球蛋白已不含清蛋白谱带。

图 6 山毛豆总蛋白及各蛋白组分的 SDS-PAGE图谱注:1-标准蛋白,2-总蛋白,3-清蛋白, 4-球蛋白,5-醇溶蛋白,6-谷蛋白
3 结论
非洲山毛豆种子蛋白质主要由清蛋白、球蛋白、醇溶蛋白和谷蛋白等组成。其中,清蛋白含量最高,占总蛋白的 64.04%(m/m),球蛋白、醇溶蛋白和谷蛋白的相对百分含量分别为 8.83%(m/m),11.06% (m/m)和 14.50%(m/m)。另外,有少量难溶的复合蛋白,其相对含量为 1.57%(m/m)。清蛋白、球蛋白和醇溶蛋白的等电点为 4.3、5.1和 4.7,谷蛋白的等电点为 3.5~3.8。清蛋白、球蛋白、醇溶蛋白和谷蛋白分别在其等电点附近溶解度最小,偏离等电点时清蛋白和球蛋白的溶解度较大,而醇溶蛋白和谷蛋白的溶解度较小。SDS-PAGE电泳表明了非洲山毛豆种子蛋白及各组分蛋白具有不同的分子组成。非洲山毛豆种子总蛋白的相对分子量差异较大,在20.1~97.2kDa及小于 20.1kDa的均有分布,但其谱带分布不明显。清蛋白谱带变化范围为主要有 6条,变化区域集中在 20.1~66.4kDa及小于 20.1kDa的范围。球蛋白在 20.1~66.4kDa大约出现了 10条谱带。醇溶蛋白在 20.1、29.0、44.3kDa分别有 3条明显的谱带。谷蛋白在 20.1~97.2kDa大约有 10条以上的谱带。
和大豆 (蛋白含量 38%)[13]、花生 (蛋白含量22%~26%)[13]等蛋白含量较高的蛋白质资源比较,山毛豆的蛋白含量较高(38.73%)。非洲山毛豆主要由清蛋白、球蛋白、醇溶蛋白和谷蛋白等组成,清蛋白是其主要成分。而大豆主要由清蛋白 (5%)和球蛋白(95%)组成。其中球蛋白是主要成分。花生蛋白大约 10%是水溶性的,其余 90%为花生球蛋白(63%)和伴花生球蛋白 (33%)[13]。和花生、大豆相比较,非洲山毛豆的水溶性蛋白含量最高。而蛋白质的溶解度影响其功能性质,其中最受影响是增稠、起泡、乳化和胶凝作用,不溶性蛋白质在食品中的应用是非常有限的[14],所以非洲山毛豆种子蛋白质在食品中有广泛应用的潜质。
[1]邓辅唐,喻正富,杨自全,等 .山毛豆、木豆、猪屎豆在高速公路边坡生态恢复工程中的应用 [J].中国水土保持,2006 (4):21-24.
[2]Gachene CKK,Wortmann CS.Green manure/cover crop technology in eastern and central uganda:development and dissemination[M].SpringerNetherlands,2004:219-236.
[3]Kwesiga F,Akinnifesi FK,Mafongoya P L,et al.Agroforestry research and development in southern Africa during the 1990s:Review and challenges ahead[J].Agroforestry Systems,2003,59 (3):173-186.
[4]李小华,李永胜,曾晓房,等 .山毛豆资源的研究与利用[J].仲恺农业技术学院学报,2008,21(4):31-35.
[5]MANSON A.The action of certain assamese plant as larvicides [J].Journal of theMalaria Institute of India,1939,2(1):85-93.
[6]于新,严卓勤,李小华,等 .非洲山毛豆种子的物理特征、成分分析与油脂组成的研究 [J].中山大学学报,2009(1):22-26.
[7]大连轻工业学院,华南理工大学,郑州轻工业学院,等 .食品分析[M].北京:中国轻工业出版社,2006:224-225.
[8]刘拥海,俞乐,肖迪 .荞麦种子蛋白质组分分析[J].种子, 2006,25(12):31-33.
[9]施树 .两种胡麻饼粕提取蛋白质等电点测定[J].粮食与油脂,2007(8):25-26.
[10]郭尧君 .蛋白质电泳技术 [M].北京:科学出版社,2005:85-l00.
[11]李安林,熊双丽,韩珍琼 .豇豆籽蛋白的功能性质分析[J].安徽农业科学,2008,36(2):741-742.
[12]Pearce KN,Kinsella JE.Emulsifying properties of proteins:evaluation of a turbid imetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[13]管斌,林洪,王广策,等 .食品蛋白质化学[M].北京:化学工业出版社,2005.
[14]王璋,许时婴,江波,等译 .食品化学[M].北京:中国轻工业出版社,2003.
Analysis of contents of protein groups in Tephrosia vogeliiHook f.seeds
L I Xiao-hua1,2,YU Xin2,*,BIYang1
(1.College of Food Science and Engineering,Gansu AgriculturalUniversity,Lanzhou 730070,China; 2.College ofLight Industry and Food Science,ZhongkaiUniversity ofAgriculture and Engineering,Guangzhou 510225,China)
Taking Tep hros ia voge liiHook f.seeds as raw m a te ria ls,p rote ins from seeds we re g raded and sep a ra ted, the content and isoe lec tric p oint and solub ility of seeds p rote in g roup s we re de te rm ined.The results showed tha t tota l p rote in content of defa tted seeds p owde rwas47.11%(m/m),the re la tive p e rcentage content of a lbum in was 64.04%,tha t of g lobulin,g liad in,and g lute lin was8.83%,11.06% and14.50%,resp ec tive ly,defa tted Tep hros ia voge liiHook f.seeds p owde r a lso conta ined a sm a ll quantity of comp ound p rote in(1.57%)which was d ifficult to d issolve.In add ition,isoe lec tric p oint of each seed p rote in g roup was d iffe rent,isoe lec tric p oint of a lbum in was pH 4.3,g lobulin pH5.1,g liad in pH4.7,g lute lin pH3.5~3.8,and the ir the solub ility was the wors t a t nea r isoe lec tric p oint. Solub ility of a lbum in and g lobulin we re be tte r but tha t of g liad in and g lute lin we re worse a t pH>5or pH<4. SDS-PAGE showed tha t the re was g rea t d iffe rence in the re la tive m olecula rwe ight of tota lp rote in from Tep hros ia voge liiHook f.seeds,its sp ec trum band was not d is tinc t but d is tributed in20.1~97.2kDa and less than20.1kDa.S ix sp ec trum bands of a lbum in concentra ted a t the range of20.1~66.4kDa and less than20.1kDa.tota lp rote in and the four solub ility frac tions had d iffe rent p olyp ep tide comp os itions.The re we re10sp ec trum bands a t the range of 20.1~66.4kDa for g lobulin.And three d is tinc t sp c trum bands a t20.1,29.0,44.3kDa for g liad in,resp ec tive ly.M ore than 10bands we re d is tributed from 20.1kDa to97.2kDa.Hence,tha t tota l p rote in and the four solub ility frac tions had d iffe rent p olyp ep tide comp os itions
defa tted Tep hros ia voge liiHook f.seeds;p rote in comp os ition;isoe lec tric p oint;solub ility;SDS-PAGE
TS201.2+1
A
1002-0306(2010)03-0158-04
非洲山毛豆 (Tephrosia vogeliiHook f.)又称福氏灰毛豆、窝氏灰叶,属豆科,蝶形花亚科,灰叶属,多年生灌木。作为一种优良的水土保持、护坡绿化、土壤改良植物[1-4],其原产于非洲,主要分布在北纬 15°至南纬 20°的广大地区,亚洲也有自然分布[5]。近 10多年来,我国广东、广西、海南、云南、贵州、四川、福建等省区大量种植。非洲山毛豆种子产量高,不需要人工水、肥管理,未发现病虫害,不需要使用农药,荒山种植,不占用耕地。目前,尚未见中外文献关于非洲山毛豆种子食用、饲用及营养价值的研究报道。我们前期研究结果表明,非洲山毛豆种子中粗蛋白含量为 38.73%(m/m)[6],说明其蛋白含量较高。本实验进一步对非洲山毛豆种子蛋白进行了分级分离,测定了组分蛋白的等电点和溶解度,并对其进行SDS-PAGE电泳分析,确定出各组分蛋白的分子量范围,以期为非洲山毛豆作为新的蛋白质资源开发利用提供部分理论依据。
2009-02-02 *通讯联系人
李小华(1978-),女,在读硕士研究生。
广东省科技计划资助项目(2008B030302001)。

