Sephadex G-50纯化生姜蛋白酶的研究
杜新永,唐晓珍
(1.山东农业大学食品科学与工程学院,山东泰安 271018; 2.山东省青州市农业局,山东青州 262500)
Sephadex G-50纯化生姜蛋白酶的研究
杜新永1,2,唐晓珍1,*
(1.山东农业大学食品科学与工程学院,山东泰安 271018; 2.山东省青州市农业局,山东青州 262500)
采用 Sephadex G-50为填料对粗提生姜蛋白酶进行了纯化,充分利用了尺寸排阻层析简便、高效、重复性好的特点,以酶得率、纯化倍数、柱效分析等参数为指标,研究了凝胶柱床高度、洗脱速度、上样量等条件对纯化效果的影响。确定了最佳纯化方案为:柱床高度 50cm,上样量 3mL粗酶,流速 45cm/h,洗脱液总用量 150mL。纯化后的生姜蛋白酶比活性是姜汁的 4.192倍,粗酶的 2.113倍,而且还去除了色素、不溶物等杂质,纯化效果极佳。
生姜蛋白酶,Sephadex G-50(葡聚糖凝胶),尺寸排阻层析(SEC),纯化
1 材料与方法
1.1 材料与仪器
生姜 购自山东泰安当地超市;Sephadex G-50 Wha tman(进口分装);酪蛋白、酪氨酸、BSA(牛血清蛋白)、Coomassie Blue G-250 上海化学试剂采购供应站进口分装;其它为实验室常规试剂。
恒流泵、紫外检测仪、分部收集器 上海沪西分析仪器厂有限公司;层析柱 上海亚荣生化仪器公司,16×500mm;分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 生姜蛋白酶粗酶制备[1-4,7]生姜洗净切丝→1∶1 (m/v)磷酸缓冲液 (pH6.86,50mmol/L,含 5mmol/L EDTA, 10mmol/L Cysteine)→打浆,低速搅拌 30min,并加入 20% (m/v)的硫酸铵→纱布过滤,4℃静置 3h→离心,收取上层姜汁→1∶1(v/v)预冷丙酮 (-18℃)沉淀→离心获得粗酶
1.2.2 Sephadex G-50纯化[4-5]
1.2.2.1 缓冲液选择 选择不同缓冲液,先用 1~2倍柱体积(CBV)量平衡凝胶柱,测定收集器流出的洗脱液 pH与所用缓冲液的 pH相等后,再上样并进行洗脱,根据 SEC纯化酶的酶活力来选择最佳缓冲液作为洗脱液。
1.2.2.2 凝胶柱床高度确定 选择不同凝胶柱床高度,取等量粗酶上柱洗脱,根据蛋白质分离效果确定最佳凝胶柱床高度。
1.2.2.3 洗脱速度确定 设定不同洗脱速度,对 SEC进行洗脱,根据洗脱效果,确定最佳洗脱速度。
1.2.2.4 上样量确定 在最佳柱床高度及洗脱速度时,设定不同的上样量,综合分离柱效与生产量来确定最佳上样量。
1.2.2.5 纯化倍率计算 分别以姜汁、粗酶的比活力与 SEC最佳纯化工艺获得的酶比活力进行比较,得出纯化倍率。计算公式为:R=SE/SJ
其中:R—纯化倍率;SE—酶液比活力,单位:U/μgPr;SJ—姜汁比活力,单位:U/μgPr。
1.2.2.6 蛋白质分辨率计算公式 Rs=[2(VR2-VR1)]/(Wb1+Wb2)
其中:VR1和 VR2—峰 1和峰 2的洗脱体积;Wb1和Wb2—洗脱峰 1和峰 2的峰宽。
分离效率计算基准为:Rs=1.5时,分离效率为100%;Rs=1.0时,分离效率为 98%,以此为基准,推测出其他分辨率所对应的分离效率。
1.2.3 测定方法
1.2.3.1 蛋白质含量的测定[8]本实验采用 Bradford Protein Assay(考马斯亮蓝 G-250)法测定蛋白质含量。标准曲线方程为:y=202.41x-2.3252,R2= 0.9912,单位:μg/mL。
1.2.3.2 生姜蛋白酶活力测定[1,8]生姜蛋白酶活力的定义:在 40℃水浴条件下,酶促反应前 5min降解酪蛋白产生 TCA(三氯乙酸)可溶的多肽增加量,以活性与灭活的生姜蛋白酶进行对照,根据酪氨酸标准方程,每增加 1μg/mL酪氨酸的值计量为一个酶活力单位。标准方程为:y=802.92x-9.5212,R2= 0.9995,单位:U。
2 结果与分析
2.1 缓冲液的选择
采用磷酸 (pH6.86,0.05mol/L)、Tris-HCl (pH8.0,0.05mol/L)、去离子水(pH 7.0,无缓冲能力)三种缓冲液对生姜蛋白粗酶进行纯化,从而得到不同缓冲液的生姜蛋白 SEC纯化酶液。以酪蛋白为底物分别设定酶促水解反应时间:5、25、50、100、150min,根据标准方程计算酪蛋白酶促水解量,结果见图1。
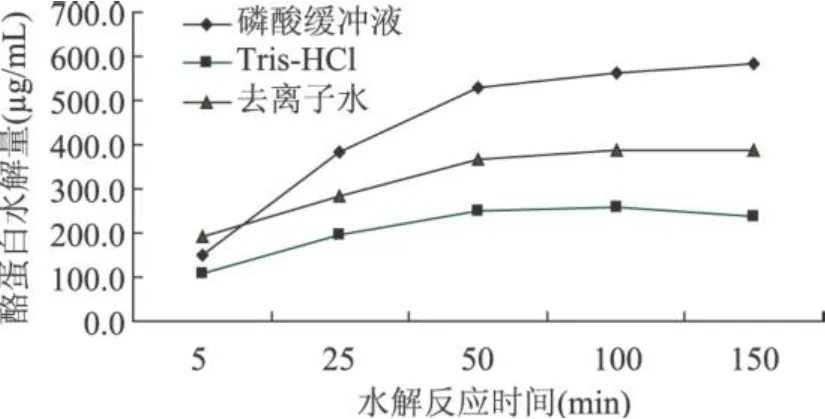
图 1 不同缓冲液中生姜蛋白酶活力比较
从图 1可以看出,随着酶促水解时间的延长,酪蛋白水解量呈上升趋势,50min前水解量增长较快,之后渐渐变缓。其中,磷酸缓冲液 (pH6.86)SEC纯化酶的酪蛋白水解量上长趋势较明显,而 Tris-HCl (pH8.0)与去离子水(pH7.0)SEC纯化酶的酪蛋白水解量上升趋势较为平缓,随着时间的延长,酪蛋白水解量并没有明显的增长。本实验设定的酶促反应温度为 40℃,在该温度下,生姜蛋白酶半衰期仅为20min[9],而磷酸缓冲液 (pH6.86)SEC纯化酶的酪蛋白水解量在 50min内一直呈现出明显的增长趋势,说明磷酸缓冲液(pH6.86)能较好地保持生姜蛋白酶的活性。
比较三种 SEC纯化酶的酪蛋白水解量,除 5min的值以去离水(pH7.0)SEC纯化酶最高外,其余各个时间点的酪蛋白水解量均为:磷酸缓冲液 (pH6.86)酶 >去离子水(pH7.0)酶 >Tris-HCl(pH8.0)酶。
综合上述分析,磷酸缓冲液 (pH6.86)是最佳的选择,故本实验确定磷酸缓冲液 (pH6.86)为生姜蛋白酶 SEC洗脱液。
2.2 Sephadex G-50凝胶柱床高度确定
SEC在洗脱液推动下,利用分子量不同的物质受到凝胶阻力不同,导致移动速度不同而被分离[5],因此凝胶柱床高度是一个重要的柱效指标。本实验选择凝胶柱床高度 25、50cm两个高度进行纯化操作,当凝胶柱床高度为 25cm时,采用恒流泵将洗脱速度分别设定为 2.0、0.5、1.5mL/min的速度进行洗脱,上样量为 70μg/mL的粗酶 2mL(10g生姜制得)时,只能获得一个蛋白峰 (见图 2),而将凝胶重新装柱到 50cm后,确定 1.5mL/min的洗脱速度,分别上样量为粗酶 2、3、4、10mL(相当于 10、15、20、50g生姜制得)时,则可以得到两个很明显的蛋白洗脱峰 (见图3)。
生姜蛋白粗酶在提取、沉淀等过程中,以姜汁中蛋白质为目标物,因此,粗酶中杂蛋白含量较大,在SEC纯化过程中,获得一个蛋白峰就意味着杂蛋白去除量极少,而获得两个蛋白峰就说明至少去除了约一半的杂蛋白。对比图 2、图 3可以明显地看到,将凝胶柱床高度从 25cm提高到 50cm后,粗酶中的蛋白质分离度得到了明显的提高。本实验中采用的层析柱最高仅能装 50cm凝胶,故而确定凝胶柱床高度 50cm。
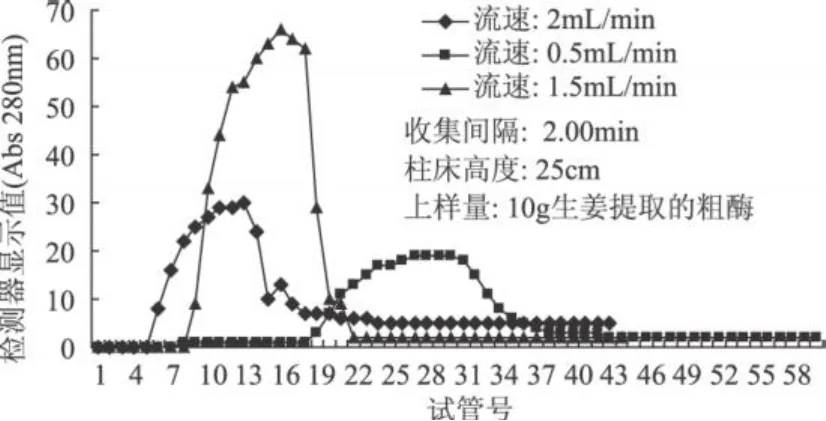
图2 25cm凝胶柱床洗脱效果图

图3 50cm凝胶柱床洗脱效果图
2.3 洗脱速度确定
从图 2可以看出,洗脱速度越快,蛋白质出峰越快,然而分离效果较差。当凝胶柱床高度增高到50cm后,重复上述洗脱速度的实验,当洗脱速度超过 1.5mL/min后,就不能得到两个明显的蛋白峰,达到 3.0mL/min的洗脱速度后,最终的洗脱效果就仅出现一个蛋白峰。
分析对比所有的实验数据后,最终确定1.5mL/min为最佳洗脱速度,此速度可以获得最佳洗脱效果。
洗脱速度换算结果[5]为:(60×1.5mL/h)/ (100mL/50cm)=45cm/h
2.4 上样量确定
从图 3可以看出,上样量越大,出峰越快,峰形越高,但是两峰之间的分离效果也越差,分别计算图3中四个处理的分辨率 (见表 1)。

表1 SEC不同上样量柱效表
从表 1中可以看出,当上样量高于 15g生姜制取的粗酶后,分离效率就不够理想,因此,可以确定上样量为 15g生姜制粗酶 (用 1∶3v/v磷酸缓冲液复溶, 3mL)时,可以获得较好的分离效果。
2.5 纯化倍率计算
分别取姜汁、粗酶、SEC纯化酶测定蛋白质含量、酶活力单位、比活力,以姜汁、粗酶的比活力为 1,测算出生姜蛋白酶的纯化倍率,其结果见表 2。
从表 2可以看出,以姜汁酶活力为基准时,粗酶的比活力为其 1.98倍,而经过 SEC纯化后,比活力纯化倍数达到 4.19倍,是粗酶的 2.11倍,纯化效果比较理想。

表2 SEC纯化效果表
3 结论
3.1 本实验结果证明,单独使用 Sephadex G-50为填料进行 SEC纯化,就能够有效地纯化生姜蛋白酶,纯化倍率是姜汁的 4.19倍,是粗酶的 2.11倍。而且其纯化过程简便、高效、重复性好。
3.2 SEC纯化不仅可以除去粗酶中绝大部分的色素、不溶物等杂质,还可以更换缓冲液,能够适应研究、生产时对生姜蛋白酶缓冲液的特殊需要。
3.3 通过实验,确定了 Sephadex G-50纯化生姜蛋白酶的最佳洗脱方案为磷酸 (pH 6.86)缓冲液,柱床高度 50cm,上样量 3mL(15g生姜提取的粗酶),流速45cm/h,洗脱液总用量 150mL。
[1]Misook Kim,Susan E Hamilton,et al.Plant collagenase:Unique collagenolytic activity of cysteine proteases from ginger [J].BiochimicaetBiophysica Acta,2007,1770:1627-1635.
[2]Ohtsuki K,Taguchi K,Sato K,et al.Purification of ginger proteases by DEAE-Sepharose and isoelectric focusing[J]. Biochim BiophysActa,1995,1243:181-184.
[3]Choi KH,Laursen RA.Amino-acid sequence and glycan structures of cysteine proteaseswith proline specificity from ginger rhizome Zingiber officinale[J].Eur J Biochem,2000,267(5):1516-1526.
[4]赵帜平,等 .生姜蛋白酶的分离纯化及其糖肽键型的初步研究[J].安徽大学学报,1995(2):93-97.
[5]陆建,等 .蛋白质纯化技术及应用[M].北京:化学工业出版社,2005:29-31.
[6]孙国梁,乔园园,等 .生姜蛋白酶提取新工艺[J].食品工业科技,2007,28(10):197-199.
[7]Hompson E H,Wolf L D.Ginger Rhizome:A new source of proteolytic enzyme[J].J Food Sci,1973,38:652-655.
[8]韩雅珊 .食品化学实验指导[M].北京:北京农业大学出版社,1992:42-50.
[9]Adulyatham,Richard Owusu-Apenten.Stabilization and Partial Purification of a Protease from Ginger Rhizome[J].J Food Scie,2005,70(31):231-234.
Study on purification of ginger protease by Sephadex G-50
DU Xin-yong1,2,TANG Xiao-zhen1,*
(1.Food Science and Engineering College of ShandongAgriculturalUniversity,Taian 271018,China; 2.Qingzhou CityAgriculturalBureau of Shandong Province,Qingzhou 262500,China)
C rude g inge r p rotease was p urified by Sep hadex G-50,and the op t im a l p urifica tion m e thod was ob ta ined through resea rches about the ge l bed leng th,flow ra te,samp le app lica tion am ount,and was m easured by g inge r p rotease yie ld,p urified folds,and the effic iency of chrom a tog rap hy colum n.The p a ram e te rs we re:ge l bed leng th—50cm,samp le app lica tion am ount—c rude g inge r p rotease3mL (extrac ted from 10g g inge r),flow ra te—45cm/h,and the tota l e lution leng th was150mL.Afte r p urifying,not only the sp ec ific ac tivity of p urified g inge r p rotease inc reased to4.192folds of g inge r juice,and2.113folds of c rude g inge r p rotease,but a lso p igm ent, insolub le imp urities we re rem oved,which ind ic ts a good effec t of p urifica tion.
g inge r p rotease;Sep hadex G-50;s ize exc lus ive chrom a tog rap hy(SEC);p urifica tion
TS255.1
A
1002-0306(2010)03-0303-03
生姜蛋白粗酶的纯化常用离子交换层析 (I on Exchange Chromatography)、尺寸排阻层析 (Size Exclusive Chromatography,SEC)[1-4]等柱层析法进行纯化,其特点是样品处理量大,效率较高。对需要较高纯度的生姜蛋白酶时,则使用 HPLC[1]、电泳[2]等方法。尺寸排阻层析(SEC),又称为凝胶过滤层析(Gel Filtration Chromatography,GFC),其纯化原理是利用具有多孔网状结构凝胶的分子筛作用,根据被分离样品中各组分分子量大小的差异对样品进行分离[5]。因为 SEC所用的凝胶属于惰性载体,不带电荷,吸附力弱,所以具有易清洗、可更换缓冲溶液等优点。在现有的文献报道中,SEC一般用于离子交换层析(IEC)之后[4],也就是使用 SEC对 IEC纯化酶作进一步的纯化,或使用 SEC检测样品的分子量[6],还未有单独使用 SEC对生姜蛋白酶进行纯化的报道。与IEC相比,SEC具有操作简便、高效、重复性好、回收率高等优点,在纯化的过程中,还可以更换缓冲液,便于根据工业生产的需要设定相应的纯化方案。本实验采用 Sephadex G-50为填料对生姜蛋白粗酶进行纯化,获得了较好的纯化效果。
2009-05-21 *通讯联系人
杜新永(1973-),在读硕士。

