利用分子内Click反应合成哌嗪并三唑和哌嗪并四唑化合物*
黄家吉, 贺晓鹏, 董 菁, 胡 键, 施小新
(华东理工大学 药学院,上海 200237)
点击化学是近十年来较热门的研究课题,点击化学反应具有反应条件温和,后处理简单,收率高等特点[1]。不饱和炔键和氰基与叠氮基发生的[1,3]偶极环加成是一种比较典型的点击化学反应,它能在较简单的条件下高效率地产生复杂的含有三唑和四唑类结构的杂环化合物。相关研究表明含有三唑和四唑结构的化合物具有较广泛的生理活性[2,3],因此利用点击化学反应合成三唑和四唑类杂环化合物具有一定的意义。目前文献[4~7]报道的合成含三唑和四唑结构的化合物的方法主要是分子间点击化学反应,对分子内点击化学反应的研究相对较少。
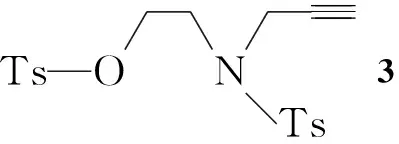
本文设计并研究了新型的分子内点击化学反应,并利用这一反应合成了氮上有对甲苯磺酰基取代的哌嗪并三唑化合物(1)和哌嗪并四唑化合物(2, Scheme 1)。
1 实验部分
1.1 仪器与试剂
Bruker ADVANCE 500型核磁共振仪(CDCl3为溶剂,TMS为内标);DICOLET IR 550型红外光谱仪(KBr压片);HP5989A型质谱仪。
所用原料和试剂未特别指出,均为分析纯;柱层析使用青岛硅胶100目~200目或200目~300目(60%)。
4 5 2
Scheme1
1.2 1的合成
(1)3的合成
在反应瓶中依次加入乙醇胺0.68 g(11.13 mmol),甲烷磺酸丙炔醇酯0.50 g(3.73 mmol)和无水乙醇7 mL,搅拌下于室温反应(TLC跟踪)。减压蒸去乙醇,加入二氯甲烷20 mL和水5 mL萃取,有机相用水(3 mL)洗涤,MgSO4干燥,蒸干溶剂得无色液体。加入乙酸乙酯10 mL,三乙胺1.35 g(13.33 mmol),冰水浴冷却,搅拌下分批加入对甲苯磺酰氯(TsCl) 1.80 g(9.44 mmol),加毕,于室温反应约5 h(TLC跟踪)。分液,有机相依次用1 mol·L-1盐酸和20%K2CO3溶液洗涤,无水MgSO4干燥,蒸干溶剂,残余物用混合溶剂A[V(乙酸乙酯) ∶V(石油醚)=1 ∶2]洗涤,干燥得白色固体31.14 g(2.80 mmol),收率75%(以甲烷磺酸丙炔醇酯计);1H NMRδ: 2.05(t,J=2.5 Hz, 1H), 2.42(s, 3H), 2.46(s, 3H), 3.45(t,J=5.8 Hz, 2H), 4.09(d,J=2.5 Hz, 2H), 4.22(t,J=5.8 Hz, 2H), 7.29(d,J=8.0 Hz, 2H), 7.37(d,J=8.0 Hz, 2H), 7.68(d,J=8.3 Hz, 2H), 7.79(d,J=8.3 Hz, 2H)。
(2) 1的合成
在反应瓶中加入3 0.50 g(1.23 mmol)的DMF(5 mL)溶液,搅拌下于室温滴加NaN30.24 g(3.69 mmol)的水(1 mL)溶液,滴毕,于70 ℃反应6 h(TLC跟踪)。冷却至室温,分批加入水20 mL(有白色固体析出),过滤,滤饼用蒸馏水洗涤三次,烘干得白色固体1275 mg(0.99 mmol),收率80%;1H NMRδ: 2.45(s, 3H), 3.63(t,J=5.3 Hz, 2H), 4.43(s, 2H), 4.49 (t,J=5.4 Hz, 2H), 7.37(d,J=8.1 Hz, 2H), 7.53(s, 1H), 7.72(d,J= 8.1 Hz, 2H);13C NMRδ: 22.18, 42.24, 43.71, 46.08, 128.21, 129.43, 130.08, 130.80, 133.22, 145.46; IRν: 3 147, 2 955, 1 657, 1 595, 1 458, 1 336, 1 168, 1 097, 920, 828, 738 cm-1; MSm/z(%): 278(M+, 16), 155(33), 123(88), 91(100), 67(46)。
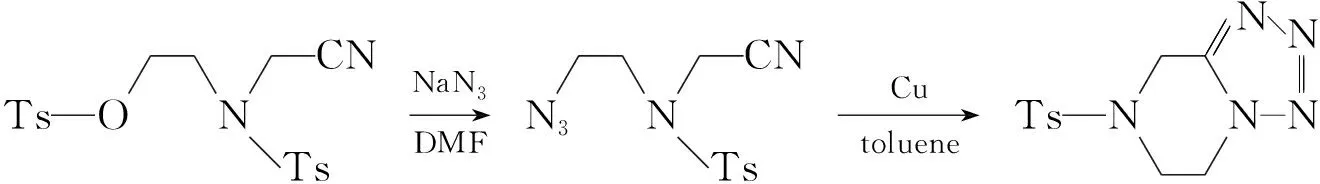
1.3 2的合成
(1)4的合成
在反应瓶中依次加入乙醇胺1.50 g(24.56 mol),氯代乙腈0.84 g(11.13 mol)和无水乙醇10 mL,搅拌下于40 ℃反应过夜。蒸干乙醇,用乙酸乙酯50 mL和饱和食盐水5 mL萃取,有机相用水(3 mL)洗涤,无水MgSO4干燥,减压蒸除溶剂得淡黄色固体(0.91 g)。加入乙酸乙酯10 mL,三乙胺2.75 g(27.18 mmol),冰水浴冷却(<5 ℃),搅拌下分批加入TsCl 3.82 g(20.04 mmol,于室温反应过夜((TLC跟踪))。分液,有机相依次用1 mol·L-1盐酸和20%K2CO3溶液洗涤,无水MgSO4干燥,蒸干溶剂得白色固体,用混合溶剂A洗涤得白色固体4 3.20 g(7.83 mmol),收率70% (以氯代乙腈计);1H NMRδ: 2.44(s, 3H), 2.47(s, 3H), 3.46(t,J=5.1 Hz, 2H), 4.24(t,J=5.1 Hz, 2H), 4.29(s, 2H), 7.36(d,J=8.5 Hz, 2H), 7.38(d,J=8.6 Hz, 2H), 7.69(d,J=8.3 Hz, 2H), 7.79(d,J= 8.3 Hz, 2H)。
(2)5的合成
在反应瓶中加入4 0.80 g(1.96 mmol)的DMF(5 mL)溶液,搅拌下于室温滴加NaN3240 mg(3.69 mmol)的水(1 mL)溶液,滴毕,于40 ℃反应过夜(TLC跟踪)。用甲苯(30 mL)和水(15 mL)萃取,有机相用少量水洗涤,无水MgSO4干燥,旋转蒸干有机相得白色固体50.49 g(1.75 mmol),收率89%;1H NMRδ: 2.44(s, 3H), 3.33(t,J=5.7 Hz, 2H), 3.60(t,J=5.7 Hz, 2H), 4.39(s, 2H), 7.37(d,J=8.1 Hz, 2H), 7.73(d,J=8.1 Hz, 2H)。
(3)2的合成
在反应瓶中加入50.10 g(0.36 mmol)的甲苯(2 mL)溶液,铜粉20 mg(0.31 mmol),搅拌下回流反应18 h(TLC跟踪)。冷却,过滤,滤液蒸干,残余物经柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶1]纯化得白色固体281 mg(0.29 mmol),收率81%;1H NMRδ: 2.45(s, 3H), 3.70(t,J=5.4 Hz, 2H), 4.49(t,J=5.4 Hz, 2H), 4.62(s, 2H), 7.38(d,J=8.1 Hz, 2H), 7.73(d,J=8.2 Hz, 2H);13C NMRδ: 23.25, 43.79, 44.30, 46.81, 129.22, 132.02, 134.18, 146.87; IRν: 3 045, 2 958, 1 655, 1 595, 1 455, 1 335, 1 170, 1 095, 935, 735 cm-1; MSm/z(%): 279 (M+, 72), 223 (4), 155 (66), 124 (6), 91 (100), 65 (16)。
2 结果与讨论
2.1 乙醇胺的单烷基化反应
在乙醇胺与甲烷磺酸丙炔醇酯或氯代乙腈的反应中,乙醇胺过量有利于主要生成单烷基化产物仲胺。降低乙醇胺与甲烷磺酸丙炔醇酯或氯代乙腈的摩尔比,副产物双烷基化产物叔胺则明显增多。
2.2 炔键与叠氮基的分子内环加成
尽管炔键与叠氮基的分子间环加成反应需要在铜试剂催化下才能进行,但本实验表明炔键与叠氮基的分子内环加成在加热下很容易进行,不需要铜试剂催化。在加热条件下,叠氮基取代3中OTs后生成的叠氮取代物立刻发生分子内环加成反应,TLC没有检测到反应过程中产生的叠氮取代中间产物。
2.3 氰基与叠氮基的分子内环加成
与氰基与叠氮基的分子间环加成反应一样[5,6],其分子内的环加成反应也较难进行,5必须在铜试剂催化下长时间加热回流情况下才能使反应完成。
3 结论
以乙醇胺为原料,乙醇胺与甲烷磺酸丙炔醇酯及对甲苯磺酰氯反应生成3;3与叠氮钠在加热条件下发生取代和分子内环加成“一锅烩”反应,生成哌嗪并三唑化合物,总收率60%。
乙醇胺与氯代乙腈及对甲苯磺酰氯反应生成4;4与叠氮钠在加热条件下发生取代生成5;5在铜粉催化和长时间回流下生成哌嗪并四唑化合物,总收率50%。
[1] Kolb H C, Finn M G, Sharpless K B. Click chemistry: diverse chemical function from a few good reactions[J].Angew Chem, Int Ed,2001,40(11):2004-2021.
[2] Chen Q, Yang F, Du Y. Synthesis of aC3-symmetric (1→6)-N-acetyl-β-D-glucosamine octadecasaccharide using click chemistry[J].Carbohydr Res,2005,340(16):2476-2482.
[3] Li J, Zheng M, Tang W,etal. Syntheses of triazole-modified zanamivir analogs via click chemistry andanti-AIV activities[J].Bioorg Med Chem Lett,2006,16(19):5009-5013.
[4] Kolb H C, Sharpless K B. The growing impact of click chemistry on drug discovery[J].Drug Discovery Today,2003,8(24):1128-1137.
[5] Demko Z P, Sharpless K B. A click chemistry approach to tetrazoles by Huisgen 1,3-dipolar cycloaddition: synthesis of 5-sulfonyl tetrazoles from azides and sulfonyl cyanides[J].Angew Chem, Int Ed,2002,41(12):2110-2113.
[6] Demko Z P, Sharpless K B. A click chemistry approach to tetrazoles by Huisgen 1,3-dipolar cycloaddition:Synthesis of 5-acyltetrazoles from azides and acyl cyanides[J].Angew Chem, Int Ed,2002,41(12):2113-2116.
[7] Rostovtsev V V, Green L G, Fokin V V,etal. A stepwise Huisgen cycloaddition process:Copper(Ⅰ)-catalyzed regioselective “ligation” of azides and terminal alkynes[J].Angew Chem,Int Ed,2002,41(14):2596-2599.

