不同N水平下缘管浒苔对重金属铜的响应
徐军田,邹定辉,朱明,郭赣林,李信书,刘树霞
(1. 淮海工学院海洋学院 江苏 连云港 222005;
2. 华南理工大学环境科学与工程学院 工业聚集区污染控制与生态修复教育部重点实验室 广东 广州 510006)
不同N水平下缘管浒苔对重金属铜的响应
徐军田1,邹定辉2,朱明1,郭赣林1,李信书1,刘树霞1
(1. 淮海工学院海洋学院 江苏 连云港 222005;
2. 华南理工大学环境科学与工程学院 工业聚集区污染控制与生态修复教育部重点实验室 广东 广州 510006)
探讨了重金属铜对两种N水平生长条件下缘管浒苔生长、光合作用、硝酸还原酶活性以及色素和蛋白含量的影响。结果表明,两种N水平下,铜离子都显著抑制藻体的生长速率,并且随着浓度的增加而增大;而N加富显著促进藻体的生长速率,但这种作用在高浓度铜(2 μM)的作用下不显著。高浓度的铜和N同时存在时,藻体的光合作用速率显著下降,硝酸还原酶活性也显著降低。高浓度的铜显著降低类胡萝卜素和可溶性蛋白的含量,在N加富的情况下,这种抑制作用更为显著。
缘管浒苔;铜;N; 光合作用;相对生长速率
海水的富营养化是近年来引起广泛关注的重要海洋环境问题,海域的富营养化日益加剧,影响了大型海藻栖息的海洋生态环境条件。大型海藻是近岸海域重要的初级生产者,它贡献了海洋 10 %的初级生产力,对近岸海域海域碳循环起着很重要的作用。氮往往是海藻生长过程中的限制性元素,但是在富营养化过程中,海水中氮水平急剧增加。研究富营养化与大型海藻的关系具有重要的生态意义,一方面,目前许多学者认为大型海藻的广泛养殖是吸收和利用营养物质,延缓并改善水域富营养化的有效措施之一[1,2];另一方面,近岸海域的富营养化不但与赤潮的发生等海洋生态灾害有直接的关系,而且,这也可能与某些机会主义生态类型的大型海藻种类如浒苔等的爆发性生长(如“绿潮”、“藻华”现象)有关。
重金属污染是另一个重要的海洋环境问题,其中铜是主要的污染物之一,关于铜对海洋大型藻类的效应已在国内外得到了很好的研究[3-6]。虽然在真核生物的基本生命过程中,铜是不可缺少的一种微量元素,但是高浓度的铜却成为海洋生物中最具有毒性的重金属之一,它对生物代谢的大多数过程都有一定的影响[7]。海洋污染的日趋加重,各种污染物并不是单一的出现在某个海域,如工业废水中不仅仅含有大量的氨氮,同时还有大量的重金属,这样海区内就成为多种污染物的混合体,研究近岸海域大型海藻对这些污染的响应,不仅仅要考虑每种污染物对藻体的效应,更要研究它们共同作用藻体的互作效应。
本文以常见大型绿藻缘管浒苔为材料,从生长速率、光合生理、硝酸还原酶活性以及色素和蛋白含量方面来研究氮和铜对藻体的结合效应,为综合评价海洋环境污染对近岸大型藻类的影响提供一定的实验基础。
1 材料和方法
1.1 实验材料
缘管浒苔(Enteromorpha linza)于 2010年 3月采自连云港高公岛。材料用过滤海水清洗干净后,选取色泽鲜绿,宽度适中的健康藻体于玻璃水族箱内暂养,暂养的条件是温度为 12 ℃,光强为200 μmol m-2s-1,光周期为 12 h︰12 h;培养液为过滤的自然海水,每两天更换一次,每天24 h通气培养。
1.2 培养
选取浒苔宽度为1 cm左右的藻体,用剪刀切为长度大约3 cm的小段,放入1 L的三角烧瓶内充气培养,培养的温度、光强和光周期均与暂养条件相同。实验设置2个N 营养盐水平和3个铜离子浓度共6个处理组合:两种N水平是对照N水平的海水(N0,其N的含量约为36 μM)、以及N加富处理的海水(通过在过滤的自然海中加入300 μmol/L的NaNO3, N300);对每种N水平处理下设置3个重金属(Cu)梯度,即海水中铜的总浓度分别为对照水平(Cu0,Cu浓度约为0.06 μM),0.5 μM和2 μM (通过分别向海水中添加0.5 μM和2 μM CuSO4.5H2O获得)。每个处理3次重复。培养液每两天更换一次,且24 h通气培养。
1.3 生长测定
每隔一天测定一次藻体的鲜重,藻体的相对生长速率(Relative growth rate , RGR)按照以下公式求得:RGR=100*(lnNt- lnN0)/t,其中Nt为第t天藻体的重量,N0为藻体的初始重量。
1.4 光合作用的测定
用氧电极法 (Hansatech,英国) 测定缘管浒苔光合放氧速率。测定之前,把藻体用锋利的小剪刀剪成约 0.2 cm2大小的小片,在室内低光下适应 1 ~2 h,最大程度的消除藻体损伤带来的测定误差。 然后称取大约 20 mg 鲜重 (FW) 的藻片(大约20片)放入装有2 mL 反应介质的反应槽中。用循环水浴精确控制反应槽内的温度为12 ℃。光强梯度是通过调节光源与反应槽的距离获得。光强响应曲线参数通过以下公式[8]获得:P = Pmax*tanh(α*I/Pmax) +Rd,其中P为光合作用速率,Pmax为最大光合作用速率,α为光合效率,I为光强强度,Rd为呼吸作用速率。
1.5 色素的测定
对不同培养条件下的藻体,测定其叶绿素 a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car.)的含量。取大约0.1 g藻体置于10 mL的甲醇中,放置于4 ℃的冰箱内过夜处理,然后用分光光度计测定提取液在470,653和666 nm的吸光值。色素含量按照以下公式计算[9]:叶绿素-a=15.65A666-7.34A653;叶绿素b = 27.05A653-11.21A666;类胡萝卜素 =(1 000A470+ 1 403.57A666-3 473.87A653)/221。 其中A470、A653、A666分别表示在470 nm,653 nm和666 nm的光密度值。
1.6 蛋白含量的测定
取藻体0.2 g,加10 ml pH 7.5的磷酸缓冲液和少量石英砂于研钵内研磨,然后以10000 g 4 ℃冷冻离心10 min,取上清液,采用考马斯亮兰G—250( Coomassie Brilliant Blue G-250 ) 染料结合法[10]测定可溶性蛋白的含量。
1.7 硝酸还原酶的测定
通过测定一定量藻体 ( 活体 ) 在一定量反应介质中单位时间内产生的亚硝氮 ( NO2-) 的量来表示藻体的硝酸还原酶活性(NRA)[11]。称取0.2 g藻体加入10 mL反应介质缓冲液 ( 0.1 M pH7.5的磷酸缓冲液,0.01 mM 的葡萄糖;0.5 mM 的Na-EDTA;200 mM的NaNO3),充氮气2 min,后在黑暗条件下30 ℃反应30 min。取反应介质1 mL,加入2 mL磺胺和2 mL的盐酸萘乙二氨试剂,混匀,静置30 min,用分光光度计测定520 nm处的吸光值,根据标准曲线的回归方程计算亚硝氮的含量,用单位时间和单位质量藻体产生亚硝氮的量来表示硝酸还原酶活性(μmolNO2-g-1h-1)。
1.8 数据处理
实验数据采用方差分析法(one- or two-way ANOVA) 或T-test分析,设置显著水平为P< 0.05。
2 结 果
铜对缘管浒苔的生长有着显著的影响(P<0.05),两种 N水平下培养的藻体生长增长量都随着铜的增加而降低(图1A), 铜显著降低藻体的相对生长速率(RGR),2 μΜ铜的抑制作用最大,与对照相比,N加富培养下的RGR下降约72%,正常N水平下的下降为67%(图1B)。N加富显著促进藻体的RGR(P< 0.05),但这种作用在高浓度铜( 2 μΜ ) 的作用下不显著(P> 0.05)。

图 1 在不同Cu处理(0,0.5和2 μM)以及两种N水平(0和300 μM)培养下缘管浒苔鲜重(A)和RGR(B)的变化(图中N0、N300分别表示培养海水中的两种N水平:0和300 μM;Cu0,Cu0.5,Cu2分别表示培养海水中的3种Cu离子水平:0,0.5和2 μM。)Fig. 1 Changes of fresh weight (A) and RGR (B) of Enteromorpha linza cultured at two different N availabilities(0 and 300 μM)and different Cu exposures (0, 0.5 and 2 μM). Means±SD (n=3).
缘管浒苔藻体的光合作用在不同的处理下呈现不同的变化趋势(图 2)。铜显著降低两种N水平培养下藻体的光合效率(α)(P< 0.05),并且随着浓度的增加抑制作用增大(表1)。 N加富显著提高了藻体在铜浓度为 0和 0.5μΜ 时的光合效率(P< 0.05),但在2μΜ铜处理下的藻体,N加富却呈现相反的效应。对于藻体的最大光合作用速率来说,N加富培养下的藻体,铜浓度只有在2 μΜ时才有显著的抑制作用(P< 0.05)。在正常N水平下培养的藻体,最大光合作用速率随着铜浓度的增加而显著降低(P< 0.05)。 N加富对铜浓度为0培养的藻体最大光合作用速率没有显著影响,但却显著促进了0.5μΜ铜浓度培养下藻体的最大光合作用速率(P< 0.05),而对于培养在2 μΜ铜浓度下的藻体来说,N加富却体现为抑制作用。正常N水平下培养的藻体在铜浓度为2μΜ时其光饱和光强(Ik)显著低于铜浓度为0时的藻体,除此之外,所有处理间没有显著差异(P> 0.05)(表1)。
在N加富的情况下,铜显著降低硝酸还原酶的活性(P< 0.05),并且随着浓度的增加抑制作用增大;而在正常N水平下,0.5 μΜ铜显著促进硝酸还原酶的活性,而2 μΜ铜显著抑制硝酸还原酶的活性(P< 0.05)。N加富显著促进藻体在铜浓度为0和0.5 μΜ时的硝酸还原酶活性(P< 0.05),但在2 μΜ铜作用下却表现为抑制效应 (图 3)。

图 2 在不同Cu处理(0,0.5和2 μM)以及两种N水平(0和300 μM)培养下缘管浒苔光合作用-光强响应曲线(P-I 曲线)(图中N0、N300分别表示培养海水中的两种N水平:0和300 μM;Cu0,Cu0.5,Cu2分别表示培养海水中的3种Cu离子水平:0,0.5和2 μM。)Fig. 2. P-I curves of Enteromorpha linza cultured at two different N availabilities (0 and 300 μM)and different Cu exposures (0, 0.5 and 2 μM).Means±SD (n=3).
在正常N水平下,铜对叶绿素a(Chla)含量没有显著的影响,但在N加富的情况下,铜显著提高Chla的含量(P< 0.05),但两个铜加富处理之间没有显著差异(P> 0.05)。而N加富却显著提高所有铜浓度水平下的Chla的含量(P< 0.05)(图4A)。Chlb呈现和Chla相同的变化趋势(图 4B)。在正常N水平下,类胡萝卜素(Car.)的含量变化趋势和Chla和Chlb一致,但在N加富的情况下,0.5 μΜ铜处理下的藻体的Car.含量最高,而2 μΜ铜处理下的最低,三者处理之间都有显著性差异(P< 0.05)。N加富显著提高藻体在铜浓度为0和0.5 μΜ时的Car.含量, 但在2 μΜ铜作用下却表现为相反的效应(图 4C)(P< 0.05)。
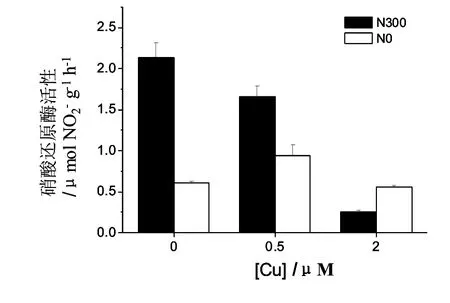
图 3 在不同Cu处理(0,0.5和2 μM)以及两种N水平(0和300 μM)培养下缘管浒苔硝酸还原酶活性(NRA)的变化(图中N0、N300分别表示培养海水中的两种N水平:0和300 μM。)Fig. 3 Changes of NRA activity of Enteromorpha linza cultured at two different N availabilities(0 and 300 μM)and different Cu exposure (0, 0.5 and 2 μM). Means±SD (n=3).

表 1 在不同Cu处理(0,0.5和2μM)以及两种N水平(0和300μM)培养下缘管浒苔光合作用-光强响应曲线参数(N0、N300分别表示培养海水中的两种N水平:0和300μM;Cu0,Cu0.5,Cu2分别表示培养海水中的3种Cu离子水平:0,0.5和2μM)Tab. 1 Photosynthetic parameters of P-I curves for Enteromorpha linza cultured at two different N availabilities (0 and 300 μM)and different Cu exposures (0, 0.5 and 2 μM). Pmax, the maximum net photosynthetic rate[μmolO2·g(f.wt)-1·h-1]; α, the photosynthetic efficiency[(μmolO2·g(f.wt)-1·h-1) / (μmol·m-2·s-1)]; Ik, light saturation point(μmol·m-2·s-1). Means±SD (n=3).
在N加富的情况下,铜显著降低可溶性蛋白的含量,在2 μΜ铜处理下的含量最低。而在正常N水平下,只有高浓度的铜 ( 2 μΜ ) 显著降低可溶性蛋白的含量。N加富显著提高藻体在铜浓度为0和0.5 μΜ时的可溶性蛋白含量, 但在2 μΜ铜作用下却表现为相反的效应 ( 图 5 )。

图 4 在不同Cu处理(0,0.5和2 μM)以及两种N水平(0和300 μM)培养下缘管浒苔Chl a(A), Chl b (B)和类胡萝卜素(Car.)(C)的变化(图中N0、N300分别表示培养海水中的两种N水平:0和300 μM。)Fig. 4 Changes of contents of Chl a (A), Chl b (B) and Car. (C) in Enteromorpha linza cultured at two different N availabilities(0 and 300 μM)and different Cu exposures (0, 0.5 and 2 μM). Means±SD (n=3).
3 讨 论
铜显著降低了缘管浒苔的生长速率,并且随着浓度的增加抑制作用增大,这种效应在其它一些大型海藻种类中也得到了证实[7]。海水中的营养盐主要指无机态的氮 ( N ) 和磷 ( P ),海水中对海藻P的供应比较稳定、通常不成为海藻生长的限制营养盐,而N则是限制海藻生长的主要营养元素[12]。 因此在富营养化的海区,N的浓度显著提高,这在一定程度上提高了大型海藻的生长速率[13],本文结果也表明在N加富的情况下,缘管浒苔的生长速率得到显著的提高,但在高浓度铜作用下的藻体,富营养化却加剧了铜对生长的抑制,这体现了N与高浓度重金属铜的耦合效应。生长是细胞内生物化学和生理学过程的综合体现,从实验结果可以看到,富营养化和高浓度重金属铜共同作用的藻体,其光合作用能力、蛋白含量以及硝酸还原酶活性都显著低于正常N水平作用下的藻体,虽然N加富提高了光合色素的水平,但也同时降低了类胡萝卜素的含量,后者在过多光能的热耗散方面发挥重要的作用,其综合的结果是藻体的生长抑制率要明显高于正常N水平下的藻体。

图 5 在不同Cu处理(0,0.5和2 μM)以及两种N水平(0和300 μM)培养下缘管浒苔可溶性蛋白含量的变化(图中N0、N300分别表示培养海水中的两种N水平:0和300 μM。)Fig. 5 Changes of soluble protein contents in Enteromorpha linza cultured at two different N availabilities(0 and 300 μM)and different Cu exposures(0, 0.5 and 2 μM). Means±SD (n=3).
重金属铜对光合作用在很多大型海藻中都表现为抑制效应[3,4],但也有一些研究表明,虽然铜导致了生长速率的下降,但对光合作用却没有明显的影响[14],这说明藻体在积累碳水化合物方面没有受到铜的抑制,生长的抑制主要表现为由于细胞膜的损伤导致的细胞数目减少,或者是由于细胞的分裂受到抑制[15],这主要体现在DNA复制以及细胞壁的形成受到铜的抑制[16]。本文结果表明,铜对缘管浒苔的光合作用存在明显的抑制效应,尤其是在高浓度铜处理的情况下。而光合色素(Chla和Chlb)的含量并没有受到铜的影响,甚至还有一定的增加。虽然一些研究表明铜是通过降低光合色素的含量来下调光合作用能力的[3,17],但本实验的结果说明铜是通过抑制其他的生理过程来降低光合作用的,铜有可能损伤光反应中心,抑制光系统II中的电子传递从而导致光合作用能力下降[18,19]。N加富在一定程度上提高了缘管浒苔的光合作用能力,这与N加富提高藻体的光合色素含量有一定的关系,这在藻体的光合效率方面表现最为显著,色素含量的提高可以为藻体在低光的条件下获得更多的光能,从而提高光合作用能力。而在高浓度铜的作用下,虽然N加富显著提高了藻体的光合色素含量,但光合作用能力却显著下降,其中最有可能的原因就是N加富显著降低了类胡萝卜素的含量(图4C),类胡萝卜素和藻体过多光能热耗散中的叶黄素循环密切相关,类胡萝卜素含量的降低必然导致藻体的热耗散能力下降,在藻体内过多光能导致的活性氧(ROS)可以显著的破坏光系统反应中心,电子传递链组分受到损伤,从而导致光合作用的下降[20]。
除光合作用过程中产生的碳水化合物,藻体在生长的过程中还合成大量的蛋白质,蛋白质的合成和 N的供应有密切的关系,在海水中,NO3-是 N存在的主要形式,但如果要参与到藻体的N代谢过程,则必须转化为NH4+,其中硝酸还原酶起到重要的作用,它是整个过程中的限速酶,它的活性直接决定藻体利用N的能力[21]。我们结果表明N加富显著提高了蛋白的含量,这是因为在N加富的情况下,藻体的硝酸还原酶活性显著增加(图 3),这为藻体提供了大量的N源,从而使蛋白的含量显著增加。硝酸还原酶的活性在底物NO3-浓度增加的情况下升高的现象在一些实验中也得到证实[22]。但在高浓度铜的作用下,N加富却显著抑制了硝酸还原酶的活性,这样使藻体蛋白含量显著下降。而在较低浓度铜的作用下,正常海水N水平培养下藻体的硝酸还原酶活性显著增加,而在N加富的情况下则存在相反的结果。这些现象说明,N和铜这两种环境因素对藻体的硝酸还原酶活性存在耦合效应,它们之间彼此作用,浓度不同,效应也不同。
综上所述,富营养化通过提供更多的N源,促进了蛋白质和光合色素的合成,使藻体的光合作用能力增加,从而导致生长速率增加;重金属铜则通过降低藻体的光合作用速率以及蛋白含量抑制藻体的生长。当二者同时存在条件下,尤其在高浓度铜和富营养化的情况下,藻体的光合作用能力、硝酸还原酶活性、类胡萝卜素含量以及蛋白含量都显著下降,这导致生长的抑制最为显著。两种环境因素相互作用,不同的量导致不同的结果,它们之间的耦合作用的机制有待于进一步的研究。
[1] 林秋奇, 王朝晖, 杞 桑, 等. 水网藻(Hydrodictyon reticulatum)治理水体富营养化的可行性研究[J]. 生态学报, 2001, 21(5):814-819.
[2] 况琪军,马沛明,刘国祥,等.大型丝状绿藻对N、P去除效果研究 [J].水生生物学报,2004,28(3): 323-326.
[3] Küpper H, Šetlík I, Spiller M, et al.. Heavy metal-induced inhibition of photosynthesis: targets of in vivo heavy metal chlorophyll formation [J]. J Phycol, 2002, 38(3): 429-441.
[4] Nielsen H D, Brownlee C, Coelho S M, et al. Interpopulation differences in inherited copper tolerance involve photosynthetic adaptation and exclusion mechanisms inFucus serratus[J]. New Phytol, 2003, 160(1): 157-165 .
[5] Brown M T, Newman J E. Physiological responses ofGracilariopsis longissima(S. G. Gmelin) Steentoft, L.M. Irvine and Farnham (Rhodophyceae) to sublethal copper concentrations [J].Aquat toxicol, 2003, 64(2): 201-213.
[6] 雷清新,于志刚,张经,等. 铜对缘管浒苔生理状态的影响 [J].海洋环境科学, 1998, 17(1): 11-14.
[7] Eklund B T, Kautsky L. Review on toxicity testing with marine macroalgae and the need for method standardization–exemplified with copper and phenol [J]. Mar Pollut Bull, 2003, 46(2): 171-181.
[8] Jassby A D, Platt T. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton [J]. Limnol Oceanogr, 1976, 21(4): 540-547.
[9] Wellburn A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectro-photometers of different resolution [J]. J Plant Physiol,1994, 144(3): 307-313.
[10] Kochert G. Protein determination by dye binding. Handbook of Phycological Methods: Physiological and Biochemical Methods[M]. Hellebust JA, Graigie JS (eds.). Cambridge University Press.1978, Pp. 91-93.
[11] Chapman D J, Harrison P J. Nitrogen metabolism and measurement of nitrate reductase activity. (eds.) Lobban C S, Chapman D J,Kremer B P. Experimental Phycology: a Laboratory Manual [M].Cambridge University Press, 1988, 196-200.
[12] Villares R., Carballeira A. Nutrient limitation in macroalgae (UlvaandEnteromorpha) from the Rías Baixas (NW Spain) [J]. Mar Ecol, 2004, 25(3): 225-243.
[13] Neori A, cohen I, Gordin H. Ulva lactuca biofilters for marine fishpond effluents: II. Growth rate, yield and C: N ratio [J]. Bot Mar, 1991, 34(6): 483 - 489.
[14] Nielsen H D, Nielsen S L. Photosynthetic responses to Cu2+exposure are independent of light acclimation and uncoupled from growth inhibition in Fucus serratus (Phaeophyceae) [J]. Mar Pollut Bull, 2005, 51(8/12): 715-721.
[15] Corellou F, Bisgrove S R, Kropf D L, et al. A S/M DNA replication checkpoint prevents nuclear and cytoplasmic events of cell division including centrosomal axis alignment and inhibits activation of cyclin-dependent kinase-like proteins in fucoid zygotes [J].Development, 2000, 127(8): 1 651-1 660.
[16] Nielsen H D, Brown M T, Brownlee C. Cellular responses of developingFucus serratusembryos exposed to elevations concentrations of Cu2+[J]. Plant Cell Environ, 2003, 26(10):1 737-1 744.
[17] Ciscato M,Valcek R, van Loven K, et al. Effects of in vivo copper treatment on the photosynthetic apparatus of twoTriticum durumcultivars with different stress sensitivity [J]. Physiological Plantarum, 1997, 100(4): 901-908.
[18] Cid A, Herrero C, Torres E, Abalde J. Copper toxicity on the marine microalgaePhaeodactylum tricornutum: effects on photosynthesis and related parameters. Aquat Toxicol, 1995, 31(2): 165-174.
[19] Yruela I, Pueyo J J, Alonso P J, et al. Photoinhibition in photosystem II from higher plants [J]. J Biol Chem, 1996, 271(44):27 408-2 7415.
[20] Li X P, Björkman O, Shih C, et al. Rosenquist M, Jansson S, Niyogi K K. A pigment-binding protein essential for regulation of photosynthetic light harvesting [J]. Nature, 2000, 403(6768):391-395.
[21] Lopes P F, Oliveira M C, Colepicolo P. Diurnal fluctuation of nitrate reductase activity in the marine red algaGracilaria tenuistipitata(Rhodophyta) [J]. J Phycol, 1997, 33(2): 225- 231.
[22] Crawford N M, Arst N H J. Themolecular genetics of nitrate assimilation in fungi and plants [J]. Annu Rev Genet, 1993, 27(3):115-146.
Responses ofEnteromorpha linzato the copper exposure under different N growth conditions
XU Jun-tian1, ZOU Ding-hui2, ZHU-Ming1, GUO Gan-lin1, LI Xin-shu1, LIU Shu-xia1
(1. School of Marine Science and Technology, Huaihai Institute of Technology, Lianyungang, 222005, China;
2. The Key Lab of Pollution Control and Ecosystem Restoration in Industry Clusters of Chinese Ministry of Education,College of Environmental Science and Engineering, South China University of Technology, Guangzhou, 510006, China)
The ongoing coastal eutrophication and heavy metal pollution are becoming the question of marine environment with widespread concerns. The effects of copper exposure on the growth, photosynthesis, activity of nitrate reductase, pigments and soluble protein contents were investigated inEnteromorpha linzagrown at two different N availabilities. Our results showed that copper exposure both inhibited the relative growth rate (RGR) ofEnteromorpha linzaunder two different N growth conditions. The inhibition of the RGR increased with increasing level of copper concentrations. N-enrichment stimulated the growth of thalli under all copper exposure except for the highest level copper tested (2 μM). The photosynthetic rate and the activity of nitrate reductase of the thalli significantly decreased under N-enrichment and high level copper condition. N-enrichment significantly increased the contents of soluble protein of the thalli, but copper inhibited the synthesis of the protein and the lowest protein content was found in thalli cultured under N-enrichment and high level copper treatment.
Enteromorpha linza;copper;N;photosynthesis;relative growth rate
Q945.79
A
1001-6932(2010)06-0643-06
2010-06-09 ;收修改稿日期:2010-10-25
国家自然科学基金项目 (30970450);教育部“新世纪优秀人才支持计划”(NCET-10-0375);连云港市发展项目 (SCH0810)
徐军田(1979—),男,博士,讲师,主要从事大型海藻生理生态的研究,电子邮箱:xjtlsx@126.com。
邹定辉,教授,电子邮箱:dhzou@scut.edu.cn。

