冷适应对一株植物乳杆菌膜脂肪酸组成和膜蛋白表达的影响
王胜男,王淼
(1.东北农业大学 乳品科学教育部重点实验室,哈尔滨 150030;2.黑龙江省乳品工业技术开发中心,哈尔滨 150086)
冷适应对一株植物乳杆菌膜脂肪酸组成和膜蛋白表达的影响
王胜男1,2,王淼2
(1.东北农业大学 乳品科学教育部重点实验室,哈尔滨 150030;2.黑龙江省乳品工业技术开发中心,哈尔滨 150086)
从15株乳杆菌中筛选出一株冷敏感性较高的菌株(植物乳杆菌KLDS1.0703),研究冷适应对该株菌细胞膜脂肪酸组成和膜蛋白表达的影响。根据生长速率与温度(开氏温度)相关性的Arrhenius曲线及冷适应时间对存活率的影响,确定该菌株的冷适应条件为:培养至对数中期,10℃冷适应处理4 h。应用GC/MS分析冷适应前后菌体的膜脂肪酸组成发现,脂肪酸18:1△9c的结构中不饱和键由反式转变为顺式;应用双向电泳分析冷适应前后菌体的膜蛋白质组成,分析找到23个差异表达的蛋白点,其中3个为特异表达蛋白质点。结果表明,冷适应处理诱导植物乳杆菌KLDS1.0703膜脂肪酸结构向熔点降低方向转变,而且膜蛋白质出现特异性表达。
植物乳杆菌;冷适应;细胞膜脂肪酸;细胞膜蛋白
0 引 言
据报道,对乳杆菌预先进行冷适应处理能够提高细胞在冷冻条件下的存活率[1]。菌体对冷适应或冷应激应答,发生适应性调节,导致细胞膜脂肪酸和膜上蛋白质表达变化,进而降低冷对细菌造成的伤害[2]。而细胞膜脂肪酸改变方式以不饱和度增加、碳链长度降低、甲基分支增加、出现甲基异构分支结构等为主[3]。
国内的学者研究发现,细胞脂肪酸和蛋白质的改变有利于细菌的低温存活[4-6]。并且从基因角度证实了冷诱导蛋白能够提高菌体的抗冻特性[7]。
本研究以一株冷敏感性较高的菌株作为试验菌株。通过冻-融实验确定最佳的冷适应条件。应用GC/MS分析及双向凝胶电泳方法,研究冷适应处理对试验菌株细胞膜脂肪酸组成和细胞膜蛋白质表达的影响。该研究可为阐明乳杆菌冷冻抗性机理奠定基础。
1 材料和方法
1.1 材料
供试菌株和培养基:植物乳杆菌(KLDS1.0702,KLDS1.0703,KLDS1.0704,KLDS1.0706,KLDS1.0708,KLDS1.0714,KLDS1.0715,KLDS1.0717,KLDS1.0724,KLDS1.0725,KLDS1.0728);嗜酸乳杆菌(KLDS1.0701,KLDS1.0732,KLDS1.0738);干酪乳杆菌1.0720。
主要仪器:高速冷冻离心机(GL-21M型),混匀器(VORTE-5型),超声波破碎仪(JY92-ⅡD型)恒温磁力搅拌器(HJ-3型),气-质联用仪(6890-5973N),双向凝胶电泳系统。
1.2 乳杆菌冻-融后存活率的测定
15株乳杆菌分别以3%接种量接种至10mL MRS培养基中,37℃培养至对数中期,调整细胞终菌数为107mL-1;离心(5 000 g,4℃,离心15 min)收集菌体,所获菌体用PBS缓冲液清洗2次,离心,弃上清,收集菌体,悬浮于质量分数为0.9%生理盐水中制成菌的悬浮液,以1 mL的量分装至冻存管中,然后迅速于-20℃放置24 h后,取出于25℃水浴解冻5 min,采用标准平板菌落计数方法测定冻-融前后的活菌数,计算冻-融后的存活率。
1.3 冷适应处理条件的确定
以上述试验获得的冻-融后存活率最低的菌株为试验菌株,确定冷适应处理条件。
试验菌株Arrhenius曲线的建立:测定试验菌株在不同温度下的生长曲线。根据实验室实际条件,在7~46℃温度范围内每间隔2℃选取1个测试温度点,共选取14个温度点。在不同培养温度下,测定试验菌株的生长曲线,选择对数生长中期测定的OD值对时间作图,得到直线斜率为k,再分别计算Ln(k),以Ln(k)对绝对温度的倒数(1/T)作图,获得试验菌株的Arrhenius曲线。
冷适应处理条件的确定:根据Arrhenius曲线确定的冷适应临界温度点,分别将10 mL培养至对数中期的培养物置于临界点以下的不同试验温度下,保持4 h,冷适应处理后的菌体经冻-融后,计算其存活率,以不经冷适应处理的菌体为对照。选择存活率最高的条件作为冷适应处理条件。
1.4 细胞膜脂肪酸组成的分析
1.4.1 细胞膜脂肪酸的提取
取约1 g的试验菌株的菌体,加入7 mL甲醇:氯仿(2∶1,体积比)混合溶液。室温条件下涡旋2 h,迅速置于4°C条件下放置24 h,取出后5 000 g(4℃)条件下离心15 min,收集上清液备用;沉淀用3.75 mL甲醇∶氯仿∶水(2∶1∶0.8,体积比)混合溶液润洗,5 000 g(4℃)条件下离心15 min收集上清液备用。将前面两次离心所得上清液合并,在其中加入5 mL、4℃预冷的水∶氯仿(1∶1,体积比)转换为双向体系。用移液管移出氯仿(下相),此相包括细胞膜脂,迅速氮吹蒸发溶剂,获得约50 μL的细胞膜脂,迅速加入1 mL(4℃)预冷的氯仿∶甲醇(1∶1,体积比)混合溶液,样品于-20°C保存备用。
1.4.2 脂肪酸甲酯化
将所得细胞膜脂肪酸样品重新氮吹,蒸发除去氯仿∶甲醇(1∶1,体积比)混合溶液,加入3 mL氢氧化钾的甲醇溶液,70℃水浴回流5 min。冷却后加入1 mL三氟化硼乙醚溶液70℃水浴回流5 min,冷却。加入3 mL正己烷提取3次。合并提取液,用甲醇润洗,移除上层溶液。加入饱和氯化钠,放置3~5 min,氮气吹干,1 mL正己烷定容,获得脂肪酸甲酯待测样品。
1.4.3 脂肪酸分析
气相色谱分析条件:采用HP-5弹性石英毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度250℃,载气为高纯氦气,柱流速1 mL/min,柱前压73.0 kPa,柱起始温度70℃,保持2 min,以5℃/min升至230℃,保持20 min,再以5℃/min升至280℃,保持15 min,分流进样1 μL,分流比20∶1。
质谱分析条件:用电子轰击源(EI)分析,电子能量70 eV,离子源温度200℃,接口温度250℃,选取全程离子碎片扫描(SCAN)模式,质量扫描范围40~650,溶剂延迟3.5 min。
1.5 细胞膜蛋白质表达谱分析
1.5.1 细胞膜提取
冷适应处理前后的试验菌株的菌体养至对数中期,离心(5 000 g,4℃,15 min),收集到的菌体在PBS中清洗2次,再离心(5 000 g,4℃,15 min)。 将收集到的菌体均匀分散于质量分数为0.001%的PMSF的缓冲液[Tris–HCl(20 mmol/L),pH=7,EDTA(1 mmol/L)]中,超声波破碎(破碎条件:工作5 s,间歇15 s,功率800 W)15 min,用革兰氏染色的方法观察细胞破碎程度,然后10 000 g(4℃)条件下离心5 min,弃沉淀,上清以75 000 g(4℃)条件离心30 min,沉淀(菌膜)溶于1 mL缓冲液中,放入-80℃保存备用。
1.5.2 膜蛋白样品的制备
样品室温融解后,重悬于IEF缓冲液(浓度为8 mol/L尿素,质量分数0.02%的CHAPS,浓度为0.02 mol/L的DTT,质量分数为0.05%的IPG)中,充分放置,使样品充分融解,呈透明状态。采用Bradford方法测定蛋白浓度。
1.5.3 双向电泳及图像分析
IPGphor第一向等电点共聚焦电泳采用pH值为4~7的18 cm长IPG预制胶条,第二向SDS-PAGE(13.0%)按每一胶条40 mA电泳40 min后换用60 mA电泳5 h,银染,采用ImageScanner光密度扫描仪扫描,并经ImageMasteTM2D Platinum6.0软件分析蛋白质表达谱。
2 结果与分析
2.1 乳杆菌冻-融后的存活率
15株乳杆菌经冻-融后,其存活率如图1所示,根据其存活率可以获得对冷敏感的菌株。15株菌中,植物乳杆菌KLDS1.0703的存活率最低,为20.25%,该菌对冻-融最敏感,因此选用该菌为实验菌株进行下面的试验。

2.2 冷适应处理条件的确定
根据不同生长温度条件下植物乳杆菌KLDS1.0703的生长速度,可以建立该菌的Ahrrenius曲线(图2),在此曲线上可直接获得热适应、冷适应临界温度值以及最适合生长的温度区域,进而确定冷适应温度范围。
由图2可以看出,温度对植物乳杆菌KLDS1.0703生长的影响有两个拐点,分别为37℃和16℃,这两个拐点将曲线分为3个区间,其中37~16℃区间为最适生长温度区间,此温度区间活化能基本恒定,表明此区间温度对菌株KLDS1.0703生长速度不存在显著性影响,且相对于其他培养温度,37℃生长速率最高;在37~46℃区间,Ln(k)随温度的升高而降低,37℃为热适应临界温度;在37~7℃区间,Ln(k)随温度的降低而降低,其中16℃为冷适应临界温度,因此冷适应处理应在此温度以下。

根据实验室实际条件,选择16,13,10,7℃作为菌株KLDS1.0703冷适应处理温度,分别处理4 h后,菌体再经冻-融处理后的存活率如图3所示。由图3可以看出,10℃处理4 h后,菌体经冻-融处理后的存活率最高,为71.94%,因此确定该菌株的冷适应条件为:培养至对数中期,10℃冷适应处理4 h。

2.3 冷适应对植物乳杆菌膜脂肪酸组成的影响
通过GC-MS法测定了植物乳杆菌KLDS1.0703冷适应前后菌体细胞膜脂肪酸的组成,如图4所示。

通过SPSS 13.0软件分析获得冷适应前菌体细胞膜不饱和脂肪酸质量分数为55.21%,饱和脂肪酸质量分数为44.75%,不饱和脂肪酸与饱和脂肪酸的比例为为123.37%。在10℃条件下适应4 h后的冷适应菌体,其细胞膜不饱和脂肪酸质量分数上升至56.92%,而饱和脂肪酸质量分数下降为44.75%,不饱和脂肪酸与饱和脂肪酸的比例(U/S)为127.20%(表1)。结果表明:冷适应处理并未显著影响该菌株的细胞膜饱和脂肪酸与不饱和脂肪酸的比例。
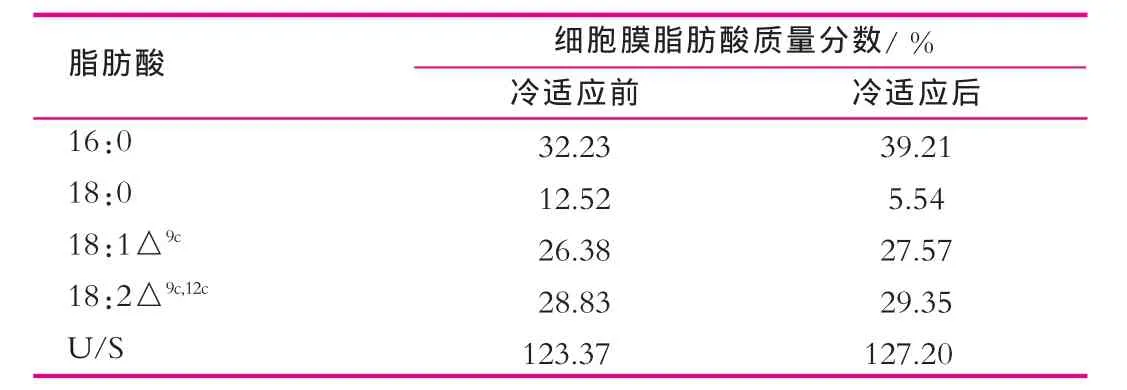
表1 冷适应对植物乳杆菌KLDS 1.0703细胞膜脂肪酸组成的影响
由表1可以看出,饱和脂肪酸16:0的质量分数增加了6.98%,18:0的减少了6.98%。此结果表明:在此冷适应条件下,植物乳杆菌KLDS 1.0703细胞膜饱和脂肪酸向短链脂肪酸转化,进而使熔点降低。
图5为冷适应处理前后菌体细胞膜脂肪酸中的18:1△9c的棒状质谱图。 由图5(a)可以看出,冷适应处理前菌体的18:1△9c的结构中不饱和键为反式;图5(b)中,冷适应处理后菌体的18:1△9c的结构中不饱和键为顺式。同一脂肪酸,顺式不饱和脂肪酸比反式不饱和脂肪酸熔点更低。因此可推测:冷适应过程中,细胞膜脂肪酸的结构发生改变,以减低熔点,进而增强菌株对冷的耐受力。
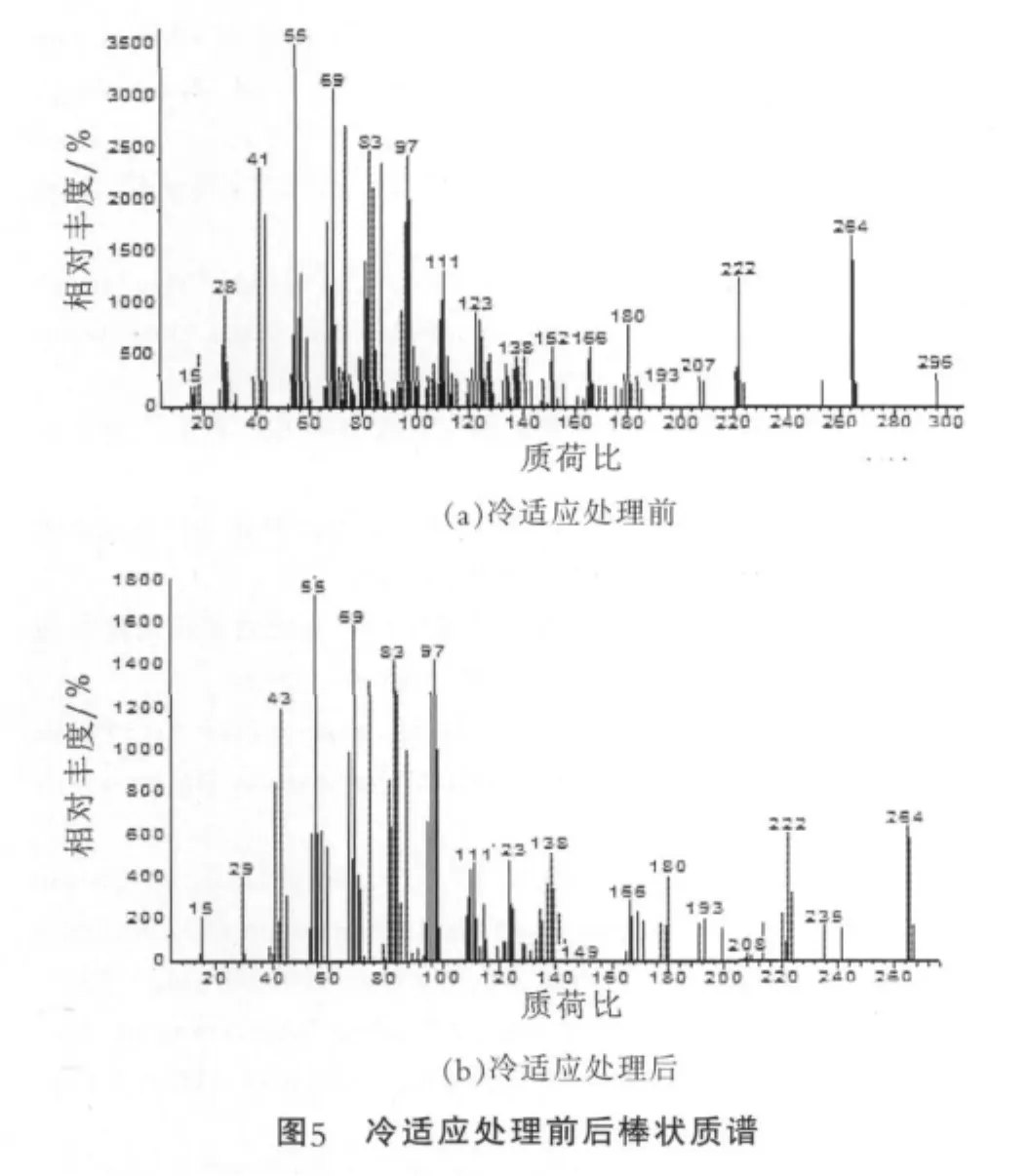
2.3 冷适应对植物乳杆菌膜蛋白质表达的影响
采用BCA试剂盒测定得到,提取的植物乳杆菌KLDS1.0703冷适应前后菌体膜蛋白质质量浓度分别为7000 mg/L和7060 mg/L,此蛋白质浓度符合制备双向凝胶电泳18cm胶条样品的需要。应用ImageMasterTM2D Platinum 6.0软件对蛋白质表达谱分析,在冷适应处理菌体的2次重复胶上分别检测到812和801个蛋白点,平均有806个蛋白点;在未经冷适应处理菌体的2次重复胶上分别检测到890和875个蛋白点,平均有882个蛋白点。两胶匹配相关系数为0.863,匹配效果较好(图6)。

冷适应菌体图谱与未经冷适应的对照菌体图谱匹配的蛋白点的相对体积值进行求熵运算,以3.5倍为标准,比值大于3.5(且蛋白点轮廓清晰)的即为认定的在冷适应后差异表达的蛋白点。经过分析找到23个差异表达的蛋白点(图7)。
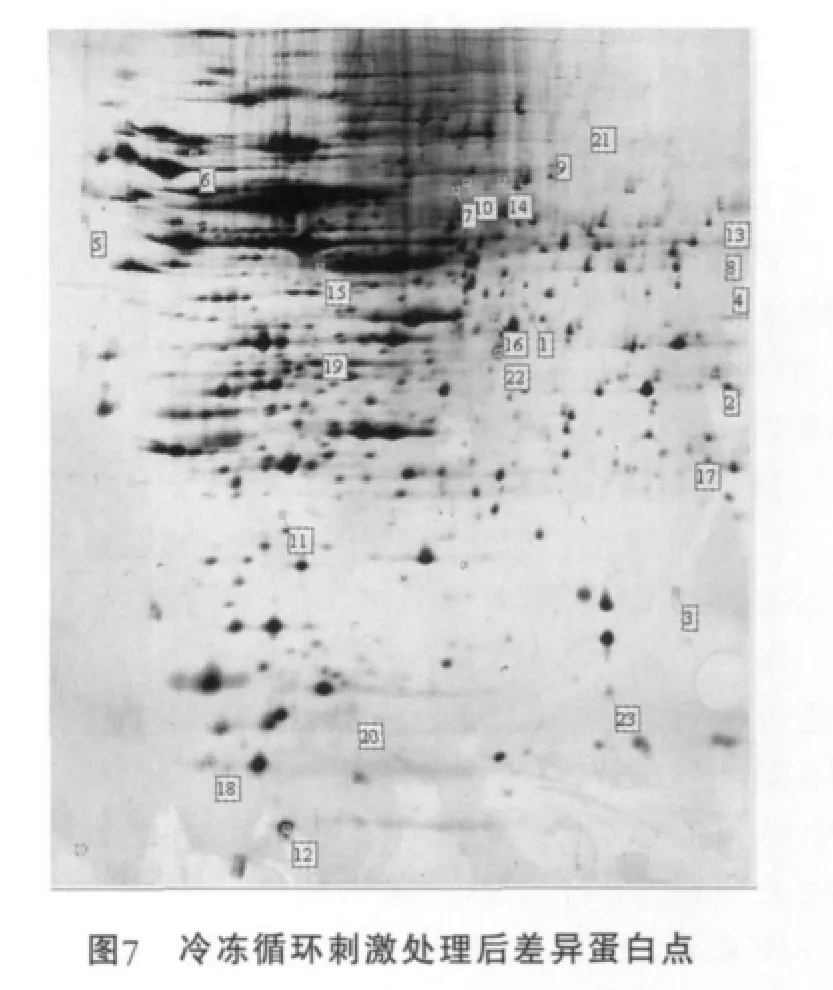
在凝胶的报告中分别找出这些差异表达的蛋白点的相对体积值,根据处理组与对照组图谱中同一蛋白点的相对体积值的差异可以确定蛋白点的表达变化情况。将处理组图谱中的23个蛋白点对应的相对体积值的平均值 (2次重复凝胶中同一蛋白点相对体积作均值运算得到的结果)与对照组的20个蛋白点对应的相对体积的平均值比较作图(图8)。结果显示,蛋白点5,6,12,15,16,19,20上 调 表 达 ; 蛋 白 点4,7,8,9,10,11,13,14,17,18,21,22,23下调表达;蛋白点1,2,3只在冷适应处理胶上出现为特异表达。下调表达的蛋白点较上调表达的蛋白点多,说明冷冻适应对细胞膜上某些蛋白表达有抑制作用,同时也诱导产生新的蛋白。
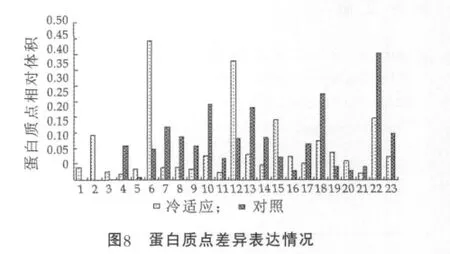
3 讨 论
3.1 冷适应处理对脂肪酸组成的影响
对单增李斯特氏菌(Listeria monocytogenes)的研究发现,冷适应处理后短链脂肪酸显著增加[8],且冷冻抗性增强;嗜酸乳杆菌(Lactobacillus acidophilus CRL 640)冷适应处理后,冷冻抗性增强,不饱和脂肪酸(C18:2)比例显著增加[9];对嗜酸乳杆菌(Lactobacillus acidophilus RD758)进行冷适应处理后,不饱和脂肪酸增加的同时,产生cycC19:0脂肪酸[10];对瑞士乳杆菌(Lactobacillus helveticus)和旧金山乳杆菌(Lactobacillus sanfranciscensis)冷适应处理后,发现存在cycC19:0脂肪酸,同时获得细胞分子流动性或膜物理化学性能的适应性变化主要取决于短链脂肪酸的结论[11]。上述研究结果初步表明,不同菌株冷适应处理后,脂肪酸结构变化并不一致,但都向着熔点降低方向转变。
本研究中并未出现不饱和脂肪酸比例、脂肪酸碳链长度的改变以及出现cycC19:0脂肪酸等的显著变化,但脂肪酸18:1△9c的结构中,不饱和键由反式转变为顺式,同时冷冻抗性显著增强。
3.2 细胞膜蛋白质差异表达
乳酸菌膜蛋白质不同于嗜冷菌的膜蛋白质,嗜冷菌能够在低温条件下保持结构上的完整性和催化功能。当生长温度突然降低时,乳酸菌细胞会合成一组冷适应性蛋白[12],维持细胞正常生物学功能的发挥[13],进而提高乳酸菌对冷的耐受力,增加存活率。双向凝胶电泳可有效地分离细胞膜蛋白质[14],在本研究的对照胶上出现3个特异表达蛋白质点,其分子量显著高于冷休克蛋白,因此不属于冷休克蛋白,对其特异表达的特性及功能有待深入研究。
4 结 论
本试验通过比较15株乳杆菌的冷敏感性,获得一株对冷较为敏感的植物乳杆菌KLDS1.0703,通过冷适应处理,该菌对的冷敏感性显著降低;冷适应处理并未导致该菌细胞膜的不饱和脂肪酸与饱和脂肪酸比例出现显著差异,但是其脂肪酸18:1△9c的结构中不饱和键由反式转变为顺式,有利于降低该菌的冷敏感性;且冷适应处理后该菌细胞膜蛋白质表达出现差异,出现特异性表达蛋白质。
[1]LEILA B,CATHY F G,DANIEL A,et al.Study of the Cryotolerance of Lactobacillus acidophilus:Effect of Culture and Freezing Conditions on the Viability and Cellular Protein Levels[J]?.?International Journal of Food Microbiology,2000,59(3):241-247.
[2]NICHOLAS J R.Bacterial Membranes:the Effects of Chill Storage and Food Processing[J].International Journal of Food Microbiology,2002,79:27–34.
[3]曹军卫,沈萍,李朝阳.嗜极微生物[M].武汉:武汉大学出版社,2004:82-84.
[4]VIGH L,MARESCA B,HARWOOD J L.Does the Membrane’s Physical State Control the Expression of Heat Shock and Other Genes[J].Trends Biochem Sci.,1998.23:369-374.
[5]陈贵元,魏云林.冷适应微生物的研究现状与应用前景[J].大理学院学报,2008,7(4):82-84.
[6]李晶,王继华,崔迪,等.嗜冷菌适冷代谢机制的研究[J].哈尔滨师范大学学报:自然科学版,2007,23(5):88-91.
[7]张英华,雷雨婷,霍贵成.乳酸乳球菌中冷休克蛋白基因的高效表达及其抗冻保护作用[J].微生物学报,2008(9):27-30.
[8]SOFIA K M,ARVANITIS N.Cold Dependence of Fatty Acid Profile of Different Lipid Structures of Listeria Monocytogenes[J].Food Microbiology,2005(22):213–219.
[9]FERNANDEZ M L,MURGA G M C,et,al.Influence of Growth Temperature on Cryotolerance and Lipid Composition of Lactobacillus acidophilus[J].Journal of Applied Microbiology,2000(88):342–348.
[10]WANG Y,JEROME D.Influence of Cooling Temperature and Duration on Cold Adaptation of Lactobacillus acidophilus RD758[J].Cryobiology,2005,50(3):294-307.
[11]CHIARA M,SYLVAIN L.SADO K,et al.Synthesis of Cyclopropane Fatty Acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and Their Cellular Fatty Acids Changes following Short Term Acid and Cold Stresses[J].Food Microbiology,2010,27(4):493-502.
[12]RYOSUKE M,MIHO M.Very Rapid Induction of a Cold Shock Protein by Temperature Downshift in Thermus thermophilus[J].?Biochemical and Biophysical Research Communications,2010,399(3):336-340.
[13]刘志恒.现代微生物学[M].科学出版社.2002:475-476.
[14]MARTIN V,DERR K D,et.al.A High-Throughput Strategy to Screen 2D Crystallization Trials of Membrane Proteins[J].Journal of Structural Biology,2007,160(3):295-304.
Influence of cold adaptation on composition of membrane fatty acids and membrane proteins for Lactobacillus plantarum
WANG Sheng-nan1,2,WANG Miao2
(1.Key Lab of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbinn 150030,China;2.National Research Centre for Dairy Eng and Tech,Harbin 150086,China)
Abstrac:A most cold-sensitive strain was screened from 15 Lactobacilli strains(Lactobacillus plantarum KLDS1.0703).The objective of this paper is to investigate the influence of cold stimulation on the membrane fatty acids compositions and membrane protein expression of this strain.Lactobacillus plantarum KLDS1.0703 was most freeze-thaw sensitive among 15 strains.The condition of cold adaptation was that mid-logarithmic strain was cultured at 10℃for 4 h according to the Arrhenius curve and the survival rate of this strain.The membrane fatty acid were analyzed with GC/MS,and the unsaturated bond was transferred from the cis to trans for 18:1△9cunsaturated fatty acids.Analysis of 2D-EF gels revealed that there are 23 differentia protein spots and 3 specific expression protein spots after cold adaptation.It can be suggested that the structure of unsaturated fatty acids transform high to low melting point was stimulated by cold adaptation for L.plantarum KLDS1.0703,and specific expression protein spots were appeared.
Lactobacillus plantarum;cold adaptation;the membrane fatty acids;protein spots
Q93-33
A
1001-2230(2011)08-0018-05
2011-04-10
王胜男(1982-),女,硕士,研究方向为畜产品加工。

