无花果叶补骨脂素对体外培养瘢痕疙瘩成纤维细胞的影响Δ
王涛,陶如,李清华,高永峰,周成军,刘金成
(1.泰山医学院基础医学部生物化学教研室,泰安市 271000;2.泰山医学院临床医学部,泰安市 271000;3.泰山医学院附属医院,泰安市 271000;4.泰山医学院药学院药学综合实验室,泰安市 271000;5.山东大学第二医院,济南市 250033;6.青岛大学医学院生物学教研室,青岛市 266021)
无花果叶补骨脂素对体外培养瘢痕疙瘩成纤维细胞的影响Δ
王涛1*,陶如2,李清华3,高永峰4,周成军5,刘金成6
(1.泰山医学院基础医学部生物化学教研室,泰安市 271000;2.泰山医学院临床医学部,泰安市 271000;3.泰山医学院附属医院,泰安市 271000;4.泰山医学院药学院药学综合实验室,泰安市 271000;5.山东大学第二医院,济南市 250033;6.青岛大学医学院生物学教研室,青岛市 266021)
目的:研究无花果叶补骨脂素(FLP)对瘢痕疙瘩成纤维细胞的生长抑制作用。方法:用FLP处理体外培养的成纤维细胞后进行细胞形态学检测,通过细胞增殖试验(MTT法)和流式细胞仪检测FLP对成纤维细胞增殖和凋亡的影响;氯胺T法检测FLP对成纤维细胞胶原蛋白合成的抑制作用;Western-bloting检测凋亡相关蛋白Bcl-2的表达。结果:经FLP处理后,成纤维细胞增殖活性降低,凋亡指数升高(P<0.01),凋亡相关蛋白Bcl-2表达被抑制,同时胶原蛋白的合成受到抑制。结论:FLP对瘢痕疙瘩成纤维细胞增殖的抑制和诱导其凋亡作用可能是通过抑制凋亡相关蛋白Bcl-2的作用来实现的。
无花果叶;补骨脂素;瘢痕疙瘩;成纤维细胞;增殖;凋亡
瘢痕疙瘩是一种以胶原纤维等细胞基质过度产生和沉积为特征的皮肤纤维化疾病,在皮肤修复过程中成纤维细胞持续活化所产生的细胞外基质(ECM)成分,如纤连蛋白、弹性蛋白、蛋白聚糖,尤其是胶原蛋白的过度堆积,从而导致真皮的持久纤维化[1]。抑制成纤维细胞的增殖,诱导其凋亡,以及抑制胶原蛋白的合成,是瘢痕疙瘩治疗的重点。无花果属于桑科无花果属植物(Ficus caricaL.),是目前研究较多的药食兼优的植物。无花果叶所含的主要成分补骨脂素可通过破坏线粒体、减少细胞的能量供应、抑制核酸及蛋白质的合成、降低有关酶的活性等途径,起到抑制多种肿瘤增殖、抗病毒、抗菌的作用[2~4]。但目前尚未有无花果叶补骨脂素(FLP)抑制瘢痕疙瘩成纤维细胞的报道。本研究利用不同剂量的FLP,通过体外试验观察其对瘢痕疙瘩成纤维细胞的作用,以及对其胶原合成的影响,并进一步探讨其作用机制,为其治疗瘢痕疙瘩提供理论基础。
1 仪器与材料
1.1 仪器
3k30 型高速冷冻离心机(德国Sigma公司);MDF-1156型超低温冰箱、CO2细胞培养箱(日本三洋公司);Bryte型流式细胞仪、iMark型酶标仪、凝胶成像系统(美国Bio-Rad公司);超纯水系统(法国Millipore公司);CKX31型倒置相差显微镜(日本Olympus公司)。
1.2 试药
FLP(由泰山医学院药学院从无花果叶中提取和制备,浓度:5mg·mL-1);青霉素(批号:091107)、链霉素(批号:090412)均由华北制药集团提供;DMEM培养液(美国Gibco公司);小牛血清(杭州四季青生物材料工程公司);Trizol(美国Gibco Brl公司);鼠抗人Bcl-2单克隆抗体(美国R&D公司)。
1.3 瘢痕疙瘩成纤维细胞
标本取自泰山医学院附属医院普外科从瘢痕疙瘩患者手术切取的瘢痕组织。取材部位:前胸、耳垂等;患者年龄:11~28岁;瘢痕生长时间:1~2年。所有患者均无其他器质性疾病,未作过特殊治疗及激素治疗,均经过临床和病理诊断证实。
2 方法
2.1 细胞培养
在手术室无菌条件下将手术切下的病理性瘢痕及周围正常组织小心去除表皮及皮下脂肪组织,然后在超净工作台上用眼科剪刀将组织剪成大小约0.5~1mm3的小块,加入少量小牛血清,接种于培养瓶中,在95%空气、5%CO2、37℃、饱和湿度条件下培养24h,使组织块牢固贴附于瓶壁。然后加入适量含20%小牛血清、100U·mL-1青霉素、100µg·mL-1链霉素的DMEM培养液继续培养,每周2次换液。约3~4周,原代培养细胞生长成细胞单层。用0.25%胰蛋白酶消化以后,以1∶2的比例传代培养。每隔2天用含10%小牛血清的DMEM培养液换液1次,待细胞铺满瓶底后传代。试验选用3~10代细胞。
2.2 MTT法检测细胞抑制率
纤维细胞用0.25%胰蛋白酶消化,收集细胞悬液,调整浓度为5×105·mL-1,接种于96孔板内,每孔0.2mL。每个样本设4个复孔。置培养箱内孵育,待细胞完全贴壁后更换为含FLP的培养液(FLP溶解于二甲亚砜(DMSO)液中,贮存浓度为5mg·mL-1),终浓度分别为0.01、0.1、1、10、100、1000μmol·L-1,重复10孔,另设不加FLP的最高浓度DMSO液(20μg·mL-1)作空白对照组。置培养箱中孵育48h后,每孔加入20μLMTT(5mg·mL-1)继续孵育4h,之后每孔加入100μL 20%十二烷基硫酸钠(SDS)有机溶剂,孵育20h后于490nm波长处用酶标仪测吸光度(D)值。按抑制率=1-试验组D值/空白对照组D值×100%计算,并用Probit回归法[5]估算半数抑制浓度(IC50)值。
2.3 凋亡细胞形态变化
取对数生长期的成纤维细胞接种于2.5cm培养皿中培养,待细胞贴壁后,用10μmol·L-1FLP处理细胞,空白对照组不处理;于加FLP 12、24、48h后,倒置相差显微镜观察细胞形态和凋亡情况并照相。
2.4 流式细胞仪观察细胞凋亡
将处于对数生长期的成纤维细胞接种于25cm2细胞瓶中,待培养24h细胞贴壁后,用10μmol·L-1FLP处理细胞,分别于12、24、48、72h 后终止培养,制成单细胞悬液浓度为 1×106·mL-1,再以1000r·min-1离心5min,PBS洗涤3次,加入70%冷乙醇2mL固定,用流式细胞仪检测细胞凋亡率。
2.5 Western-blotting检测凋亡相关蛋白Bcl-2的表达
将处于对数生长期的成纤维细胞接种于25cm2细胞瓶中,待细胞贴壁后设空白对照组与试验组,分别进行处理,转染24h后收集细胞,用PBS洗涤3次,加1×SDS加样缓冲液(50mmol·L-1Tris(pH 6.8)、1000mmol·L-1DTT、2%SDS、0.1%溴酚蓝、10%甘油)裂解细胞2min,收集上述裂解液,并置100℃沸水中水浴5min,以测定蛋白浓度。进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)[5],然后将蛋白电转移到硝酸纤维素膜上,先封闭,再加入鼠抗人Bcl-2抗体(1∶200)过夜,PBS洗涤3次;加入生物素标记的羊抗鼠二抗(1∶1000),室温振荡1h,PBS洗涤4次,每次10min;加入卵白素-生物素化辣根过氧化物酶,孵育15min;PBS洗涤3次,DAB显色,约5~10min。
2.6 瘢痕疙瘩成纤维细胞胶原测定(氯胺T法)
配制标准羟脯氨酸(Hyp)应用液、柠檬酸缓冲液、0.05mol·L-1氯胺 T 溶液、3.15mol·L-1过氯酸溶液、10%对二甲氨基苯甲醛溶液。消化单层培养细胞,以2×105·mL-1接种于25cm2的培养瓶中,待细胞贴壁后设空白对照组与试验组。空白对照组换液,试验组则弃去原培养液,用10μmol·L-1FLP处理细胞,观察12、24、48、72h。每个时间段分别收集细胞,经处理后上机检测。以Hyp的浓度为测量对象,间接推算胶原含量。取上清液0.5mL,经一系列反应后在紫外分光光度计下560nm波长处比色测量。计算公式如下:样品Hyp浓度(μg·mL-1)=所测Hyp液浓度×稀释倍数/标准Hyp液浓度。
2.7 统计学方法
所有试验数据以±s表示。细胞增殖试验资料用方差分析处理,其他试验数据用卡方检验、Probit回归法处理。P<0.05认为差异有显著性。
3 结果
3.1 MTT法检测细胞抑制情况
将试验用成纤维细胞以1.0×105·mL-1密度接种于96孔培养板中,每孔100pL,37℃、5%CO2孵箱中培养至细胞贴壁,加入FLP,使其终浓度为分别为0.01、0.1、1、10、100、1000μmol·L-1,重复10孔。分别于37℃、5%CO2孵箱中培养48h后,每孔加入MTT(3mg·mL-1)20pL,继续培养4h。吸弃培养基,加入MTT裂解液100pL,37℃、5%CO2孵箱中孵育18h。待紫色结晶完全溶解后(约20h),于490nm波长处用酶标仪测D值,计算抑制率和IC50。经5次以上试验观察不同时段的FLP对瘢痕组织成纤维细胞增殖是否有抑制或促进作用。结果表明,10、100、1000μmol·L-1FLP能抑制瘢痕组织成纤维细胞的增殖,其D值与空白对照组比较,均有显著性差异(P<0.01)。FLP对瘢痕组织成纤维细胞抑制的影响见表1。
表1 FLP对瘢痕组织成纤维细胞抑制的影响(±s,n=5)Tab1 Inhibition of FLPon keloid fibroblast(s±s,n=5)

表1 FLP对瘢痕组织成纤维细胞抑制的影响(±s,n=5)Tab1 Inhibition of FLPon keloid fibroblast(s±s,n=5)
与0浓度比较:*P<0.01vs.zero concentration:*P<0.01
c/μmol·L-1-0.010.11101001000D值1.601±0.1521.571±0.0231.538±0.0601.491±0.0131.433±0.123*0.841±0.064*0.156±0.011*抑制率/%02.04.07.010.646.589.8
3.2 成纤维细胞形态学变化
取10μmol·L-1FLP1mL,置细胞培养瓶中,于24、48、72h通过倒置相差显微镜观察成纤维细胞形态变化并与空白对照组比较。结果,试验组成纤维细胞数目减少,体积变小,胞浆量减少,排列紊乱,与邻近细胞接触减少,突起变短变少,细胞明显皱缩,少见细胞分裂。空白对照组细胞形态正常,胞体呈梭形,细胞核大小及染色均匀,胞浆丰富,细胞间有突起相连,折光性强。FLP处理后成纤维细胞形态变化见图1。
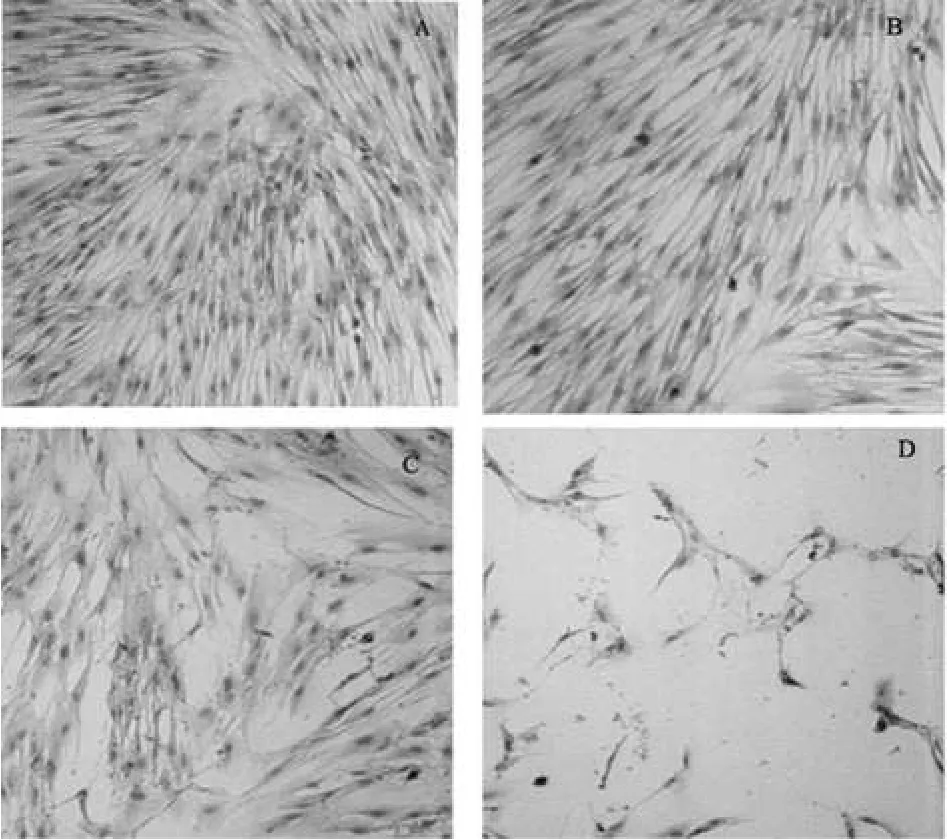
图1 FLP处理后成纤维细胞形态变化A.空白对照;B.FLP 10µmol·L-124h;C.FLP 10µmol·L-148h;D.FLP 10µmol·L-112hFig1 Morphology of keloid fibroblasts treated with FLPA.blank control;B.FLP 10µmol·L-124h;C.FLP 10µmol·L-148h;D.FLP 10µmol·L-112h
3.3 流式细胞仪检测细胞凋亡
流式细胞仪检测显示,FLP作用12、24、48、72h和空白对照的抑制率分别为(5.88%±1.54%)、(7.04%±1.80%)、(8.21%±1.47%)、(10.84%±3.90%)、(3.02%±1.22%)。FLP对成纤维细胞有明显抑制作用,随作用时间的增加成纤维细胞出现亚二倍体小峰,提示FLP可促进细胞凋亡(P<0.05)。FLP对成纤维细胞凋亡的影响见图2。
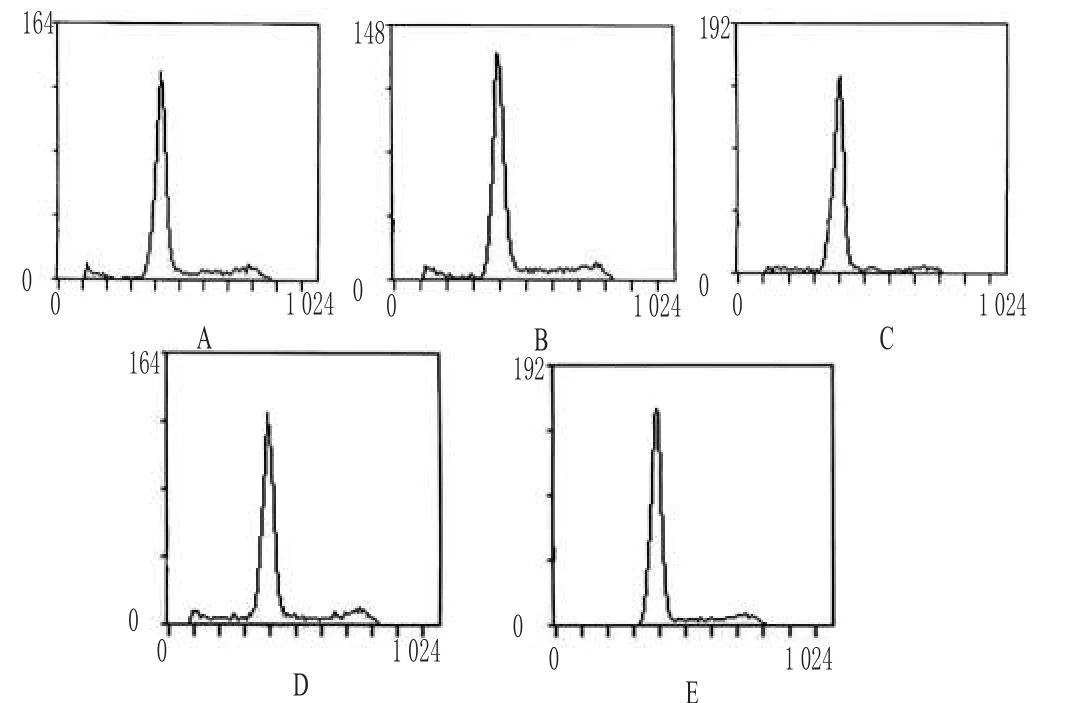
图2 FLP对成纤维细胞凋亡的影响A.12h;B.24h;C.48h;D.72h;E.空白对照Fig2 Effect of FLPon the apoptosis of fibroblastsA.12h;B.24h;C.48h;D.72h;E.blank control
3.4 凋亡相关蛋白Bcl-2表达的变化
Western-blotting检测结果表明,培养的瘢痕疙瘩成纤维细胞有一定量的Bcl-2蛋白表达。加入FLP后各组Bcl-2蛋白表达均有减少,其中1mg·L-1、24h组,1mg·L-1、48h 组与空白对照相比较具有显著性差异(P<0.05)。FLP作用后成纤维细胞Bcl-2蛋白的表达见图3。
3.5 胶原蛋白含量的测定
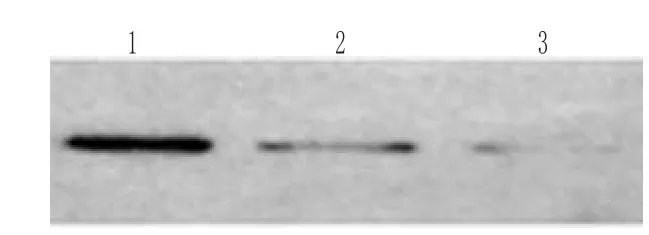
图3 FLP作用后成纤维细胞Bcl-2蛋白的表达1.空白对照;2.FLP 10µmol·L-124h ;3.FLP 10µmol·L-148hFig3 Bcl-2protein expression of fibroblasts treated withFLP1.blank control;2.FLP 10µmol·L-124h ;3.FLP 10µmol·L-148h
各试验组中,Hyp含量无明显变化;而空白对照组中,不同时间段的Hyp含量随时间的延长而增加(P<0.05)。结果表明,FLP能降低瘢痕成纤维细胞中Hyp的含量。FLP对成纤维细胞胶原蛋白合成的影响见图4。
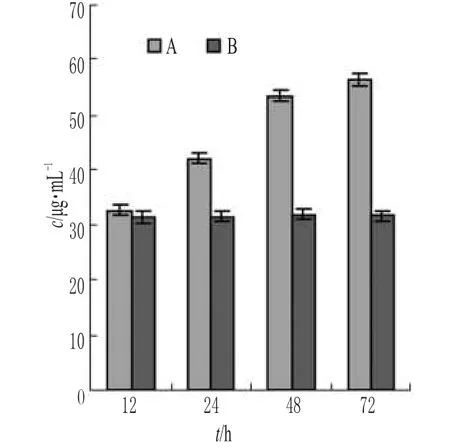
图4 FLP对成纤维细胞胶原蛋白合成的影响A.空白对照;B.FLP 10µmol·L-1Fig4 Effect of FLP on the synthesis of fibroblasts collagen proteinA.blank control;B.FLP 10µmol·L-1
4 讨论
瘢痕疙瘩是皮肤的一种良性肿瘤,其临床表现为瘢痕的过度增生并向正常组织浸润生长,手术切除后极易复发,当今尚无可靠的特异性治疗方法[6]。FLP具有抑制肿瘤增殖、促进肿瘤凋亡的作用[7],这为笔者研究其对增生性瘢痕组织的作用提供了理论依据。本研究应用不同浓度FLP干预体外培养的瘢痕疙瘩成纤维细胞,结果观察到FLP对瘢痕疙瘩成纤维细胞增殖具有明显抑制作用;进一步试验观察到FLP能明显诱导病理性瘢痕组织成纤维细胞凋亡,同时可抑制胶原蛋白的合成,从而抑制组织的纤维化。瘢痕形成过程中,Bcl-2基因表达异常增加可使已有基因异常改变的成纤维细胞逃避凋亡,由此引起的基因异常事件的积累是导致瘢痕形成的必要前提。增生性瘢痕是组织损伤后修复过度的一种改变,表现为成纤维细胞的大量增生以及胶原等间质蛋白的沉积。Ladin DA等[8]发现,瘢痕疙瘩和培养的瘢痕疙瘩成纤维细胞中Bcl-2蛋白表达升高,并伴有细胞凋亡率降低。本研究结果发现,FLP可能通过抑制Bcl-2阻断此信号传递途径而发挥其抑制细胞增殖、诱导成纤维细胞凋亡的作用,这为防治组织纤维化提供了一条新的研究思路。
本研究结果表明,FLP具有抑制瘢痕疙瘩成纤维细胞增殖、诱导其凋亡、抑制胶原蛋白增殖的作用。同时研究发现,其机制可能通过抑制Bcl-2表达来发挥作用。
[1] 陈晓栋,张国成.促纤维化细胞因子与瘢痕疙瘩[J].国外医学-皮肤性病学分册,2002,28(1):31.
[2]Yin WP,Chen HM,Wang TX,et al.A new coumarin compound with anticanceractivity[J].Chin Tradit Herb Drugs,1997,27(1):3.
[3] Mao XW,Chen YD,Yang L,et al.Study on main composition extraction separation of Fig andapplication[J].J Chem Indus Forest Prod,1998,13(6):22.
[4] Mao XW,Chen YD,Yang L,et al.The anticancer research overview of the Fig[J].J Chem Indus For Prod,1998,13(5):13.
[5] 刘 辽,贾 萍,杨云霞,等.柚皮苷对人皮肤角质细胞分泌趋化因子RANTES及其核转录因子-κB信号通路影响的实验研究[J].中国药房,2010,21(1):40.
[6] 王晓军,龙 笑.槲皮素对瘢痕疙瘩成纤维细胞胶原合成的影响[J].整形再造外科杂志,2005,2(3):137.
[7] 曹尚银,杨福兰,吴 顺,等.无花果抗癌作用研究新进展[J].林业科技开发,2004,18(2):13.
[8] Ladin DA,hou Z,patel D,et al.The use of athymic nude mice for the study of human keloids[J].Wound Rep Reg,1998,6(6):2837.
Influence of Psoralen of Fig Leaf on Human Keloid Fibroblasts in Vitro
WANG Tao
(Dept.of Biochemistry,Basic Medical College,Taishan Medical University,Taian 271000,China)
TAO Ru
(Medical College,Taishan Medical University,Taian 271000,China)
LI Qing-hua
(The Affiliated Hospital of Taishan Medical University,Taian 271000,China)
GAO Yong-feng
(General Lab of Pharmacy,College of Pharmacy,Taishan Medical University,Taian 271000,China)
ZHOU Cheng-jun
(The Second Hospital of Shandong University,Jinan 250033,China)
LIU Jin-cheng
(Dept.of Biology,Medical College of Qingdao University,Qingdao 266021,China)
OBJECTIVE:To investigate the effect of psoralen of fig leaf(FLP)on the proliferation and apoptosis of human keloid fibroblasts.METHODS:Human keloid fibroblasts were treated with FLP.Morphology,MTT method and flow cytometry(FCM)were adopted to detect the effect of FLP on the proliferation and apoptosis of human keloid fibroblasts.The inhibition effect of PSO on the synthesis of fibroblasts collagen was determined by chloramines T assay.The protein levels of Bcl-2were detected by Western bloting.RESULTS:After FLP treatment,the proliferation activity of human keloid fibroblasts decreased while the apoptotic index increased(P<0.01).Related-apoptosis Bcl-2protein level was inhibited as well as the synthesis of college protein.CONCLUSION:FLP inhibits the proliferation and induces the apoptosis of human keloid fibrolasts by means of inhibiting related-apoptosis Bcl-2.
Fig leaf;Psoralen;Human keloid;Fibroblasts;Proliferation;Apoptosis
R285;R97
A
1001-0408(2011)19-1746-04
Δ山东省中医药管理局资助项目(2007167);泰山医学院青年基金资助项目(997)
*讲师,硕士。研究方向:肿瘤分子生物学。电话:0538-6222050。E-mail:wangtaofch@yahoo.com.cn
2010-09-12
2010-12-19)

