聚酰胺-胺型树状聚合物介导基因转染的实验研究
王 雪 王丹茹
聚酰胺-胺型树状聚合物介导基因转染的实验研究
王 雪 王丹茹
目的 探讨聚酰胺-胺型树状聚合物(PAMAM)作为基因载体,体外转染成纤维细胞的可行性。方法 ① 将pEGFP与PAMAM按不同电荷比混合,通过原子力显微镜(AFM)对PAMAM和PAMAM-pEGFP复合物进行粒径、形态的表征;凝胶电泳实验和Zeta电位实验检验PAMAM与pEGFP质粒在不同电荷比时形成复合物的能力;通过DNA共沉淀试验检测不同电荷比下PAMAM对质粒pEGFP的包封率。②将不同电荷比的PAMAM-pEGFP复合物转染至小鼠胚胎成纤维细胞系,48 h后荧光显微镜下观察转染情况。③CCK-8实验检测转染后细胞的增殖活性。结果 PAMAM-pDNA复合物的粒径约10 nm。PAMAM在电荷比大于2时就能有效包裹质粒。随电荷比的增加,复合物的Zeta电位增加,在溶液中的稳定性和分散性也提高。包封率在电荷比为4∶1时达95%。转染效率随电荷比的增加呈增高趋势,其中在4∶1和6∶1时转染效率达到最高。细胞毒性与电荷比有关,电荷比大于6∶1时,PAMAM对细胞生长有毒性作用。结论 PAMAM纳米载体可安全有效地介导基因转染,是一种理想的基因递送系统。
聚酰胺-胺型树状聚合物 成纤维细胞 转染 基因治疗
聚酰胺-胺(Polyamidoamine,PAMAM)树枝状聚合物是一种高度分枝、表面多价、呈放射状球体结构的新型纳米级高分子聚合物。属于非生物材料,无免疫原性和遗传毒性。其表面具有大量带正电的末端功能基团,在生理条件下,可以与带负电的DNA通过静电作用形成纳米级复合物。通过非特异性内吞作用进入细胞。在溶酶体中,其表面大量的碱性端基发挥“质子海绵效应”,缓冲强酸性环境的降解作用,而将遗传物质释放到胞浆中,进而移入胞核完成转染过程[1-2]。
就理论而言,所有器官都可以是基因治疗的靶器官,皮肤作为人体最大的器官,在基因治疗中具有独特优势:容易获取、选择范围及部位充足;能够监控基因表达,若出现不良反应可以及时中止;皮肤血供丰富,基础代谢旺盛,可作为全身系统性疾病基因治疗的靶器官。皮肤中含量最为丰富的细胞就是成纤维细胞。因此,本实验中,我们使用小鼠胚胎成纤维细胞系 (3T3细胞),用绿色荧光蛋白基因EGFP模拟治疗性基因,探索以纳米材料PAMAM为基因递送载体、以皮肤为靶器官的基因治疗方法治疗皮肤及瘢痕性疾病[3]。
1 材料与方法
1.1 材料
实验在上海交通大学医学院附属第九人民医院组织工程实验室完成。3T3细胞为本实验室提供。真核表达质粒pEGFP(美国GeneCopoeia公司),大量质粒抽提纯化试剂盒(上海天根试剂公司),PAMAM G5(美国Sigma公司),DMEM高糖培养液(美国Gibco公司),胎牛血清FBS(美国BD公司),HEPES缓冲液(美国Invitrogen公司),CCK-8(日本Dojindo公司)。
1.2 方法
1.2.1 PAMAM-pEGFP复合物的制备
取1 mL PAMAM G5甲醇溶液,以真空旋转蒸发仪将甲醇抽吸掉,加入10 mM HEPES,10%(w/v)蔗糖缓冲液(pH 7.4)溶解,配制成不同浓度。将抽提纯化后经电泳实验鉴定的质粒pEGFP(0.25 mg/mL)与PAMAM等体积混合,室温下孵育30 min,获得PAMAM/pEGFP电荷比为1∶1~8∶1的复合物。
1.2.2 PAMAM及PAMAM-pEGFP复合物粒径和形态的表征
将5%(w/v)PAMAM甲醇溶液稀释100倍,将电荷比为4∶1的PAMAM/pEGFP复合物溶液稀释至pEGFP浓度为5 μg/mL,分别取2 μL滴到云母片上,室温下自然风干后,用原子力显微镜检测两者的粒径和形态。
1.2.3 琼脂糖凝胶阻滞实验
在20 μL的反应体系中,将不同浓度的PAMAM与pEGFP各8 μL混合配成电荷比1∶1~8∶1的复合物,其余用PBS缓冲液补足。混匀后,室温下静置30 min。配制1%(w/v)的琼脂糖凝胶,85 mV,电泳30 min。可判断PAMAM/pEGFP复合物的形成情况,以及复合物中pEGFP的状态(开环或是闭环)。
1.2.4 Zeta电位
配制pEGFP终浓度为8%、电荷比1∶1~8∶1的复合物体系,其余用去离子水补足,用Zeta电位仪检测Zeta电位,每组重复6次。
1.2.5 PAMAM对pEGFP包封率的表征
电荷比1∶1~8∶1的PAMAM-pEGFP复合物32 μL(含4 μg质粒,浓度0.125 μg/μL)用去离子水将DNA浓度稀释30倍。12 000 r/min低温高速离心15 min后,通过DU-800核酸分析仪测上清质粒DNA 260 nm的吸光度。经过高速离心,与PAMAM结合形成复合物的pEGFP沉到管底,未被结合的pEGFP则留在上清液中。通过测其浓度可计算未被结合的pEGFP的量,从而可算出被包封的pEGFP的量。
1.2.6 细胞培养与基因转染
3T3细胞用含10%FCS的高糖DMEM培养液,37℃、5%CO2下培养。转染前18 h,按2×104个/孔的密度接种到24孔板,实验分5个实验组,即1∶1、2∶1、4∶1、6∶1和8∶1,以及1个空白对照组,每组设三个副孔。待细胞生长至60%~80%融合时,每孔加入200 μL转染试剂,轻摇后转入培养箱培养,5 h后,将转染试剂吸去,每孔加入500 μL普通培养液,继续培养。48 h后在荧光显微镜下观察结果,随机选取镜下视野,数200个细胞,计算其中发荧光的细胞数目,每组重复取3个视野,以此计算转染效率。
1.2.7 细胞毒性检测
按每孔2 000个细胞接种到96孔板中,24 h后,分别加入不同电荷比的转染试剂100 μL,空白组加等量普通培养液,37℃、5%CO2培养箱中孵育5 h后,吸去转染试剂,每孔加入 100 μL普通培养液,继续培养。48 h后,每孔加入10 μL CCK-8,37℃、5%CO2中孵育2~3 h,在酶联免疫检测仪OD 490 nm处测量各孔的吸光值,连测3 d。
1.3 统计学处理
应用SPSS 17.0统计学软件,采用单因素方差分析进行统计学数据处理。
2 结果
2.1 PAMAM及PAMAM-pEGFP复合物粒径和形态的表征
原子力显微镜对PAMAM及PAMAM-pEGFP复合物粒径、形态的表征,镜下可见PAMAM颗粒小,分散性好,粒径大小约10 nm(图1A)。PAMAM-pEGFP复合物分布均匀,粒径大小约60 nm(图1B)。
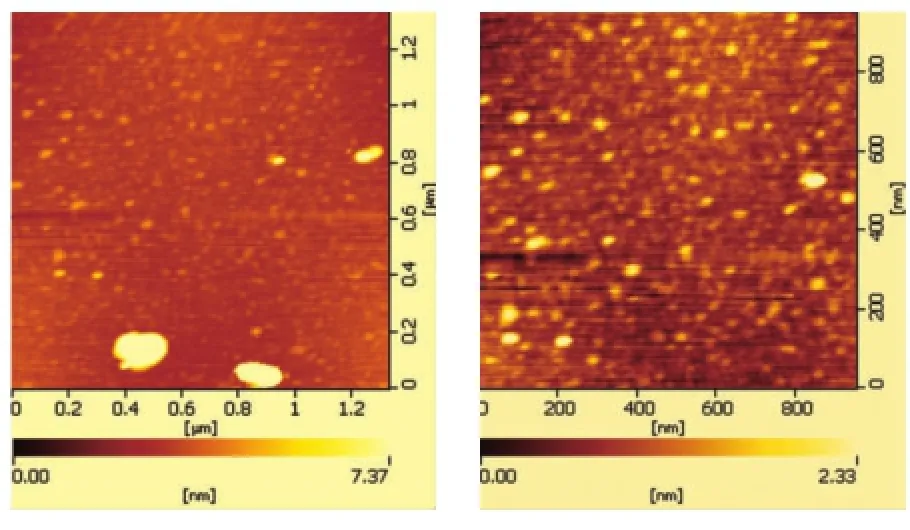
图1 PAMAM及PAMAM-pEGFP复合物的原子力显微镜图Fig.1AFM image of PAMAM andPAMAM-pEGFP complex
2.2 琼脂糖凝胶阻滞实验
该实验检测PAMAM结合DNA的能力。结果显示,PAMAM对DNA的包裹压缩作用随电荷比的增加而增强。电荷比1∶1时,两者之间结合能力较弱,当达2∶1后,便可充分保护DNA不被电泳出加样孔(图 2)。
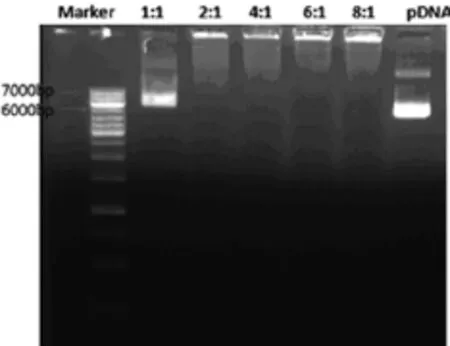
图2 不同电荷比下的PAMAM结合DNA的情况Fig.2 The results of PAMAM binding DNA by different charge ratios
2.3 Zeta电位
PAMAM-pEGFP复合物整体带正电荷。随着电荷比的增加,Zeta电位值也增加,表明PAMAM-pEGFP复合物表面的净正电荷量增加,复合物颗粒间斥力也随之增加,使其分散性得到提高(图3)。
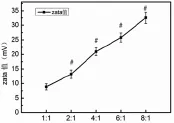
图3 不同电荷比下复合物Zeta电位(﹟示与1∶1组相比较,P<0.05)Fig.3 Zeta potential by different charge ratios (﹟P<0.05,compared to1:1 group)
2.4 PAMAM包封率的表征
经单因素方差分析,各组间差异有统计学意义(P<0.05)。随电荷比的增加,PAMAM对pEGFP的包封率也越高(图4)。
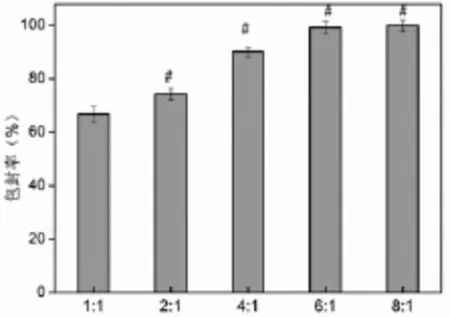
图4 不同电荷比下PAMAM的包封率(﹟示与1∶1组相比较,P<0.05)Fig.4 Envelopment ratio of PAMAM by different charge ratios (﹟P<0.05,compared to1∶1 group)
2.5 转染效率
转染效率随电荷比的变化而变化,4∶1、6∶1时转染效率最高,且二者无明显差异;8∶1时转染效率反而有所下降。跟脂质体转染相比,效率略低。转染后48 h的表达率最高。72 h后绿色荧光蛋白开始降解(图 5,6)。
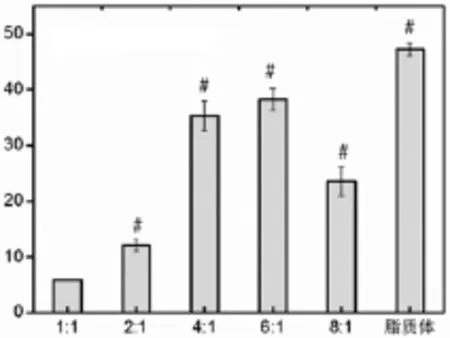
图5 不同电荷比下的转染效率(﹟示与1∶1组相比较,P<0.05)Fig.5 Transfection efficiency by different charge ratios (﹟P<0.05,compared to1∶1 group)
图6 荧光显微镜观察转染效率Fig.6 Transfection efficiency of PAMAM and liposome
2.6 细胞毒性试验
实验结果表明,脂质体的毒性相对较明显;组间比较显示,电荷比越大,毒性越大。电荷比小于4∶1时,对细胞几乎无影响;但当电荷比大于6∶1时,对细胞生长有毒性作用(图7)。
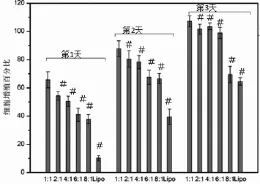
图7 不同电荷比下细胞增殖随时间的变化情况(﹟示与1∶1组相比较,P<0.05)Fig.7 Cell proliferation by different charge ratioes at different time(﹟P<0.05,compared to1∶1 group)
3 讨论
选择恰当的转染方法将治疗基因高效、安全地递送至细胞核是基因治疗最重要的步骤。基因治疗开展至今,转染手段始终是限制其临床推广的难题。本研究主要探讨了新型纳米材料作为基因递送系统体外转染成纤维细胞系的可行性,内容包括复合物的制备、表征,转染效率和毒性的检测[4]。
对PAMAM和PAMAM-pEGFP复合物进行表征的目的,是检测其粒径和形态是否正常,是否能够有效形成复合物,这一实验步骤是不可或缺的。因为,PAMAM是一种高度分支化、由分子核心向外放射开来、活性带电的氨基末端覆盖分子表面的高分子聚合物,在溶液中很容易受到各种物理化学因素的影响,而导致其表面电性电量及形态大小的改变,影响其与DNA通过静电作用形成复合物,从而影响转染的效果。原子力显微镜可在常温干燥状态下表征PAMAM及其复合物的表面形态、粒径大小和分布情况,镜下可见到PAMAM及PAMAM-pEGFP复合物粒径都在纳米级以下,呈球形,分布均匀。但也可见到团聚的现象,这主要是离子浓度、pH值影响了溶液中的电荷分布,破坏了纳米颗粒之间的平衡。Vlasov等[5]在透射电镜下观察到了纳米颗粒团聚,并认为这是造成转染效率低的最主要原因。Yoza等[6]通过表征前超声复合物的办法分散团聚的纳米颗粒。本实验中参考并采用了此法。
琼脂糖凝胶滞留实验的原理,就是未被PAMAM充分吸附的DNA会在电泳过程中迁移,而形成紫外光下的可见条带,而被充分吸附的DNA就会以PAMAM-pEGFP复合物的形式滞留在加样孔,可据此判断两者的复合情况。实验证明,当电荷比大于2∶1时,PAMAM就能充分地吸附压缩DNA,可见PAMAM结合DNA的能力是很强的。Zeta电位是表征胶体分散系稳定性的重要指标,是对颗粒之间相互排斥或吸引力强度的度量。Zeta电位越高,体系越稳定,即溶解或分散可以抵抗聚集,一般认为达到25 mV后体系就很稳定。实验发现,Zeta电位也随电荷比的增加而增加,表明复合物表面的净正电荷量在增加,可以提供更多的活性氨基与细胞膜静电吸附。当电荷比达到4∶1时,Zeta电位就超过25 mV,可见复合物在溶液中分散性良好,整个体系处于稳定状态。但是,Zeta过高(一般认为大于50 mV)就会对细胞膜造成损伤。
不论基因载体还是药物载体,包封率都是评价其装载容量和能力的重要指标。本实验中运用高速离心法,通过计算离心前后上清液中pEGFP的质量变化,来评价PAMAM的包封能力。本实验显示,各组包封率普遍大于80%,而且随电荷比的增加呈增高的趋势,4∶1时包封率达到95%,进一步证明了前面提到的PAMAM有较强pDNA结合能力的结论。
相对于目前广泛使用的商品化转染试剂脂质体来说,PAMAM的转染效率并不理想。有报道认为,基因在转染过程中会遇到层层障碍,包括跨膜过程、被溶酶体包吞后降解、不能有效释放DNA、释放后DNA滞留在胞浆、DNA在入核前被降解以及DNA入核困难等[7-8]。对此,大量研究进行了诸多方面的优化。例如,Nam等[9]在以羟基为末端的PAMAM酯表面连接精氨酸,可以有效缓冲溶酶体内的酸碱度变化,有利于DNA由溶酶体释放入胞浆,进而入核参与核内反应。Ma等[10]用去炎舒松修饰PAMAM以开大核孔,易化复合物入核过程,显著提高了转染效率。另外,在转染过程中添加氯喹,氯喹在内涵体中积累可提高微环境的pH值,诱导内涵体渗透性膨胀而最终崩解,有利于将DNA释放到胞浆中[11]。在本室验中,我们使用加热的方法降解PAMAM自身,将其本身严格规整的结构分散开来,增加了转染的灵活性,使之与DNA的结合更紧密,在释放DNA时更易于膨胀,转染效率明显提高。结合本实验的结果来看,PAMAM介导的转染效率还有待于进一步的优化。
PAMAM对细胞的毒性具有复合物浓度和电荷比依赖性,并且与细胞类型有关。引起细胞毒性甚至凋亡的两种途径为:①复合物吸附到细胞表面时,其表面氨基可在细胞磷脂双分子上形成1个纳米微孔,胞浆从这些微孔流出而造成细胞死亡;②复合物被溶酶体融合后,氨基质子化,造成溶酶体碱化,质子海绵效应使得溶酶体崩解,从而将大量的水解酶释放到胞浆中,使线粒体膜电位变化,外膜通透性增加导致凋亡[12]。这是所有阳离子聚合物引起细胞毒性的共同特点。但是与脂质体相比,PAMAM的毒性要小得多,而且在电荷比小于4∶1时,对细胞活性几乎无影响。大于6∶1时,细胞生长受到一定程度的抑制。
本实验结果表明,G5 PAMAM可以有效介导体外非特异性基因转染真核细胞。表明丰富的正性氨基与负性的核酸形成粒径小、稳定、高分散、低毒性的纳米颗粒,可以将目的基因递送至真核生物成纤维细胞。相信经过进一步优化,PAMAM可以作为一种以皮肤为靶器官的基因治疗的新型载体。
[1] Caminade AM,Turrin CO,Majoral JP.Dendrimers and DNA: combinations of two special topologies for nanomaterials and biology [J].Chemistry,2008,14(25):7422-7432.
[2] Sonawane ND,Szoka FC,Verkman AS.Chloride accumulation and swelling in endosomes enhances DNA transfer by polyamine-DNA polyplexes[J].J Biol Chem,2003,278(45):44826-44831.
[3] Therrien JP,Pfützner W,Vogel JC.An approach to achieve longterm expression in skin gene therapy[J].Toxicol Pathol,2008,36 (1):104-111.
[4] Shcharbin D,Pedziwiatr E,Bryszewska M.How to study dendriplexes I:characterization[J].J Control Release,2009,135(3):186-197.
[5] Vlasov GP.Starlike branched and hyperbranched biodegradable polymer systems as DNA carriers[J].Bioorg Khim,2006,32(3): 227-242.
[6] Yoza B,Arakaki A,Maruyama K,et al.Fully automated DNA extraction from blood using magnetic particles modified with a hyperbranched polyamidoamine dendrimer[J].J Biosci Bioeng, 2003,95(1):21-26.
[7] Dufès C,Uchegbu IF,Schatzlein AG.Dendrimers in gene delivery [J].Adv Drug Deliv Rev,2005,57(15):2177-2202.
[8] Dutta T,Jain NK,McMillan NAJ,et al.Retracted:dendrimer nanocarriers as versatile vectors in gene delivery[J].Nanomedicine: Nanotechnology,Biology and Medicine2010,6(1):25-34.
[9] Nam HY,Nam K,Hahn HJ,et al.Biodegradable PAMAM ester for enhanced transfection efficiency with low cytotoxicity[J]. Biomaterials,2009,30(4):665-673.
[10] Ma K,Hu MX,Qi Y,et al.PAMAM-triamcinolone acetonide conjugate as a nucleus-targeting gene carrier for enhanced transfer activity[J].Biomaterials,2009,30(30):6109-6118.
[11] Navarro G,Ilarduya CT.Activated and non-activated PAMAM dendrimers for gene delivery in vitro and in vivo[J].Nanomedicine, 2009,5(3):287-297.
[12] Parimi S,Barnes TJ,Callen DF,et al.Mechanistic insight into cell growth,internalization,and cytotoxicity of PAMAM dendrimers[J]. Biomacromolecules,2010,11(2):382–389.
Experimental Study of Gene Transfer Mediated by Polyamidoamine Dendrimers
Wang Xue,Wang Danru.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 20011,China.Corresponding author:WANG Danru(E-mail:wangdanru@126.com).
Objective To explore the feasibility of PAMAM as a gene carrier transfecting into fibroblasts.Methods The p-EGFP was mixed with PAMAM by different charge ratios.① The size and shape of PAMAM and PAMAM-pEGFP complex were characterized by Atomic force microscopy(AFM).The ability of PAMAM forming complex was analysed by gel electrophoresis assay and Zeta potential measurememt.The encapsulating efficiency was measured by co-sedimentation assay.② The PAMAM-pEGFP complexes were delivered to mouse embryonic skin fibroblasts cell line (3T3),and the transfection efficiency was observed after 48h by fluorescence microscope.③The post-transfected cell viability was determined by CCK-8 test.Results The diameter of PAMAM-pDNA complex was 10 nm approximately.By a charge ratio of 2∶1 or above, PAMAM can condense p-EGFP effectively.With the increase of charge ratio,the Zeta potential of the complex increased,the stability and dispersion of the complex in aqueous solution were also improved.By a charge ratio of 4∶1,the envelopment rate can reach 95%.With the increase of charge ratio,the transfection efficiency increased,especially by a charge ratio of 4∶1 or 6∶1.The toxicity of the nanoparticles was dependent on charge ratio.When the charge ratio was over 4∶1,the cell viability would be inhibited in certain extent.Conclusion PAMAM could transfect effectively and safely and becomes a promising gene delivery system.
PAMAM Dendrimer;Fibroblast;Transfection; Gene therapy
Q813.1+2
A
1673-0364(2011)04-0181-05
2011年7月23日;
2011年8月10日)
10.3969/j.issn.1673-0364.2011.05.001
200011 上海市 上海交通大学医学院附属第九人民医院 整复外科。
王丹茹(E-mail:wangdanru@126.com)。

