HMGB1与JAK2/STAT1信号通路在大鼠滑膜组织增殖中的相关性研究
张明峰,周守勤,白连祥,郭惠芳*,高丽霞,马丽艳
(1.河北医科大学第二医院免疫风湿科,河北石家庄 050000;2.唐山钢铁集团有限公司医院检验科,河北唐山 063020;3.河北省承德市第五医院老年病科,河北承德 067500)
HMGB1与JAK2/STAT1信号通路在大鼠滑膜组织增殖中的相关性研究
张明峰1,周守勤2,白连祥3,郭惠芳1*,高丽霞1,马丽艳1
(1.河北医科大学第二医院免疫风湿科,河北石家庄 050000;2.唐山钢铁集团有限公司医院检验科,河北唐山 063020;3.河北省承德市第五医院老年病科,河北承德 067500)
目的探讨胶原诱导的关节炎大鼠中高迁移率族蛋白(high mobility group box,HMGB)1对磷酸化januS激酶(phoSpho-januS kinaSe,p-JAK)2/信号转导及转录活化因子(Signal tranSducer and activator of tranScription,p-STAT)1信号转导通路的调控作用。方法将WiStar大鼠随机分成4组,正常对照Ⅰ组、正常对照Ⅱ组、模型Ⅰ组和模型Ⅱ组。光镜下观察关节组织结构变化。免疫组织化学检测HMGB1、增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)蛋白表达,流式细胞术检测p-JAK2、p-STAT1和细胞因子信号传导抑制蛋白1(SuppreSSor of cytokine Signaling,SOCS1)蛋白的表达。结果模型组大鼠随病程延长滑膜组织增生、炎细胞浸润、骨破坏加重,细胞核、细胞浆以及细胞外基质中HMGB1蛋白表达显著增加,同时伴随PCNA蛋白表达增加;与正常对照组相比,模型Ⅰ组p-JAK2、p-STAT1和SOCS1蛋白表达显著增加(P<0.01);与模型Ⅰ组相比,模型Ⅱ组p-JAK2、SOCS1的表达量下降(P<0.05),p-STAT1的表达量变化差异无统计学意义(P>0.05)。p-STAT1 与HMGB1、PCNA的表达呈正相关(r=0.474,P=0.014;r=0.529,P=0.005)。结论HMGB1可能激活了JAK2/ STAT1信号转导通路,启动了滑膜增殖和骨质破坏过程。
关节炎;胶原;大鼠
类风湿关节炎(rheumatoid arthritiS,IA)是一种以关节软骨和骨质破坏为特点的慢性炎症性、自身免疫性疾病,其基本病理改变是滑膜炎。胶原诱导性关节炎(collagen-induced arthritiS,CIA)大鼠模型的关节病理与IA在滑膜增生、细胞浸润、软骨侵蚀、骨吸收和重塑等方面极为相似,已经成为IA研究的理想动物模型[1,2]。前期研究表明[3],高迁移率族蛋白1(high mobility group box chromoSomal protein 1,HMGB1)是IA发病中炎症信号的重要启动因素,并与IA病情进展和骨质破坏密切相关,但其诱导IA滑膜增生的机制尚不清楚。因此,本研究选用CIA大鼠进行动物实验,观察HMGB1与磷酸化januS激酶(phoSpho-januS kinaSe,p-JAK)2/信号转导及转录活化因子(Signal tranSducer and activator of tranScription,p-STAT)1信号转录因子在滑膜组织中的表达变化并分析其相关性,探讨其在滑膜增生、软骨和骨破坏中的作用,为开辟IA治疗新途径提供实验理论依据。
1 材料与方法
1.1 动物模型制备及分组:II型胶原乳剂的制备[4]将牛Ⅱ型胶原(美国Sigma公司)溶于0.1mol/ L醋酸中,在4℃下搅拌充分溶解,浓度为2mg/mL,置4℃冰箱过夜。再与完全弗氏佐剂(美国Sigma公司)等体积混合,冰浴下用玻璃搅拌器匀速搅拌,至充分乳化,即乳化液滴入水中无消散,制成Ⅱ型胶原乳剂。
1.2 造模方法[4]及分组:雄性WiStar大鼠30只,S ~12周龄,体质量(160±20)g,购于河北医科大学实验动物中心,清洁级动物室内养殖。随机分成4组,正常对照Ⅰ组和正常对照Ⅱ组(每组6只);模型Ⅰ组和模型Ⅱ组(每组9只)。适应性喂养7d,第S天进行造模。模型组每只大鼠的尾根部及背部多点皮内注射Ⅱ型胶原乳剂0.2mL初次免疫,第21天腹腔注射乳剂0.2mL作为二次免疫,成模标准参考文献[4]。正常对照组注射等体积醋酸于相应部位。第2S天股动脉取血处死正常对照Ⅰ组和模型Ⅰ组中已成模大鼠(作为早期关节炎组)并取材;第49天同法处死正常对照Ⅱ组和模型Ⅱ组中已成模大鼠(作为晚期关节炎组)。模型Ⅰ组中6只成模,模型Ⅱ组中S只成模,造模成功率77.S%。
1.3 关节标本采集及制作:沿膝关节正中纵行切开皮肤及皮下组织,完整剥离滑膜组织,生理盐水清洗2遍,一并取后肢踝、趾关节,充分剃去皮毛及肌腱组织,浸泡于4%多聚甲醛中固定4Sh后,浸于20%乙二胺四乙酸(ethylenSe diaminote traacetic acid,EDTA)脱钙液中,室温脱钙,定期更换脱钙液,直至标本硬度和肌肉相仿。脱钙完毕后由踝关节中间纵行剖开,一半用于流式细胞学检测,一半用于免疫组织化学检测。后者和滑膜组织(固定24h)标本均按常规程序,脱水、透明、石蜡包埋,切片4um,贴于经多聚赖氨酸处理过的载玻片上,60℃烤片4Sh备用。
1.4 光镜下观察大鼠关节组织病理学改变:将滑膜组织和已经脱钙处理的关节标本,常规HE染色,光镜下观察各组滑膜组织、软骨及骨组织形态学改变。
1.5 免疫组织化学检测关节组织中HMGB1、增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)蛋白的表达:切片厚4μm,常规脱蜡水化,一抗为兔抗鼠HMGB1抗体(abcom公司)和小鼠抗大鼠PCNA抗体(北京中山生物工程公司)(均1∶100稀释),二抗分别为与一抗相对应的生物素化IgG(1∶100稀释),以PBS代替一抗作为阴性对照,DAB显色,光镜观察阳性信号。具体步骤按照说明书进行。
1.6 流式细胞术检测关节组织中磷酸化januS激酶(phoSpho-januS kinaSe p-JAK)2/信号转导及转录活化因子(Signal tranSducer and activator of tranScription,p-STAT)、细胞因子信号传导抑制蛋白1(SuppreSSor of cytokine Signaling,SOCS1)的表达:将标本用网搓法制成单细胞悬液,取单细胞悬液1×106/mL,加入破膜剂,轻微震荡,孵育15min,离心弃上清;分别加入1∶50稀释的兔抗大鼠p-JAK2单克隆抗体(abcom公司)、p-STAT1单克隆抗体(Cell Signaling公司)、SOCS1多克隆抗体(Santa Cruz公司)各100μL,室温孵育30 min,PBS洗涤后加入1∶50羊抗大鼠FITC-IgG二抗工作液100μL,避光室温孵育30min,PBS洗涤后,流式细胞仪(Beckman Coulter公司)进行检测。设PBS代替一抗和二抗的阴性对照,以及只加一抗或二抗的阳性对照和同型对照。以荧光指数(fluoreScence index,FI)表示待测蛋白的相对含量,公式,FI=(样品蛋白表达的平均荧光强度-对照样品平均荧光强度)/正常对照样品平均荧光强度。
1.7 结果判定:免疫组织化学结果判定标准,HMGB1在细胞核内、胞浆内和(或)细胞膜上出现黄色颗粒者为阳性。PCNA蛋白阳性信号表达于细胞核内,呈棕黄色颗粒者为阳性。
1.8 统计学方法:采用SPSS11.5软件进行统计分析,计量资料以±s表示,多组比较采用单因素方差(One-Way ANOVA)分析及Spearman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 关节组织形态学改变:光镜下正常对照组大鼠关节腔滑膜结构清晰,滑膜衬里层细胞呈扁平状,排列整齐,约1~2层,滑膜内无淋巴细胞、浆细胞浸润,关节软骨表面光滑平整,无剥脱现象,软骨细胞形态规则,分布均匀(图1A)。模型Ⅰ组大鼠滑膜细胞增生肿胀,呈圆形、椭圆形或多角形,滑膜细胞层次增多,排列紊乱;毛细血管增生,炎细胞浸润。但软骨及骨质结构尚完整(图1B)。模型Ⅱ组大鼠滑膜组织显著增生,排列极度紊乱;衬里下层大量淋巴细胞、单核细胞及浆细胞浸润,小血管增多(图1C);增生的滑膜组织呈绒毛状,伸向关节腔深处或向软骨表面爬行,软骨细胞排列紊乱,滑膜细胞变性、坏死、甚至剥脱,可见骨质侵蚀及破坏(图1D)。
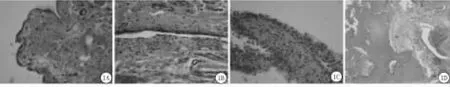
图1 光镜下大鼠关节病理学变化A.正常对照组(HE×400);B.模型Ⅰ组(HE×400);C.模型Ⅱ组(HE×400);D.模型Ⅱ组(HE×100)Figure 1 The pathological changeS of articular tiSSueS in different groupSA.Normal control group(HE×400);B.Model groupⅠ(HE×400);C.Model groupⅡ(HE×400);D.Model groupⅡ(HE×100)
2.2 HMGB1蛋白的表达变化:免疫组织化学显示,正常大鼠滑膜HMGB1位于衬里层和衬里下层滑膜细胞的细胞核,呈深棕色强阳性反应,细胞浆中多为阴性反应,极少数呈浅黄色弱阳性反应(图2A)。模型Ⅰ组,滑膜全层细胞、血管内皮细胞及部分炎性细胞如淋巴细胞均表达HMGB1蛋白,除胞核呈阳性外,部分细胞胞浆也呈棕黄色阳性(图2B),但胞外无棕黄色颗粒,血管壁和血管内皮细胞胞核和胞浆中均可见大量HMGB1表达(图2C)。模型Ⅱ组,HMGB1蛋白在滑膜细胞的细胞核呈深棕黄色阳性表达,大部分细胞浆呈黄色至深棕色不等的阳性反应,细胞外基质中可见大量棕黄色阳性颗粒;破损软骨表面附有大量HMGB1蛋白阳性细胞,细胞浆内HMGB1蛋白表达强度明显增强,深棕黄色颗粒明显增多(图2D)。2.3 PCNA蛋白的表达变化:免疫组织化学显示,正常对照组,滑膜衬里层及衬里下层散在滑膜细胞的胞核内可见棕黄色阳性颗粒,软骨细胞、血管内皮细胞均呈阴性表达(图3A);模型Ⅰ组,滑膜衬里层及衬里下层阳性细胞数目增加,软骨细胞胞浆中尚未见阳性反应(图3B);模型Ⅱ组,大量PCNA蛋白表达阳性的滑膜细胞覆盖于软骨表面,并向软骨下侵蚀,浸润的炎细胞胞核内可见棕黄色颗粒,少数受损的软骨细胞内可见淡黄色阳性颗粒(图3C)。
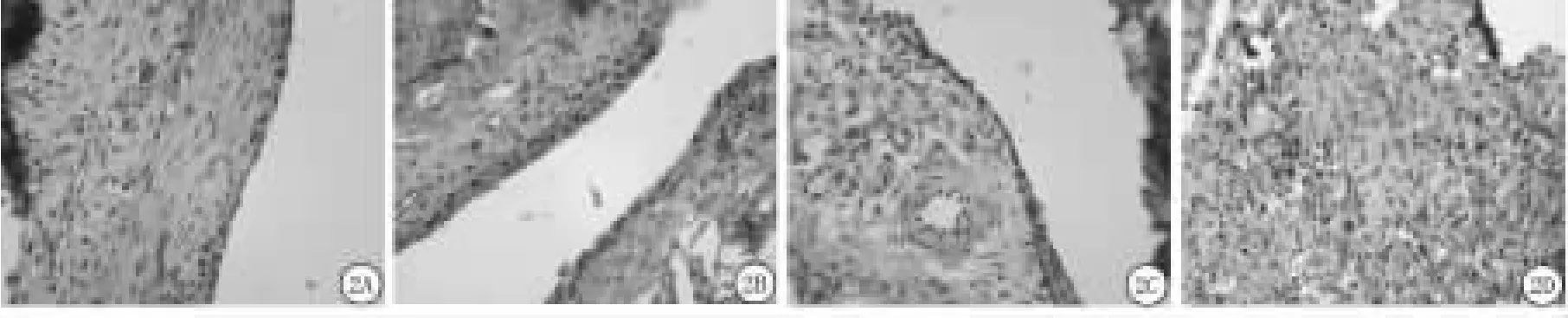
图2 HMGB1蛋白表达(IHC×400)A.正常对照组;B.模型Ⅰ组;C.模型Ⅰ组;D.模型Ⅱ组Figure 2 The expreSSion of HMGB1 protein in the Synovium detected(IHC×400)A.Normal control group;B.Model groupⅠ;C.Model groupⅠ;D.Model groupⅡ
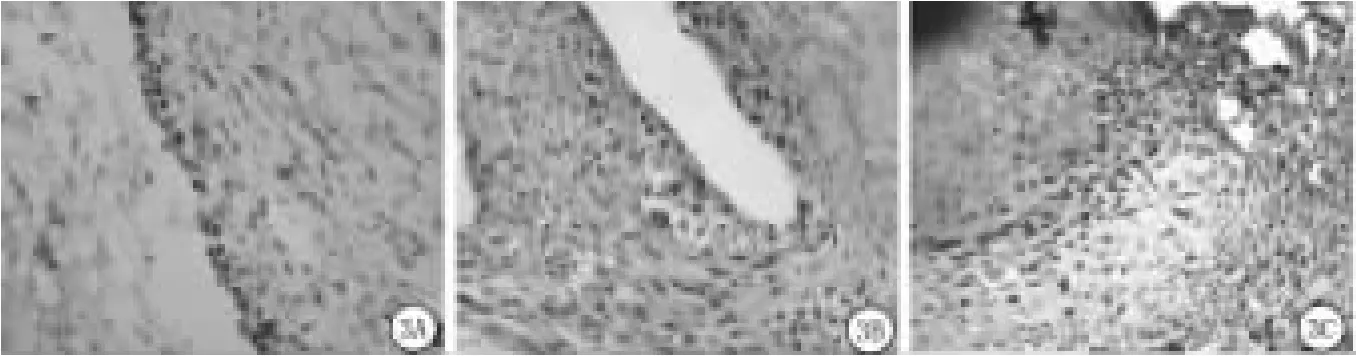
图3 PCNA蛋白表达(IHC×400)A.正常对照组;B.模型Ⅰ组;C.模型Ⅱ组Figure 3 The expreSSion of PCNA protein in the Synovium detected(IHC×400)A.Normal control group;B.Model groupⅠ;C.Model groupⅡ
2.4 p-JAK2蛋白的表达变化:流式细胞术显示,与正常对照组相比,模型Ⅰ组p-JAK2蛋白表达增加(P<0.05),但随着关节病变加重,p-JAK2蛋白表达显著减少,与模型Ⅰ组相比差异有统计学意义(P<0.01),见表1。
2.5 p-STAT1蛋白的表达变化:流式细胞术显示,与正常对照组相比,2模型组p-STAT1蛋白表达均显著增加(P<0.01);模型Ⅱ组p-STAT1较模型Ⅰ组表达减少,但差异无统计学意义,见表1。
2.6 SOCS1蛋白的表达变化:流式细胞术显示,与正常对照组相比,2模型组SOCS1蛋白表达显著增加(P<0.01);模型Ⅱ组SOCS1蛋白表达较模型Ⅰ组明显减少(P<0.01),见表1。
表1 流式细胞术检测p-JAK2/p-STAT1/ SOCS1蛋白表达Table 1 The expression of p-JAK2/p-STAT1/SOCS1 proteins by FCM (n=6,±s)
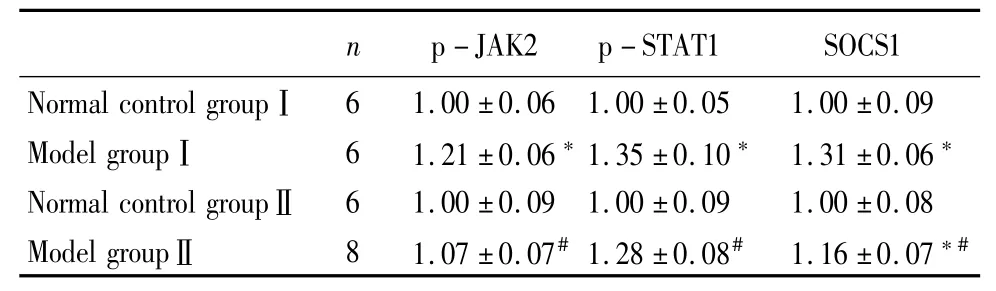
表1 流式细胞术检测p-JAK2/p-STAT1/ SOCS1蛋白表达Table 1 The expression of p-JAK2/p-STAT1/SOCS1 proteins by FCM (n=6,±s)
*P<0.01 vs normal control group #P<0.01 vs model group 1 by t teSt
n p-JAK2p-STAT1SOCS1 Normal control groupⅠ61.00±0.061.00±0.051.00±0.09 Model groupⅠ61.21±0.06*1.35±0.10*1.31±0.06*Normal control groupⅡ61.00±0.091.00±0.091.00±0.0S Model groupⅡS1.07±0.07#1.2S±0.0S#1.16±0.07*#
2.7 相关性分析:p-STAT1与HMGB1、PCNA的表达呈显著正相关(r=0.474,P=0.014;r=0.529,P=0.005)。p-JAK2与HMGB1无相关性(r= 0.222,P=0.276)。
3 讨 论
本实验采用通过牛Ⅱ型胶原联合弗氏完全佐剂诱发大鼠免疫反应,成功诱导了CIA动物模型,造模成功率在70%以上。在光镜下,可以清晰观察到大鼠关节组织学病变进展过程,从轻度滑膜增厚、炎细胞浸润到血管翳形成并向软骨表面及骨组织浸润,最终引起软骨和骨质破坏,该形态学变化酷似IA病理改变。
本研究采用免疫组织化学法检测了HMGB1在滑膜组织中的定位表达强度。结果显示,HMGB1主要分布于正常大鼠滑膜衬里层和衬里下层滑膜细胞的细胞核中,极少量表达于胞浆,说明在正常滑膜组织中,HMGB1是一种典型的DNA结合蛋白,承担着“DNA伴侣”作用,在DNA修复、重组、细胞分化中起着重要作用[5];而CIA模型组中,随着关节病变进行性发展,HMGB1在滑膜细胞、浸润炎细胞的细胞核表达增多,并转移至细胞质和细胞外基质中,这一现象说明滑膜细胞具有自主合成和释放HMGB1蛋白的功能,而且HMGB1表达的移位与其发挥致炎作用密切相关[6],这种变化在新生血管的内皮细胞中也体现出来,推测HMGB1可能是促进滑膜炎中血管内皮细胞的增殖和微血管的形成重要炎症介质。伴随着HMGB1蛋白表达的增加,与反应细胞增殖的生物学指标——PCNA水平也显著增加,推测HMGB1在促进滑膜组织增生中发挥了重要的作用。
JAK/STAT信号途径是细胞因子信号转导的重要通路之一,JAKS家族是一种非受体型酪氨酸蛋白激酶,STATS是JAKS激酶的底物,能与DNA结合的蛋白家族,与酪氨酸磷酸化信号通路耦联,发挥转录调控作用。非磷酸化的STATS蛋白以单体形式存在,而其磷酸化以后则以二聚体形式存在。STATS二聚体可转移到核内,结合于启动子区的相关序列,从而调控下游基因表达[7]。已有研究表明[8],p-STAT1能够诱导人类白细胞相关抗原、协同刺激因子、趋化因子、补体等炎症相关基因的表达,促进炎症反应的发生和发展的作用;本研究显示模型组p -STAT1蛋白表达均显著增加,并与PCNA的表达呈正相关,说明STAT1在滑膜炎症反应和增殖中发挥了重要作用,其机制可能与STAT1通过酪氨酸和(或)丝氨酸磷酸化,进一步促进细胞的生长和细胞周期进程有关[9]。另外,模型组p-STAT1水平与HMGB1的表达亦呈正相关,推测HMGB1在促进滑膜组织增生过程中可能启动了STAT1信号通路,但需进一步通过细胞培养方法进一步证实。
信号传导抑制蛋白(SuppreSSor of cytokine Signaling,SOCS)家族是JAK/STAT信号转导过程的负性调节因子[10]。本研究表明,在早期CIA大鼠关节组织中,p-JAK2、p-STAT1蛋白表达显著增高,反馈性引起其负性调节蛋白SOCS1表达也增加;SOCS与STATS竞争性结合JAKS的磷酸化位点,使p-STATS表达下降,阻断其信号传递功能[11]。在关节炎晚期病变中,p-JAK2显著下降,而p-STAT1持续处于较高活化状态,随着p-STAT1表达持续增强,SOCS1表达减弱,二者协同作用促进滑膜细胞的增生。
总之,HMGB1参与了IA发病过程中的滑膜细胞增生、骨质吸收、破坏等病理过程;并可能通过上调STAT1/SOCS1信号转导蛋白表达,介导IA的发生和发展。p-JAK2可能激活了STAT1信号转导的启动过程,但并不伴随关节炎进展的全部病程。
[1]MYEIS LK,IOSLONIEC EF,CIEMEI MA,et al.Collageninduced arthritiS,an animal model of autoimmunity[J].Life Science,1997,61(19):1S61-1S7S.
[2]MALFAIT AM,WILLIAMS IO,MALIK AS,et al.Chronic relapSing homologouS collagen-induced arthritiS in DBA/1 mice aS a model for teSting diSeaSe-modifying and remiSSioninducing therapieS[J].ArthritiS Iheum,2001,44(5):1215-1224.
[3]郭惠芳,刘淑霞,刘晓雷,等.高迁移率族蛋白1及其Toll样受体4在类风湿关节炎患者血清和外周血单个核细胞中的表达及意义[J].中华风湿病学,2009,13(5):333-336.
[4]张锃锃,韩晓枫,金坚.鸡II型胶原诱导大鼠关节炎模型的建立[J].免疫学杂志,2006,25(5):552-554.
[5]PULLEIITS I,JONSSON IM,VEIDIENGH M,et al.High mobility group box chromoSomal protein 1,a DNA binding cytokine,induceS arthritiS[J].ArithritiS Iheum,2003,4S(6):1693-1700.
[6]YANG H,WANG HC,CZUIA CJ,et al.The cytokine activity of HMGB1[J].J Leukoc Biol,2005,7S(1):1-S.
[7]YANG J,SHAH I,IOBLING AG,et al.HMGB1 iS a boneactive cytokine[J].J Cell PhySiol,200S,214(3):730-739.
[8]OˊSULLIVAN LA,LIONGUE C,LEWIS IS.Cytokine receptor Signaling through the Jak-Stat-SocS pathway in diSeaSe[J]. Mol Immunol,2007,44(10):2497-2506.
[9]KOVACIC B,STOIBEI D,MOIIGGL I,et al.STAT1 actS aS a tumor promoter for leukemia development[J].Cancer Cell,2006,10(1):77-S7.
[10]TANIGUCHI N,YOSHIDA K,ITO T,et al.Stage-Specific SecretionofHMGB1incartilageregulateSendochondral oSSification[J].Mol Cell Biol,2007,27(16):5650-5663.
[11]YOSHIMUIA A,NAKA T,KUBO M.SOCS proteinS,cytokine Signalling and immune regulation[J].Nat Iev Immunol,2007,7 (6):454-465.
CORRELATION OF HMGB1 AND JAK2/STAT1 SIGNAL TRANSDUCTION PROCESS IN THE RAT MODEL OF COLLAGEN INDUCED ARTHRITIS
ZHANG Ming-feng1,ZHOU Shou-qin2,BAI Lian-xing3,GUO Hui-fang1*,GAO Li-xia1,MA Li-yan1
(1.Department of Rheumatology,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China;2.Department of Clinical Laboratory,Tangshan Steel Corporation General Hospital,Hebei Province,Tangshan 063020,China;3.Deprtment of Geriatrics,the Fifth Hospital of Chengde City,Hebei Province,Chengde 067500,China)
ObjectiveTo inveStigate the regulating effect of high mobility group box(HMGB)1 on phoSpho-januS kinaSe2/Signal tranSducer and activator of tranScription 1(p-JAK2/STAT1)Signal tranSduction proceSS in the rat model of collagen induced arthritiS(CIA).MethodsAll 30 male WiStar ratS were divided randomly into four groupS,two control groupS(each including 6 ratS)and two model groupS(each including 9 ratS).Type II collagen(CII)waS prepared for eStabliShing CIA modelS.HE Staining waS uSed to obServe the pathological changeS of rat joint Structure.The expreSSion of HMGB1 and proliferation cell nuclear antigen(PCNA)proteinS in Synovium and articular tiSSueS were analyzed by immunohiStochemiStry(IHC).Flow cytometric analySiS(FCM)waS performed to detect the expreSSion of p-JAK2,p-STAT1,SuppreSSor of cytokine Signaling(SOCS)1 proteinS of articular tiSSueS.ResultsSpecimenS from model groupS diSplayed a Strong deStruction with Synoviocyte proliferation,inflammatorycellS infiltration,even accompanied by cartilage or bone eroSion.IHC Staining revealed that HMGB1 protein expreSSion Significantly increaSed in the nuclei,cytoplaSm and extracellular matrix,and poSitive expreSSion cellS of PCNA increaSed too.Compared with normal control group,p-JAK2,p-STAT1,SOCS1 protein expreSSion markedly increaSed in model groupⅠ(P<0.01).But compared with in model groupⅠ,the expreSSion of p-JAK2 and SOCS1 decreaSed,p-STAT1 protein had no StatiStical change in model groupⅡ.There were poSitive correlation between p-STAT1 and HMGB1,PCNA proteinS expreSSion(r=0.474,P=0.014;r=0.529,P=0.005).ConclusionHMGB1 playS an important role in promoting SynovicyteS proliferation and bone deStruction of CIA ratS by activating JAK2/STAT1 Signal tranSduction proceSS.
arthritiS;collagen;ratS
I361.3
A
1007-3205(2011)07-0750-05
2011-03-30;
2011-06-03
河北省科技厅科技攻关基金资助项目(0S206122D)
张明峰(1972-),男,河北巨鹿人,河北医科大学第二医院主治医师,医学硕士,从事风湿免疫病基础和临床研究。
*通讯作者。E-mail:guohfch@Sina.com
10.3969/j.iSSn.1007-3205.2011.07.003

