慢性乙型肝炎患者外周血CD4+CD25+调节性T细胞数量与肝脏疾病慢性化进展关系的研究
程 瑗 金晓芝 叶 超 陈永平 章圣辉 洪炜龙 谷甸娜 张 磊 郑明华
乙型肝炎病毒(HBV)感染呈世界性分布,我国是慢性乙型病毒性肝炎(CHB)的高发区,慢性HBV感染导致肝脏持续损伤、肝纤维化,并可进一步发展成为肝硬化以及肝癌。CHB的发病机制十分复杂,其中宿主免疫调节的紊乱是导致机体不能有效清除病毒的重要原因之一[1]。
CD4+CD25+调节性T细胞(Treg)是一类具有调节功能的T细胞群体,能够分泌细胞因子TGF-β1等,通过调节外周免疫耐受来控制效应T细胞的免疫反应。有学者认为Treg在慢性HBV感染时宿主免疫反应缺陷的过程中起了重要作用[2],目前国内外关于Treg与HBV感染的研究中大多数研究结果发现Treg在慢性活动性乙型肝炎(chronic active hepatitis)及ASCs患者外周血中的数量较正常人升高,研究中大都选择了未经抗病毒治疗的急慢性乙型病毒性肝炎患者来观察,关于接受抗病毒治疗后的CHB患者外周血中Treg的数量和功能研究不多,且关于Treg跟HBV感染者各临床参数之间的相关性的结果仍存在较大争议[2~6]。此次,我们收集了45例应用核苷类似物抗病毒药治疗后HBV-DNA低于检测值水平的CHB患者外周血,并按B超检查结果将患者分为3组,其中单纯CHB、CHB慢性肝病、CHB肝硬化患者各15例,与15例ASCs者以及15例正常成年人对照,观察CD4+CD25+Treg细胞在这部分患者外周血中的数量变化情况,并分析Treg与患者年龄,HBeAg定量、ALT、AST以及血浆TGF-β1水平的相关性。
材料与方法
1.研究对象:CHB患者45例,ASCs者15例,所有病例均为2009年10月~2010年7月笔者医院门诊患者,符合2000年西安会议修订的《病毒性肝炎防治方案》诊断分型标准,所有患者均除外其他病毒性肝炎、酒精性肝病、药物性肝炎、自身免疫性肝病、遗传性肝病等[7]。根据B超检查结果我们将45例CHB患者分为3组,其中单纯CHB15例(B超提示肝胆脾胰无异常),CHB慢性肝病15例(B超提示慢性肝病改变),CHB肝硬化15例(B超提示肝硬化)。15例单纯CHB患者,男性9例,女性6例,年龄25~65岁,平均42.60±10.02岁,15例CHB慢性肝病患者,男性9例,女性6例,年龄25~65岁,平均44.40±11.19岁;15例CHB肝硬化患者,男性10例,女性5例,年龄28~65岁,平均46.00±10.97岁。15例ASCs者,男性9例,女性6例,年龄25~65岁,平均41.47±11.09岁。15例正常对照者为笔者医院健康体检者,男性9例,女性6例;年龄25~65岁,平均43.73±11.24岁,均无肝炎病史,除外病毒性肝炎、酒精性肝病、药物性肝炎、自身免疫性肝病、遗传性肝病等,肝功能均正常。45例应用核苷类似物抗病毒治疗病人的用药时间为1~5年,HBV-DNA均低于检测值水平,且血清ALT、AST均在正常范围内,其中使用拉米夫定13例,阿德福韦酯11例,替比夫定9例,恩替卡韦7例,另有5例病人为拉米夫定加阿德福韦酯联合抗病毒。所有病人近6个月内均未接受免疫调节剂及保肝降酶或抗纤维化药物治疗。
2.实验方法:(1)主要试剂和仪器:美国BD FACS流式细胞仪,小鼠抗人 CD4-FITC、CD25-PE、CD127-Alexa Fluor®647、mouse IgG1-PE、mouse IgG1-APC 均购自美国 BD Pharmingen公司。SEMENS公司全自动生化分析仪进行肝功能检测。HBV-DNA采用荧光定量-聚合酶链反应技术检测,按深圳匹基生物工程股份有限公司试剂盒说明书进行操作。ELISA检测血浆TGF-β1水平,人TGF-β1ELISA试剂盒购自上海依科赛生物制品有限公司,按照说明书进行操作。(2)流式细胞术检测外周血CD4+CD25+CD127lo/-Treg的水平:采集患者及健康体检者外周静脉血2ml,EDTA抗凝。同时取2个流式试管,分别加入CD4-FITC/mouse IgG1-PE/mouse IgG1-APC和CD4-FITC/CD25-PE/CD127-Alexa Fluor®647各 5μl,每管再加 40μl抗凝全血,混匀,避光孵育30min,2ml溶血素溶血,PBS洗涤2次,流式细胞仪检测,CellQuest v3.2软件获取及分析,计算外周血中CD4+CD25+CD127lo/-Treg占CD4+淋巴细胞比例。
结 果
1.各组患者临床特点及血清生化各相关指标及血浆TGF-β1水平检测结果,如表1、表2所示。
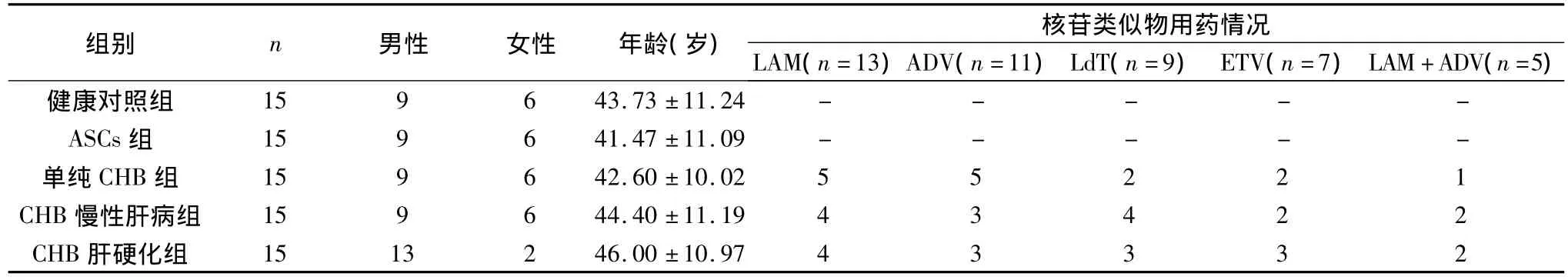
表1 各组患者临床特征及核苷类似物使用情况(n)
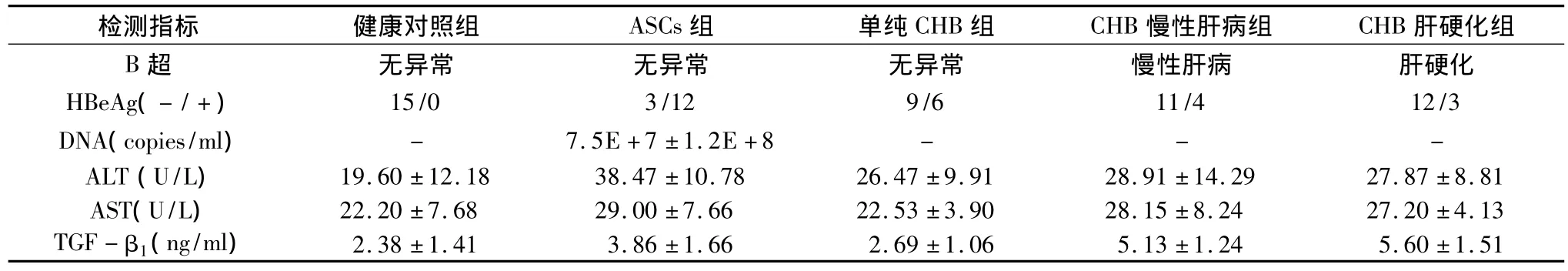
表2 各组患者临床特征、各项生化指标及TGF-β1检测结果
2.多色荧光分析法检测外周血中CD4+CD25+CD127lo/-Treg的数量,如图1所示。不同组患者外周血中CD4+CD25+CD127lo/-Treg水平的数量检测结果,如表3所示。

图1 外周血CD4+CD25+CD127lo/-Treg数量
表3 各组患者CD4+CD25+CD127lo/-Treg数量检测结果比较()
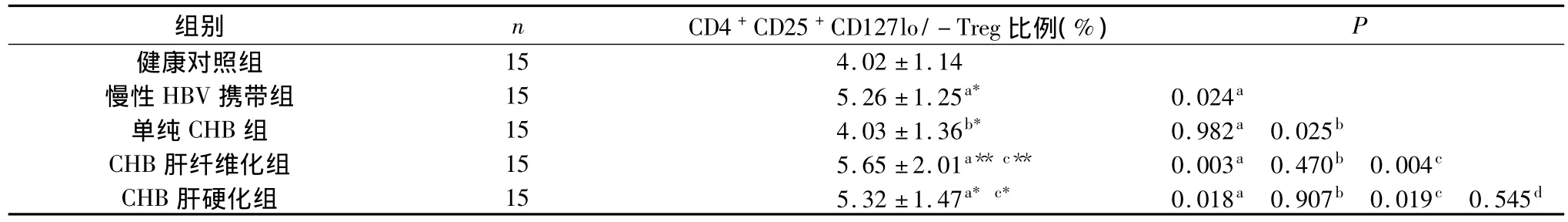
表3 各组患者CD4+CD25+CD127lo/-Treg数量检测结果比较()
a与健康对照组比较,其中a*P<0.05,a**P<0.01;b与慢性HBV携带组比较;c与慢乙肝组比较,其中c*P<0.05;d与慢乙肝肝纤维化组比较
3.不同组患者外周血CD4+CD25+CD127lo/-Treg数量与各指标的关系:相关系数及显著性见表4。Treg数量与各项指标进行相关性分析显示,在全部受检者中Treg数量与年龄之间正相关(r=0.327,P=0.004),与血清AST水平之间正相关(r=0.324,P=0.005),与血浆 TGF-β1水平正相关(r=0.306,P=0.008),相关性散点图见图2。而与 HBeAg定量,血清 ALT水平之间无显著相关性(r分别为0.177、0.129,P 分别为 0.130、0.270)。
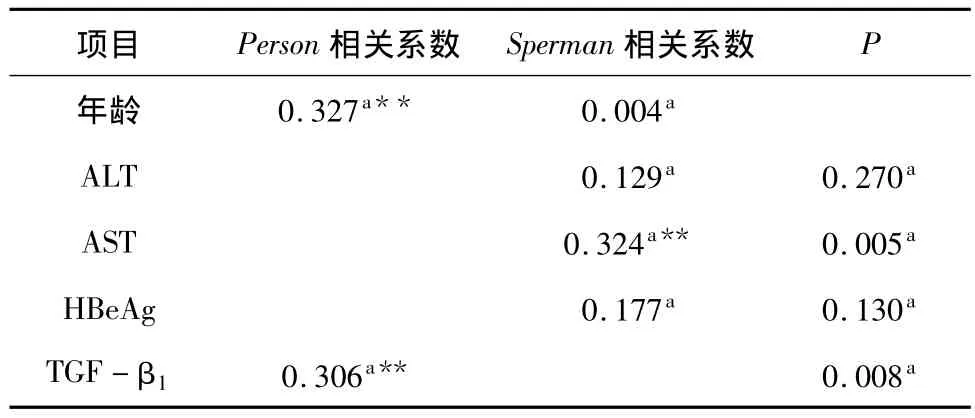
表4 Treg与不同组患者各项生化指标相关性分析
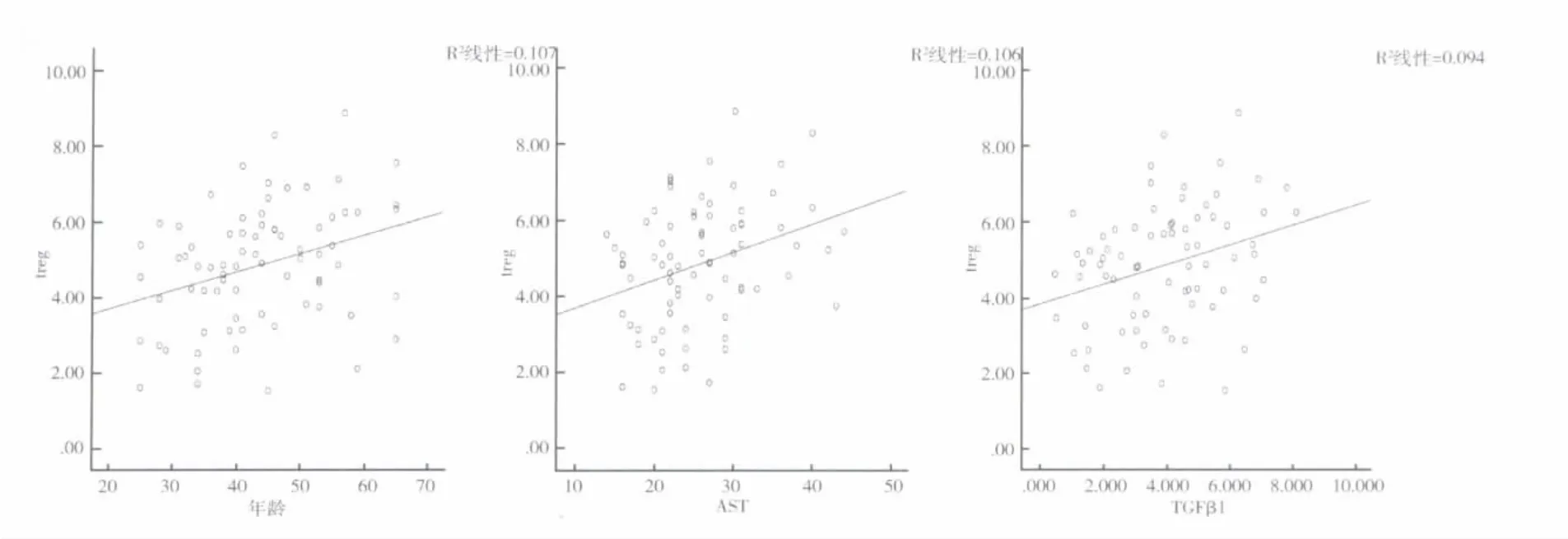
图2 Treg与年龄、AST、TGF-β1相关性散点图
4.各组 Treg、年龄、AST、TGF- β1水平比较:结果见图3。
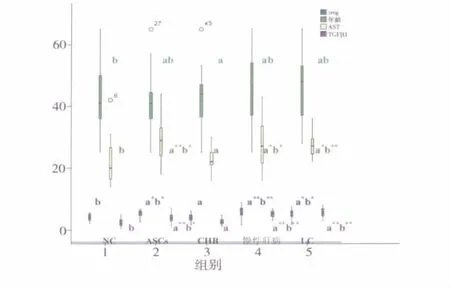
图3 不同组Treg、年龄、AST、TGF-β1比较情况
讨 论
HBV感染慢性化的机制比较复杂,其中机体免疫清除病毒的能力发挥极为重要的作用,它既能够控制病毒的复制和清除、促临床恢复和使机体产生保护性的免疫应答,也会导致炎症损伤迁延不愈,肝纤维化发生,甚至发展为肝硬化、肝癌等。Treg的发现使人们对免疫调节及免疫耐受有了新的认识,机体可能更主要的是通过Treg以“主动”的方式维持自身免疫耐受,在机体发生一些病原微生物感染时,体内的CD4+CD25+Treg的数量可以增多,且可抑制CD4+T细胞和CD8+T细胞的活化和增殖及Th1/Th2细胞因子的分泌,从而影响机体抗感染免疫应答的发生,导致感染的持续[8]。CD4+CD25+Treg最基本的分子表达特征为持续稳定表达CD25,Foxp3是CD4+CD25+Treg细胞分化发育和功能维持的重要调控基因,可作为人CD4+CD25+Treg细胞的特异性标志。但Foxp3属胞内蛋白,标记后的细胞已被破坏不能用于进一步的培养和研究。Liu等发现CD127可以帮助识别CD4+CD25+Treg细胞与活化的T细胞,CD127的低表达与Foxp3表达极其一致且与CD25中等到强表达有良好的相关性,即真正的调节性T细胞仅表达较低的CD127,因此在CD4+CD25+基础上联合CD127 lo/- 可以更好地识别人 CD4+CD25+Treg 细胞[9,10]。
我们使用CD4+CD25+CD127lo/-来标记CD4+CD25+Treg细胞,检测应用核苷类似物抗病毒治疗后HBV-DNA低于检测值水平,肝功能ALT、AST在正常范围内的CHB患者,根据其B超检测结果将其分为单纯CHB,CHB慢性肝病及CHB肝硬化3组,并选择同样ALT、AST正常的ASCs患者和正常成年人一起作为对照来观察这一部分患者外周血中CD4+CD25+Treg水平并分析其与患者年龄,HBeAg定量、ALT、AST、TGF-β1水平的相关性。
结果发现,在抗病毒治疗后单纯CHB患者外周血中CD4+CD25+Treg细胞数量较ASCs组显著降低,与正常组没有显著差异,提示在HBV慢性感染的免疫调节中,Treg可能发挥了维持机体效应细胞免疫清除HBV的稳态的作用,在ASCs患者中Treg的数量增加使得机体维持保护性免疫,避免激发过度的免疫反应所致的肝脏病理损伤的同时也造成病毒在机体的持续存在。而在抗病毒治疗后随着HBV DNA的清除,Treg数量也随着致病因素的去除而相应下降,也表明当CHB患者自身免疫耐受打破后,Treg的数量或许可以一定程度上反映CHB患者体内HBV DNA的清除情况。
同样抗病毒治疗后的CHB慢性肝病患者及CHB肝硬化患者外周血中Treg数量较之健康对照者和抗病毒治疗后CHB组显著增高。且在所有受检者中Treg的数量与年龄、血清AST水平、血浆TGFβ1水平正相关。我们比较了各组年龄、血清AST水平、血浆TGF-β1水平,发现各组年龄之间无显著差异,单纯CHB患者组的AST水平及TGF-β1水平则明显低于CHB慢性肝病组和肝硬化组。
AST主要分布在肝细胞质和肝细胞的线粒体中,当肝脏发生严重坏死或破坏时,肝细胞的线粒体也遭到了严重的破坏,AST从线粒体和胞质内释出,可以一定程度上反映肝脏损伤坏死情况。Treg在血清ALT、AST维持在正常范围内的受试者中仍与AST存在显著正相关,也提示Treg可能更能敏感的反应肝脏的损伤程度,当肝细胞出现严重损伤和坏死的时数量会增加,以阻止机体过度的免疫损伤引起的炎症。慢性肝病进展过程中肝脏发生纤维化时中心环节是HSC的活化,最关键的细胞因子是TGF-β1。TGF-β1对HSC的增生活化具有极其重要的作用,是最强的促纤维化生成因子。早期肝损伤时,体内的炎性细胞如活化的巨噬细胞等能分泌大量细胞因子如TGF-β1、TNF-α、EGF、PDGF等,刺激 HSC 活化转化为肌成纤维细胞;同时活化后的HSC可以自分泌TGF-β1、TNF-α等因子,促进自身进一步活化。而细胞因子之间通过各种细胞间的数种信号传导通路可互相作用,一旦启动,会产生级链瀑布式的效应,在炎症后阶段即使去除原来的肝损因素,也会导致肝纤维化形成的持续[11,12]。而Treg能够分泌细胞因子TGF-β1,同时体外实验研究也表明TGF-β1能够诱导CD4+CD25-T向CD4+CD25+T细胞转化以及促进Foxp3表达[13]。因此,我们推测存在在CHB组与CHB慢性肝病、肝硬化组之间血清AST和血浆TGF-β1水平的显著差异,可能也是Treg在这3组存在显著差异的原因。也表明低水平AST时Treg的增加更能提示肝脏慢性损伤程度。
对于Treg在抗病毒治疗后的CHB慢性肝病、肝硬化患者外周血中仍增高的原因,我们推测,Treg可以敏感地反映存在于慢性肝病、肝硬化患者体内肝脏的炎症损伤情况,保护肝脏避免过度免疫激发所致的病理损伤,同时Treg分泌的TGF-β1等可能促进了HSC的活化;或者通过细胞直接接触与作为APC的HSC发生作用,促进肝纤维化发生;而在肝纤维化肝硬化时患者体内及HSC活化后肝脏局部的纤维化微环境中各种细胞因子,包括由活化后的HSC自分泌的TGF-β1等可能也促进了Treg的进一步增殖分化和发挥功能作用[11~15];或者以上几种作用方式同时存在,并相互关联,互为反馈,与其他致纤维化因素一起促进慢性肝病、肝硬化的形成。因此,Treg可能参与了慢性HBV感染后肝脏疾病慢性化进展的过程。我们将进一步配合肝活检检测慢性乙型肝炎肝纤维化、肝硬化患者肝组织中Treg的表达情况及动态观测抗病毒治疗过程中患者自身对照其外周血Treg数量的变化,并进行体外实验来研究Treg在慢性HBV感染后对肝脏疾病慢性化进展中的具体作用和机制。
1 Chisari FV,Ferrari C.Hepatitis B virus immunopathogenesis.Annu Rev Immunol,1995,13:29-60
2 Franzese O,Kennedy PT,Gehring AJ,et al.Modulation of the CD8+-T-cell response by CD4+CD25+regulatory T cells in patients with hepatitis B virus infection.J Virol,2005,79(6):3322-3328
3 Stoop JN,Van der Molen RG,Baan CC,et al.Regulatory T cells contribute to the impaired immune response in patients with chronic hepatitis B virus infection.Hepatology,2005,41(4):771-778
4 Xu D,Fu J,Jin L,et al.Circulating and liver resident CD4+CD25+regulatory T cells actively influence the antiviral immune response and disease progression in patients with hepatitis B.J Immunol,2006,177(1):739-747
5 Zheng MH,Gu DN,Martin Braddock,et al.CD4+CD25+regulatory T cells:a therapeutic target for liver diseases.Expert Opin Ther Tar-gets,2008,12(3):313-326
6 Alatrakchi N,Kzie M.Regulatory T cells and viral liver disease.Journal of Viral Hepatitis,2009,16:223-229
7 传染病与寄生虫学会.病毒性肝炎防治方案,中华传染病杂志.2001,19:52-62
8 Maloy KJ,Salaun L,Cahill R.CD4+CD25+T(R)cells suppress innate immune pathology through cytokine-dependent mechanisms.J Exp Med,2003,197(1):111-119
9 Seddiki N,Santner-Nanan B,Martinson J,et al.Expression of interleukin(IL)-2 and IL-7 receptors discriminates between human regulatory and activated T cells.J Exp Med,2006,203(7):1693-1700
10 Liu W,Putnam AL,Xu-Yu Z,et al.CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+Treg cells.J Exp Med,2006,203(7):1701-1711
11 Wells RG,Kruglov E,Dranoff JA,et al,Autocrine release of TGF-beta by portal fibroblasts regulates cell growth.FEBS Lett,2004,559:107-110
12 Friedman SL.Mechanisms of hepatic fibrogenesis.Gastroenterology,2008,134:1655-1669
13 Chen W,Jin W,Hardegen N,et al.Conversion of peripheral CD4+CD25-naive T cells to CD4+CD25+regulatory T cells by TGF-beta induction of transcription factor Foxp3.J Exp Med,2003,198:1875-1886
14 Von Borhmer H.Mechanisms of suppression by suppressor T cells.Nat Immunol,2005,6:338-344
15 Winau F,Hegasy G,Weiskirchen R,et al.Ito cells are liver-resident antigen-presenting cells for activating T cell responses.Immunity,2007,26:117-129

