家蚕 Bm NPV多角体蛋白与大肠杆菌L-天冬酰胺酶Ⅱ的融合表达
费建明 吴 岩 占鹏飞 李玉峰 王文兵
(1浙江省湖州市农业科学研究院,浙江湖州 313000; 2江苏大学生命科学研究院,江苏镇江 212013)
家蚕 Bm NPV多角体蛋白与大肠杆菌L-天冬酰胺酶Ⅱ的融合表达
费建明1吴 岩2占鹏飞1李玉峰1王文兵2
(1浙江省湖州市农业科学研究院,浙江湖州 313000;2江苏大学生命科学研究院,江苏镇江 212013)
L-天冬酰胺酶是一种重要的蛋白类抗肿瘤药物,可通过降解 L-天冬酰胺从而抑制肿瘤细胞中蛋白质的正常合成,导致肿瘤细胞的死亡。通过基因融合的方法,将大肠杆菌的asp基因在家蚕杆状病毒中表达,其活性进一步提高到 5 940 U/mg,为利用家蚕生物反应器生产该蛋白打下了基础。
家蚕;多角体;L-天冬酰胺酶;大肠杆菌
L-天冬酰胺是蛋白质合成必需的氨基酸。肿瘤细胞中天冬酰胺合成酶(asparagines synthetase,AS)活性非常低,不能有效合成 L-天冬酰胺,需依赖外源 L-天冬酰胺才能生存和复制。L-天冬酰胺酶(L-asparaginase,L-ASP)可通过降解 L-天冬酰胺从而抑制肿瘤细胞中蛋白质的正常合成,导致肿瘤细胞的死亡[1-3]。L-ASP是一种重要的蛋白类抗肿瘤药物,在临床上广泛用于淋巴瘤和儿童急性淋巴细胞白血病、黑素肉瘤、胰腺癌及霍金森病等疾病的治疗[3-4]。L-天冬酰胺酶Ⅱ的生产大多采用以大肠杆菌为宿主的基因工程菌,存在着发酵水平低和分离纯化步骤繁多等问题[2],难以广泛应用。本试验通过基因融合的方法,将大肠杆菌的 asp基因在家蚕杆状病毒中表达,以提高其活性,为利用家蚕生物反应器生产该蛋白打下了基础。
1材料与方法
1.1 试验材料
1.1.1 质粒、细胞和菌株 pFastBac1载体、DH10BacTM、BmN细胞,由中国科学院上海生物化学与细胞研究所杆状病毒组馈赠;pFastBacHTb-asp重组载体、大肠杆菌 DH5α、鼠源的单克隆多角体抗体,由江苏大学生命科学研究院医学组实验室保存。
1.1.2 酶和试剂 BamHⅠ、EcoRⅠ、HindⅢ等限制性内切酶,T4 DNA连接酶、质粒柱抽试剂盒、胶回收试剂盒等购自 TaKaRa公司;Cellfectin转染试剂购自 Invitrogen公司;TC-100培养基、FBS等购自GIBCO公司。HRP标记的羊抗鼠的 Ig抗体、化学发光剂为 Pierce公司产品,Protein Marker为 Fermentas公司产品,Prestained Protein Marker为 BioLab公司产品。化学试剂均为国产分析纯。PCR引物由上海生工生物工程技术服务有限公司合成。
1.2 试验方法
1.2.1 目的基因克隆及序列分析 根据 GenBank中 BmNPV多角体基因(polh)序列,设计引物 P1:AGGGA TCCatg ccg aat tat tca tac,P2 :CCGAA TTC ata cgc cgg acc agt gaa(下划线表示酶切位点,以下相同),其中在上下游引物分别引入BamHⅠ和 EcoRⅠ酶切位点。根据 pFastBacHTb-asp DNA序列设计引物,其中在上游引物(P3:GAG GGA TCC GAA AACCTG TAT TTTCAG)引入 EcoRⅠ酶切位点,在下游引物(P4:GG AAG CTT TTA GTA CTG ATT GAA GAT CTG CT)引入 HindⅢ酶切位点。将上述扩增产物分别与 pMD18-T simple vector连接。重组质粒的转化、质粒的抽提等基因操作,参照文献[2]进行。酶切鉴定的阳性质粒,送到上海生工生物工程技术服务有限公司测序。
1.2.2 转移载体 pFastBac1-polh-asp的构建 由BamHⅠ和 EcoRⅠ双酶切 pMD18-T-polh,将切下的polh插入至同样酶切的 pFastBac1,构建成重组质粒pFastBac1-polh;然后再将 pMD18-T-tev-asp由 EcoRⅠ和 HindⅢ双酶切,将切下的 tev-asp插入至由同样酶切的 pFastBac1-polh中,构建成重组转移载体pFastBac1-polh-asp。
1.2.3 转座重组及重组病毒的获得 将构建好的转移载体 pFastBac1-polh-asp转化 DH10BacTM,涂布于含 K X-gal(1mg/L)、IPTG(0.8mg/L)、庆大霉素(7μg/mL)、卡那霉素(50μg/mL)、四环素(10μg/m L)的 LB平板,48 h左右挑取白色菌落重新划线,待长出白色菌落后接种于含相应抗生素的 LB培养基中,提取重组 Bacmid DNA,用 M13引物(M 13 Forward(-40):GTTTTC CCA GTC ACG AC,M 13 Reverse:CAGGAA ACA GCT ATG AC)PCR鉴定正确后,得到重组 bacmid-polh-asp。
将提取的重组 Bacmid-polh-asp DNA在脂质体的介导下转染昆虫细胞 BmN,28℃培养 120 h后观察细胞中多角体的产生,用 15 mL的离心管收集孔板中含重组杆状病毒的培养液,1 000 r/min离心5 min以去除细胞及较大的碎片,收集上清即得到原代重组杆状病毒 Bac-asp,并再次感染 BmN细胞,收集病毒液。
1.2.4 Western blot分析 感染的细胞经离心后去上清。用磷酸缓冲液(PBS)洗涤细胞并再悬浮,再加入等量的 2×SDS凝胶上样缓冲液,混匀后,于沸水中煮沸,取上清液按文献[5]进行 8%SDSPAGE。将蛋白转印至尼龙膜上,进行抗体检测。
1.2.5 L-天冬酰胺酶Ⅱ活性分析 使用奈氏试剂(the Nessler reagent)来检测 L-天冬酰胺酶Ⅱ的活性[3]。标准浓度样品为己知浓度的硫酸铵。为排除杆状病毒自身的影响,以 BmBacPAK6为对照。具体步骤如下:将上述收集的细胞悬浮在 2 m L PBS中,采用冰上超声波破碎。破碎条件为强度 70,每超声 15 s,于冰中静置 15 s,如此反复 20次。将100μL的上清与终浓度为 0.25%的底物 L-Asn(溶于 100mmol/L PBS,pH 8.0)混合,在 37℃的水浴中孵育 15 min,用终浓度 5%的三氯醋酸溶液终止反应。加入奈氏试剂,室温反应 15min后于450 nm波长下读取吸收值。L-天冬酰胺酶Ⅱ的酶活性定义为能使底物每分钟释放切 1μmol氨的酶量为 1个单位。相关蛋白质浓度的测定方法采用 BCA蛋白浓度测定试剂盒。
2 结果
2.1 重组载体 pFastBac1-polh的酶切鉴定
BamHⅠ和 EcoRⅠ双酶切 pFastBac1-polh,切出一条 740 bp大小的片段(图 1),其与 polh的PCR产物大小一致,表明重组载体 pFastBac1-polh构建成功。
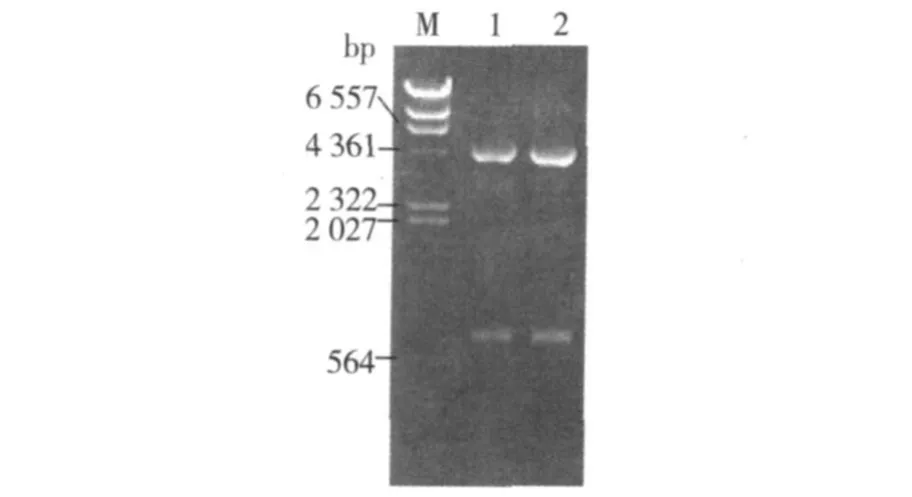
图 1 pFastBac1-po lh的酶切鉴定
2.2 重组转移载体 pFastBac1-polh-asp的酶切鉴定
用 EcoRⅠ和 HindⅢ双酶切 pFastBac1-polhasp,得到约 1 000 bp插入片段,其大小与 asp加TEV酶酶切位点对应的核苷酸序列一致(图 2,泳道1和 2)。由 BamHⅠ单酶切 pFastBac1-polh-asp,切出一条 760 bp大小的片段,这与 polh加 TEV酶酶切位点对应的核苷酸序列的大小一致(图 2)。结果表明重组转移载体 pFastBac1-polh-asp构建成功。
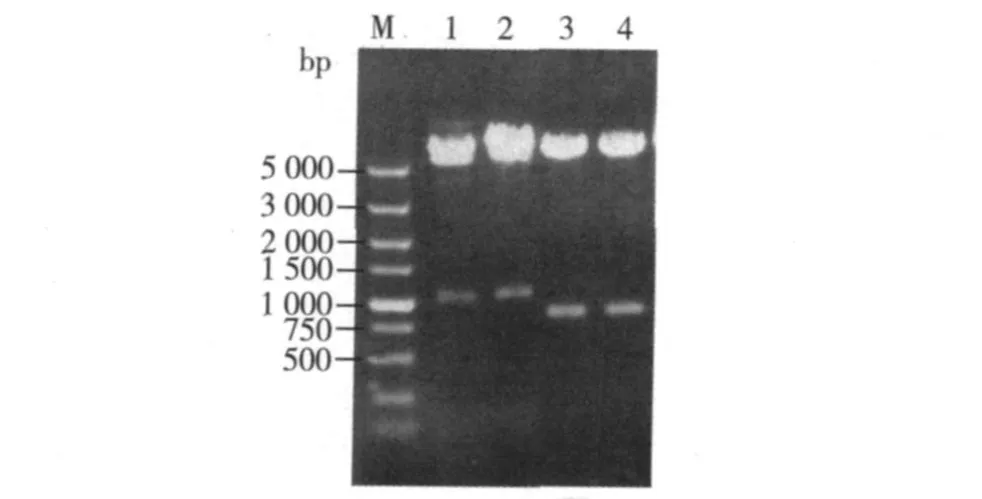
图 2 pFastBac1-polh-asp的酶切鉴定
2.3 Western blot分析
将重组杆状病毒 r-polh-asp和亲本病毒 Bm-pBacPAK6(对照)分别感染昆虫细胞 BmN。培养72 h后,收集感染的细胞。通过 Western blotting对重组病毒的表达结果进行检验。结果表明含重组病毒 r-polh-asp的表达产物在略大于 62 kD处出现一条特异条带,与预期的结果(产物分子量 65 kD)相符,而 Bm-pBacPAK6感染的细胞并没有对应的蛋白带的出现,说明 polh和 asp基因在昆虫细胞 BmN中成功融合表达。
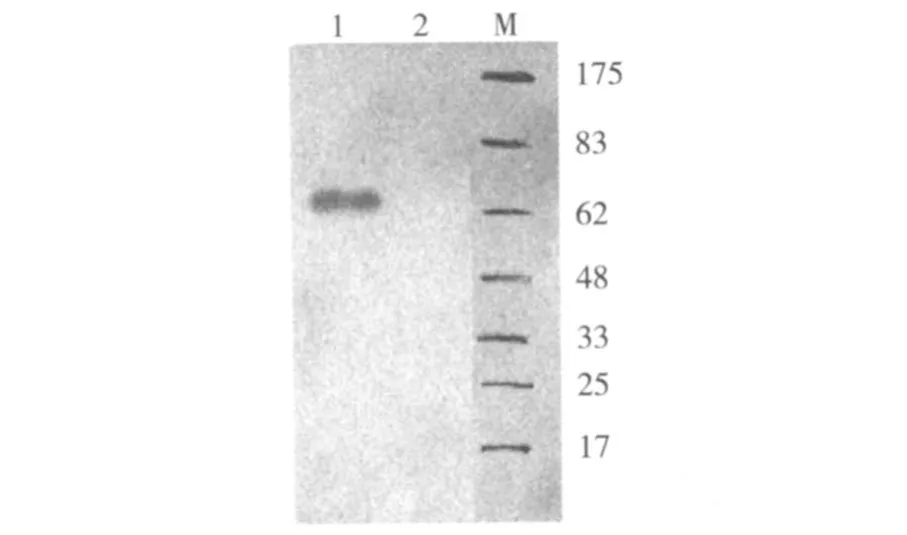
图 3 重组病毒r-polh-asp的表达产物的Western blotting
2.4 L-天冬酰胺酶Ⅱ活性分析
活性使用奈氏试剂(the Nessler reagent)来检测L-天冬酰胺酶Ⅱ的活性。标准浓度样品为己知浓度的硫酸铵。为排除杆状病毒自身的影响,以 Bm-BacPAK6为对照。根据标准曲线计算出在家蚕细胞 BmN中表达的重组大肠杆菌 L-天冬酰胺酶Ⅱ活性为 5 940U/mg。
3 讨论
L-天冬酰胺酶Ⅱ是一种重要的蛋白类抗肿瘤药物。与普通化疗抗癌药相比,L-天冬酰胺酶Ⅱ既可抑制癌细胞增殖,又不伤害正常细胞,有效地实现了酶的特异抗癌作用,因而倍受关注[6-7]。目前,L-天冬酰胺酶Ⅱ的生产大多采用以大肠杆菌为宿主的基因工程菌,进行发酵。但是由于在生产上存在着发酵水平低和分离纯化步骤繁多两方面的问题,国内临床上所用注射 L-天冬酰胺酶主要是依靠进口。因此,构建能高效表达L-天冬酰胺酶并且其表达产物易于被纯化的表达系统尤为重要。
杆状病毒表达系统相对于大肠杆菌、酵母、哺乳动物细胞表达系统具有以下几个方面的优点[8]:一是操作过程安全性高;二是病毒基因组内的多角体基因(polh)等都是病毒复制的非必需基因,其启动子是强启动子;三是可容纳较大的外源片段的插入而不影响基因表达和病毒复制及包装;四是表达水平较高。因此,在本实验中选择杆状病毒表达系统。
为了更高效、更快速地纯化表达产物,将多角体基因和 L-天冬酰胺酶Ⅱ融合表达,其中间以 TEV酶酶切位点连接。多角体基因和 L-天冬酰胺酶Ⅱ融合表达有以下优点:一是便于确定细胞是否被感染,根据细胞是否出现多角体,判断其感染情况。二是多角体是纯化 L-天冬酰胺酶Ⅱ的接头蛋白,通过偶联多角体蛋白抗体的亲和层析柱纯化能得到纯的多角体和 L-天冬酰胺酶Ⅱ融合蛋白。三是由于重组杆状病毒 r-polh-asp能形成多角体,可以通过喂食多角体,使病毒 r-polh-asp感染家蚕并在其体内表达L-天冬酰胺酶Ⅱ;喂食多角体比注射法损伤更小。
[1]Narta UK,Kanwar SS,AzmiW.Pharmacologicaland clinical evaluation of L-asparaginase in the treatment of leukemia[J].Crit Rev Oncol Hem Atol,2007,61(3):208-211.
[2]Kotzia GA,Labrou NE.Cloning,expression and characterisation of Erw inia carotovora L-asparaginase[J].JBiotechnol,2005,119(4):309-323.
[3]李晓媛,陈建华,吴梧桐.PEG-L-天冬酰胺酶的临床研究近况[J].药学进展,2009,33(11):503-510.
[4]Pozsnsky M J,Shandling M,Salkem A.Advantages in theuse of L-asparaginase album in polymer as an antitumor agent[J].Can Res,1982,42:1 020-1 024.
[5]J.莎姆布鲁克 .分子克隆实验指南[M].金冬雁,黎孟枫,译.北京:科学出版社,1995.
[6]Rosti G,Trabacchi E,Bassi S,et al.Risk and early cytogenetic reponse to imatinib and interferon in chronic myeloid leukemia[J].Haematologica,2003,88(3):256-259.
[7]Fernandes A I,GregoriadisG.The effect of polysialylation on the immunogencity and antigencitityofasparaginase:implication in its pharmacokinetics[J].IJP,2001,217:215-224.
[8]吕鸿声.昆虫病毒分子生物学[M].北京:中国农业科学出版社,1998:547-580.
S881.2
A
1007-0982(2011)02-0029-03
2011-02-18;
2011-03-05
费建明(1962—),男,浙江湖州,硕士,高级农艺师。
Tel:0572-2821600,E-mail:ajfjm@163.com

