植物乳杆菌LAI的酵母表面展示*
刘佩 阮晖 沈生荣 周倩 马鎏鏐 何国庆
(浙江大学生物系统工程与食品科学学院,浙江杭州310019)
共轭亚油酸(CLA)是由亚油酸(LA)衍生的一组亚油酸异构体,因具有诸多的生理功能(如抗癌、调节机体免疫、减肥以及预防糖尿病等)而备受关注[1].CLA异构体繁多,目前已检测到的多达28种,而其中具有生物活性的异构体主要是c9,t11-CLA和 t10,c12-CLA[2].
目前,有关生物异构化法合成CLA的研究日益增多,而获得高纯度、高活性异构体含量的CLA逐渐成为研究的主要目标.在CLA生物法合成过程中发挥关键作用的酶是亚油酸异构酶(LAI),最早在反刍动物瘤胃的溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)中被发现[3],之后在许多瘤胃细菌中也检测到了LAI活性[4-8],但其大都是厌氧菌株,对环境要求苛刻,难以培养,而且LAI的分离纯化相对困难,因而应用价值大大降低.随后,人们相继发现,许多乳酸菌菌株,包括嗜酸乳杆菌(Lactobacillus acidophilus)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)、罗伊氏乳杆菌(Lactobacillus reuteri)、干酪乳杆菌(Lactobacillus casei)、德氏乳酸杆菌乳亚种(Lactobacillus delbrueckii subsp lactis)、植物乳杆菌(Lactobacillus plantarum)和双歧杆菌属(Bifidobacterium)等都具有 LAI活性[9],其中乳酸菌菌株易于培养且大多食用安全,其研究和应用价值逐渐凸显.
Cahoon 等[10]最早从苦瓜(Momordica charantia)和凤仙花(Impatiens balsamina)中克隆得到两个酶基因,这两个酶(又被称为共轭酶)能够将LA C-12位上的双键转变为C-11和C-13位共轭双键.随后许多lai基因得以克隆并公布:Stanton等[11]对短双歧杆菌(Bifidobacterium breve)lai基因进行了扩增和序列测定(AX647943),基因全长1 985 bp,编码625个氨基酸;Rosson等[12]分别完成了对 Lactobacillus reuteri和痤疮丙酸杆菌(Propionibacterium acnes)lai基因的克隆及测序;此外,一些菌株如加氏乳杆菌(Lactobacillus gasseri)、詹士乳杆菌(Lactobacillus johnsonii NCC533)、乳酸乳球菌(Lactococcus lactis)、羽状翼藻(Ptilota filicina)的lai基因也相继在Genbank中公布.随着对lai基因的扩增和分析,对其异源表达的研究也逐渐展开,然而目前对乳酸菌来源的lai基因的展示表达以及基因工程菌的改造和构建等还较少研究.
文中对植物乳杆菌(L.plantarum)lp15-2-1株[13]的lai基因进行扩增,并对其编码序列进行比对分析,随后通过构建酵母展示表达载体,展示表达重组LAI,并初步分析其酶活以及产物CLA的构成,以期获得具有较高酶活的酵母工程株,为生物合成CLA的工业化应用打下基础.
1 材料与方法
1.1 菌株和质粒
植物乳杆菌(L.plantarum)lp15-2-1株为笔者所在实验室诱变选育[13],保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏号为CGMCC No.3782);大肠杆菌(Escherichia coli)DH5α购自美国Invitrogen公司;酿酒酵母(Saccharomyces cerevisiae)K601 株(基因缺失型菌株——ade2、his3、leu2、trp1、ura3 5个基因缺失)和酵母表达载体pYES2(ura3、galp、cycit、amp)由山东农业大学生命科学学院郑成超实验室惠赠.
1.2 培养基
培养基主要为溶菌肉汤(LB)培养基、酵母浸出粉胨葡萄糖(YPD)培养基、酵母浸出粉胨半乳糖(YPG)培养基(酵母提取物1%、蛋白胨2%、半乳糖2%,pH=7.0)、尿嘧啶营养缺陷型(SD-Ura)培养基(Ura-Do Supplement 0.077%、无氨基酵母氮源0.67%、半乳糖 2%)和乳酸细菌(MRS)培养基[13-14].
1.3 主要试剂和引物
主要试剂和引物包括:ExTaq DNA聚合酶、dNTP、氨苄青霉素(Amp+)、DL2000和 DL15000 DNA标记物以及pMD 18-T simple载体(pMDS)(Takara-宝生物工程大连有限公司),溶菌酶、胰蛋白胨、酵母提取物、溴乙锭、十六烷基硫酸钠(SDS)、葡萄糖、乙二胺四乙酸(EDTA)、苯酚、氯仿和异戊醇等(上海生工生物工程技术服务有限公司),琼脂糖、质粒DNA提取试剂盒(美国Omega公司),LA、CLA标样(美国Sigma公司).
根据Genbank中酵母信号肽(No:YPL187W)编码序列、凝集素基因(No:YJR004C)序列、植物乳杆菌WCFS1基因组全序列(No:NC004567)和罗伊氏乳杆菌 lai基因(No:AX062045)[12]设计引物,详见表1,引物均由南京金斯瑞生物科技有限公司合成.

表1 实验所用引物序列Table 1 Primer sequences in the study
1.4 实验方法
1.4.1 植物乳杆菌和酿酒酵母基因组DNA的提取
植物乳杆菌培养方法及基因组DNA的提取参见文献[13].
酿酒酵母K601于YPD培养基中、30℃下振荡培养过夜.酵母基因组DNA的提取方法为:取5mL菌液,1000g离心5min;用无菌水洗涤细胞,3000g离心5min,弃上清;将细胞悬浮于0.5mL山梨醇缓冲液中(山梨醇1mol/L,Na2EDTA 0.1mol/L,pH=7.5),加入20μL溶菌酶(10g/L),37℃下温育1h;加入200μL 2%(体积分数)的SDS,-20℃下放置30 min后,于高温水浴中使菌液迅速溶解,反复操作3次;加1/10体积的5mol/L KAc(pH=8.0),混匀后10000g离心10min;将上清转至新的离心管中,加2倍体积预冷的无水乙醇,-20℃下放置5~10 min;12000g离心 5 min,去上清,采用 500 μL TE(Tris-EDTA缓冲溶液)回悬菌体后,加10 μL RNA酶A,37℃下温育30min;加入等体积的苯酚/氯仿/异戊醇(体积比为25∶24∶1)抽提两次,12000g离心5min后,将上清转至新的离心管中;加1/10体积的5mol/L NaAc和0.8倍体积的异丙醇,室温放置20min后,12000g离心10min,弃上清,用75%乙醇洗涤沉淀两次,室温晾干后,加入100μL TE缓冲液(pH=8.0)回溶,-20℃冰箱保存备用.
1.4.2 基因扩增及克隆载体的构建
分别以植物乳杆菌lp15-2-1和酿酒酵母K601基因组DNA为模板,进行PCR扩增,反应体系为:10×PCR 缓冲液(含 Mg2+)5μL,dNTPs(25mmol/L)4μL,引物 1 和引物 2(10 μmol/L)各 1 μL,基因组DNA 1 μg,ExTaqDNA 聚合酶 1 U,加无菌超纯水至终体积50μL;PCR反应条件为:94℃预变性5 min;94℃变性30s,48℃退火30s(基因 mfα1)/50℃退火40s(基因lai和酵母凝集素C端含321 aa的锚定区序列sag),72℃延伸1min,反应30个循环;72℃延伸5min.将PCR产物与克隆载体pMDS连接,连接产物于16℃反应过夜后,转化大肠杆菌DH5α感受态细胞,将转化产物涂布于含0.1 g/L Amp+的LB平板上,37℃下倒置培养18~24 h,挑取单菌斑于LB(含0.1g/LAmp+)液体培养基中培养,并分别提取质粒(pMDS-lai、pMDS-mfα1 和 pMDS-sag)DNA进行PCR和酶切鉴定.
1.4.3 酵母展示表达载体的构建
酵母展示表达载体的构建过程为:先用HindⅢ和EcoRⅠ双酶切质粒pMDS-mfα1和空载体pYES2,回收基因片段mfα1和载体pYES2并连接,构建pYES2-mfα1(pYM)载体;再用 EcoRⅠ和 XhoⅠ双酶切质粒pMDS-lai和pYM,回收lai基因片段并将之插入载体 pYM 中,构建 pYES2-mfα1-lai(pYML)载体;最后用XhoⅠ和XbaⅠ双酶切质粒pMDS-sag和pYML,分别回收并连接基因片段sag和载体pYML,构建酵母展示表达载体 pYES2-mfα1-lai-sag(pYMLS),其结构示意图如图1所示.
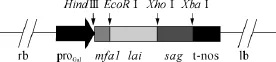
图1 pYMLS结构示意图Fig.1 Schematic diagram of pYMLS structure
1.4.4 电击法转化酵母及转化子的筛选
电击法转化酿酒酵母的具体方法参见文献[14],转化后的酵母细胞涂布在SD-Ura平板上,于30℃下倒置培养48~72h后,挑取单菌斑做PCR鉴定.菌落 PCR鉴定使用引物 LAI-5'和 LAI-3',能扩增出预期大小条带(1700 bp)的菌落即为已经含有质粒pYMLS的酵母工程菌株.
1.4.5 酵母工程菌株细胞及细胞壁的制备
将酵母工程菌株接种于5 mL新鲜的SD-Ura液体培养基中,30℃、180r/min下振荡培养过夜;分别取100μL菌液接种于10 mL YPG(含有2%的半乳糖,作为诱导剂)液体培养基中,30℃、180 r/min下分别振荡培养0、6、12、18、24、30、36、42、48、54、60、66和72h时收集菌液,于4℃、3000g下离心5min,分别收集上清液和酵母细胞;用生理盐水(0.9%NaCl溶液)洗涤细胞两次后,再用0.1mol/L的磷酸缓冲液(PBS)重悬酵母细胞,调整D(600)=2.0.取上述培养48 h的酵母工程菌制备的PBS菌悬液30mL进行酵母细胞壁组分和细胞质组分的分离和提取,具体方法参见文献[15].
1.4.6 LAI酶活的测定
分别往含有不同提取物(上清液、酵母细胞、细胞壁提取物、细胞质提取物)的10mL PBS缓冲液中添加LA(终质量浓度达3 g/L),30℃下振荡培养20h,测定CLA的含量并计算酶活.LAI的酶活力单位(U)为每1 h产1 μg CLA所需要的酶量.CLA的萃取、甲酯化以及气相检测方法参见文献[13].
2 结果及分析
2.1 lai基因的扩增及序列分析
使用引物LAI-5'和LAI-3',以植物乳杆菌 lp15-2-1基因组DNA为模板进行PCR扩增,所得目的基因lai片段长度为1700bp左右;将PCR产物与载体pMDS连接,构建了克隆载体pMDS-lai,基因的PCR扩增及质粒的双酶切(EcoRⅠ和XhoⅠ)电泳检测结果见图2(a).
经测序得知lai基因全长1695 bp,编码565 aa,在Genbank上的注册号为HQ831447.将其编码序列在Blast(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)上搜索,得知该序列与不同来源的肌球蛋白交叉反应抗原(MCRA)蛋白同源性极高:与植物乳杆菌(ZP_07076736)为99.7%,与短乳杆菌 (YP_794478)为84.3%,与干酪乳杆菌 ATCC 334(YP_805714)和BL23(ZP_001986473)为79.5%,与酒类酒球菌PSU-1(YP_811225)为51.8%,而与红串红球菌的LAI(ZP_04386005)同源性为52.7%,与来源于痤疮丙酸杆菌的 C9型异构酶的 PAI同源性仅有11.26%.对PAI的研究表明,该酶属于C9型,主要转化LA 为t10,c12-CLA[16];而其氨基酸序列含有黄素腺嘌呤二核苷酸(FAD)结合基序(GxGxxGx(17-19)E),有利于FAD的结合,从而在异构酶转化合成CLA过程中发挥作用,且FAD的结合很有可能在蛋白的加工折叠过程中就已经完成[17].LAI与不同来源的MCRA蛋白N端的同源性比较如图3所示,来源于植物乳杆菌的LAI的 N端有一个半保守的FAD结合基序(GxGxxNx(15)K/D/E).此结果表明,该酶的作用可能也需要FAD的结合,但由于结合基序的差异,使得FAD与酶分子的结合方式及结合力度与PAI可能并不相同.
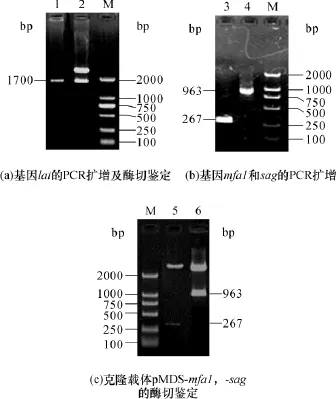
图2 基因lai、mfα1及sag的PCR扩增和克隆载体的酶切电泳图Fig.2 Agarose gel electrophoretograms of PCR amplification of lai,mfα1 and sag genes and restriction analysis of cloning vectors

图3 LAI及MCRA蛋白的FAD结合基序的同源性比较Fig.3 Homology analysis of FAD binding motif of LAI and other MCRA proteins
2.2 酵母展示表达载体的构建
以提取的酿酒酵母K601基因组DNA为模板进行PCR扩增,电泳检测结果见图2(b),分别扩增得到了267 bp(mfα1)和963bp(sag)的片段,完全符合预期值.将所得PCR产物与pMDS克隆载体连接后,转化大肠杆菌DH5α感受态细胞,筛选得到质粒pMDS-mfα1和pMDS-sag,提取质粒 DNA后分别进行酶切鉴定(HindⅢ和EcoRⅠ、XhoⅠ和XbaⅠ),结果见图2(c),图中显示均切出了符合预期大小的条带.通过一系列的酶切以及连接反应,分别将mfα1和sag连接在基因 lai的两侧,并最终将 mfα1-laisag融合基因片段插入到了酵母表达载体pYES2中,构建了酵母展示表达载体pYMLS.分别用HindⅢ和EcoRⅠ、HindⅢ和XhoⅠ以及 HindⅢ和 XbaⅠ对表达载体进行双酶切鉴定,电泳检测结果如图4所示,分别检测到 267 bp(mfα1)、1962bp(mfα1+lai)和2925bp(mfα1+lai+sag)的条带,表明表达载体已经构建成功.
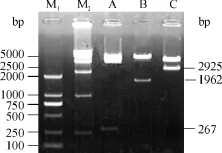
图4 酵母展示表达载体pYMLS的酶切电泳图Fig.4 Electrophoresis analysis of digested yeast cell-surface expression vector pYMLS
2.3 酵母工程菌的PCR鉴定
使用电击法将pYES2空载体及表达载体pYMLS转入酵母K601中,利用尿嘧啶缺失型培养基进行酵母工程菌株的初筛,之后使用引物LAI-5'和LAI-3'进行菌落PCR鉴定酵母转化子,部分酵母工程菌株的PCR鉴定结果见图5.其中除对照菌株外,13株酵母工程菌株中都检测到了预期大小(约1700bp)的条带,表明尿嘧啶缺失型培养基上筛选得到的酵母工程菌株中均含有表达载体pYMLS.
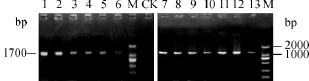
图5 酵母工程菌株的PCR鉴定Fig.5 Identification of genetically engineering yeast by PCR
2.4 CLA异构体的分析与检测
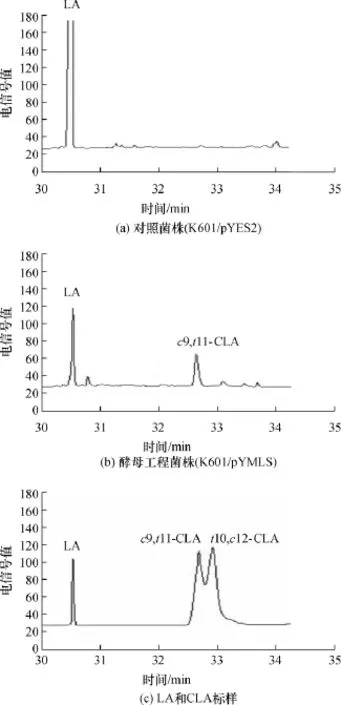
图6 酵母工程菌株CLA产物的气相色谱图Fig.6 GC chromatograms of CLA produced by genetically engineering yeast
气相色谱法对LA和CLA甲酯标样的检测结果如图6所示.由图6可见,LA的出峰时间为30.46min,而CLA中的两种异构体 c9,t11-CLA和 t10,c12-CLA得到了较好的分离,其保留时间分别为32.62和32.83min.利用气相色谱分析法对酵母工程菌株细胞合成CLA产物进行分析,发现转有空载体pYES2的阴性对照菌株培养液中并没有明显的CLA产生;而含有酵母展示表达载体pYMLS的酵母工程菌株培养液催化LA后,产物在保留时间为30.28和32.45min时出现典型峰,比对标准品的保留时间得知,二者分别为LA和c9,t11-CLA;含有质粒pYMLS的酵母工程菌株的培养液中检测到了CLA的存在,表明lai基因在酵母中展示表达成功,且LAI能够将LA转化为单一的c9,t11-CLA异构体.
2.5 LAI的定位及酶活测定
为了检测酵母工程菌株中LAI的定位,分别对诱导培养48 h的酵母工程菌株上清液、酶母细胞、细胞壁提取物和细胞质提取物进行酶活测定,结果见表2.对照菌株(K601/pYES2)各种组分中均未检测到LAI活性,而在6株转有pYMLS的工程菌株(K601/pYMLS)中(表2中1-6号),分别在酵母细胞和细胞壁提取物中检测到了LAI的活性,酶活最高达40.5 U/mL,并且酵母细胞和细胞壁提取物中的酶活基本一致,表明酵母工程菌株中LAI已经成功在酵母细胞表面展示表达.因此在对酵母工程菌株的后期研究以及应用过程中,可直接收集酵母细胞进行酶活测定以及CLA的合成,避免了细胞生长过程中添加LA而产生的毒害作用以及细胞将LA作为碳源而造成的消耗.
随后,选取1号酵母工程菌株,分别在YPG诱导培养基中培养0~72 h,收集酵母细胞,检测LAI酶活的变化,结果见图7.由图7可知,随着培养时间的延长,酶活逐渐增加,在48 h时达到最大,为40.5U/mL;随后酶活逐渐降低,这可能是由于培养时间的延长,致使培养基中发挥诱导作用的半乳糖被酵母细胞逐渐消耗,以及工程菌株中质粒在无选择压力的情况下丢失[18-19].此外,与植物乳杆菌lp15-2-1 LAI天然酶活(14.2 U/mL)相比[20],工程菌株的最大酶活增长了约1.9倍;与C9型PAI相比,异源表达PAI的酵母以及烟草中并未检测到CLA,即PAI经异源表达后并无酶活,而其编码序列按照酶母中的密码子偏好性经密码子优化后得到CoPAI,CoPAI经异源表达后有酶活,能够转化LA合成微量的 CLA,且产物为 t10,c12-CLA[16],本研究展示表达在酵母细胞表面的 LAI能够转化合成c9,t11-CLA异构体,该酶很可能作用于LA的C-12位,属于C12型异构酶.因此也许可以通过对半乳糖诱导培养条件的摸索、对表达载体诱导启动子的改进或更换以及对LAI编码序列进行密码子的优化等方法,进一步增强基因的表达进而提高酶活力.此研究为探讨LAI的作用机制和继续构建乳酸菌展示表达载体,以及在乳酸菌中展示表达LAI奠定了良好的理论基础.
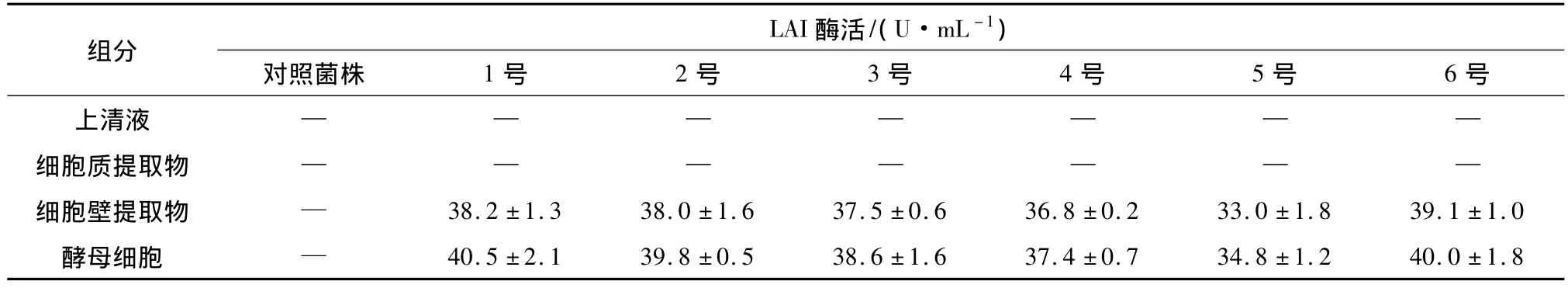
表2 酵母工程菌株不同组分中LAI酶活的分布1)Table 2 Distribution of LAI activities in different components of genetically engineering yeast

图7 酵母工程菌株LAI酶活-时间曲线Fig.7 Time course of LAI activity in genetically engineering yeast
3 结语
文中成功地从植物乳杆菌lp15-2-1基因组DNA中扩增得到全长1 695 bp的 lai基因,编码565aa,基因编码序列的N端存在一个半保守的FAD结合基序GxGxxNx(15)K/D/E;随后通过构建酵母展示表达载体、电击转化酿酒酵母K601,首次获得了展示表达LAI的酵母工程菌株.对工程菌株细胞不同组分酶活的测定表明,LAI成功地展示在了酵母细胞表面,最高酶活达40.5U/mL,并能够转化LA为单一的c9,t11-CLA异构体.通过LAI的展示表达,不仅避免了表达产物的胞内降解,减少了酶分离纯化的步骤,也大大简化了产物CLA的分离提取过程,为CLA的工业化生产以及在食品上的应用打下了基础.同时,本研究也为进一步将lai基因在食品级微生物中表达、生产单一的CLA异构体、开发保健功能性食品等提供了可能.
[1]Bhattacharya A,Banu J,Rahman M,et al.Biological effects of conjugated linoleic acids in health and disease[J].The Journal of Nutritional Biochemistry,2006,17(12):789-810.
[2]Churruca I,Fernandez-Quintela A,Portillo M P.Conjugated linoleic acid isomers:differences in metabolism and biological effects[J].Biofactors,2009,35(1):105-111.
[3]Kepler C R,Hirons K P,Mcneill J J,et al.Intermediates and products of the biohydrogrnation of linoleic acid by Butyrivibrio fibrisolvens[J].The Journal of Biological Chemistry,1966,241(6):1350-1354.
[4]Wise M L,Hamberg M,Gerwick W H.Biosynthesis of conjugated triene-containing fatty acids by a novel isomerase from the red marine alga Ptilota filicina [J].Biochemistry,1994,33(51):15223-15232.
[5]Kim Y J,Liu R H,Bond D R,et al.Effect of linoleic acid concentration on conjugated linoleic acid production by Butyrivibrio fibrisolvens A38 [J].Applied and Environmental Microbiology,2000,66(12):5226-5230.
[6]Kim Y J,Liu R H,Rychlik J L,et al.The enrichment of a ruminal bacterium(Megasphaera elsdenii YJ-4)that produces the trans-10,cis-12 isomer of conjugated linoleic acid [J].Journal of Applied Microbiology,2002,92(5):976-982.
[7]Verhulst A,Janssen G,Parmentier G,et al.Isomerization of polyunsaturated long chain fatty acids by Propionibacteria [J].System and Applied Microbiology,1987,9:12-15.
[8]Devillard E,McIntosh F M,Duncan S H,et al.Metabolism of linoleic acid by human gut bacteria:different routes for biosynthesis of conjugated linoleic acid [J].Journal of Bacteriology,2007,189(6):2566-2570.
[9]王红军,曹建,王育军,等.微生物共轭亚油酸异构酶的生物学研究[J].河南工业大学学报:自然科学版,2007,28(5):80-87.Wang Hong-jun,Cao Jian,Wang Yu-jun,et al.Biological research on conjugated linoleic acid isomerase of microorganisms[J].Journal of Henan University of Technology:Natural Science Edition,2007,28(5):80-87.
[10]Cahoon E B,Carlson T J,Ripp K G,et al.Biosynthetic origin of conjugated double bonds:production of fatty acid components of high-value drying oils in transgenic soybean embryos[J].Proceedings of the National Academy of Sciences,1999,96(22):12935-12940.
[11]Stanton C,Ross R P,Zelder O.Conjugated linoleic acid isomerase and a process for the production of conjugated linoleic acid:US,7223543B2 [P].2007-05-29.
[12]Rosson R A,Grund A D.Linoleate isomerase:CA,2377-473A1[P].2001-01-04.
[13]刘佩,周倩,沈生荣,等.产共轭亚油酸植物乳杆菌的筛选、鉴定和诱变[J].食品科学,2010,31(9):135-138.Liu Pei,Zhou Qian,Shen Sheng-rong,et al.Screening,identification and breeding of conjugated linoleic acid producing Lactobacillus plantarum by mutation [J].Food Science,2010,31(9):135-138.
[14]Sambrook J,Russell D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2002.
[15]Su G D,Zhang X,Lin Y.Surface display of active lipase in Pichia pastoris using Sed1 as an anchor protein [J].Biotechnology Letters,2010,32(8):1131-1136.
[16]Hornung E,Krueger C,Pernstich C,et al.Production of(10E,12Z)-conjugated linoleic acid in yeast and tobacco seeds[J].Biochimica et Biophysica Acta,2005,1738(1/2/3):105-114.
[17]Liavonchanka A,Rudolp M,Tittmann K,et al.On the mechanism of a polyunsaturated fatty acid double bond isomerase from Propionibacterium acnes[J].The Journal of Biological Chemistry,2009,284(12):8005-8012.
[18]Guo Q,Zhang W,Ma L L,et al.A food-grade industrial arming yeast expressing β-1,3-1,4-glucanase with enhanced thermal stability[J].Journal of Zhejiang University Science B(Biomed & Biotechnol),2010,11:41-51.
[19]Štagoj M,Komel R.The GAL induction response in yeasts with impaired galactokinase Gallp activity[J].World Journal of Microbiology and Biotechnology,2008,24(10):2159-2166.
[20]周倩.植物乳杆菌lp15-2-1转化合成共轭亚油酸的研究[D].杭州:浙江大学生物系统工程与食品科学学院,2011.

