高产β-葡聚糖酶菌株初步筛选与鉴定
邵金华,朱智勇,刘 欢,邓 佳,欧阳青,李军艳
(湖南科技学院,湖南 永州 425100)
β-葡聚糖酶是一类能降解谷物中β-葡聚糖的水解酶类的总称,包括1,3-1,4-β-葡聚糖酶、1,3-β-葡聚糖酶、1,2-1,4-β-葡聚糖酶、1,4-β-葡聚糖酶和1,3-1,6-β-葡聚糖酶,均属于半纤维素酶类[1]。β-葡聚糖酶能降解β-葡聚糖分子中的β-1,3和β-1,4糖苷链,使之降解为小分子的还原糖和寡糖,失去亲水性和粘性。随着人们对β-葡聚糖酶的深入研究,β-葡聚糖酶在食品、酿造、饲料和日化等工业方面应用价值正逐渐地显现出来[2]。β-葡聚糖酶作为一种新型添加剂,具有广泛而显著的经济效益和社会效益,开发前景十分广阔[3]。笔者对β-葡聚糖酶进行了深入的生物学研究,旨在筛选出能产生适应不同应用目标的β-葡聚糖酶的野生菌株,为今后生产出活力高、稳定性好的β-葡聚糖酶提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试土样 采自湖南省永州市阳明山、菜地、路边、西山等地,取其3~10 cm深层土壤。
1.1.2 试 剂 标准大麦β-葡聚糖购自Sigma公司;β-葡聚糖,天津市光复精细化工研究所,纯度99.9%;其他试剂均为AR级或BR级商品试剂。
1.1.3 培养基 (1)基本培养基(g/l00 mL):蛋白胨 1.0,牛肉膏0.4,琼脂 1.8,NaCl 0.4,pH值7.2,121℃灭菌25 min。(2)分离培养基(g/l00 mL):大麦β-葡聚糖 0.2,刚果红 0.004,琼脂 1.8,KNO30.1,NaH2PO40.12,MgSO40.03,CaCO30.01,pH 值 7.2,121℃灭菌25 min。(3)发酵培养基(g/l00 mL):大麦粉 4.0,玉米粉 3.0,豆饼粉 3.0,KH2PO40.002,Mg-SO40.02,CaCO30.05,pH 值 7.1,121℃灭菌 25 min。(4)PDA 培养基(g/l00 mL):马铃薯(去皮)20.0,蔗糖(或葡萄糖)2.0,琼脂2,水100 mL,pH值自然,121℃灭菌 25 min。
1.2 方法
1.2.1 菌种初步筛选 (1)样品的采集与处理:在永州市阳明山、菜地、路边、西山等不同地点共采集了46个土样,经去杂、风干装入已灭菌的牛皮纸袋内,封好袋口,备用。(2)富集培养:称取处理过的土样l g,加入装有50 mL已灭菌的富集培养基中的三角瓶中,30℃恒温培养48 h,每4 h摇匀1次,每个土样做3个平行。富集培养48 h后进行平板分离。(3)菌种分离:将富集培养物用无菌生理盐水稀释成 10-2~10-7六个梯度,选择 10-4,10-5,10-6三个梯度试管菌种,用灭菌的移液管取0.5 mL,涂布接种到以β-葡聚糖为唯一碳源的分离培养基平板上,30℃培养2~3 d,每个梯度重复3次。从中挑取生长良好的菌落接种于斜面培养基保存。(4)菌种初筛:将分离出的菌种点接在初筛培养基平板上,置于30℃培养2~3 d,凡在菌落周围能使刚果红褪色形成透明圈的菌株,即为产酶菌株。将筛选出的菌株连续重复3次点接在初筛培养基上,挑选透明圈与菌落直径之比大的菌株,接种斜面保存并编号。(5)菌种纯化:将初筛出来的菌种点接在PDA培养上,连续培养5代,至每个菌种的每个菌株的菌落形态、颜色等相同,并在显微镜下观察菌丝体、孢子的形态,直至纯化为止。(6)菌种复筛:取斜面保藏的菌种,接种于新鲜的斜面培养基上进行活化,接种到液体产酶培养基中(250 mL三角瓶,内装50 mL已灭菌的液体产酶培养基),于30℃,150 r/min摇床恒温培养3 d。培养过程结束后,取发酵液进行β-葡聚糖酶活力的测定。(7)酶活力的测定:采用DNS比色法[4-5]。取4 mL摇瓶发酵液经8 000 r/min离心10 min。取上清液用0.2 mol/L、pH值5.0的乙酸缓冲液稀释适当倍数,取经40℃预热的此稀释液1.0 mL,加入经40℃预热的1.0% β-葡聚糖溶液1.0 mL,混匀,加入蒸馏水混匀,40℃下恒温反应10 min,然后加入2.0 mL DNS停止反应,摇匀,100℃水浴5 min,冷却至室温后用去离子水定容至5.0 mL,测定OD520值。取稀释酶液1.0 mL,先加入2.0 mLDNS,再加入1.0%β-葡聚糖溶液1.0 mL为空白溶液。酶活定义:在本试验条件下,每分钟分解β-葡聚糖产生相当于l μmol葡萄糖所需的酶蛋白的量定义为一个酶活单位。
1.2.2 菌种初步鉴定[6-7](1)菌落形态特征观察:将保藏的菌种接种于新鲜的斜面培养基上,进行菌种活化,活化后轻轻点接于PDA平板中央,30℃下恒温培养2~3 d,3次重复,培养期间观察菌落形态特征,并进行记录、拍照。(2)显微镜下观察(插片法):取融化并冷却至大约50℃的PDA培养基约20 mL倒平板,待培养基凝固后,将菌种划线在培养基上,以无菌操作用镊子将无菌的盖玻片以大约45°角插入培养基内,其中盖玻片与插入的面与划的线平行,每个平板插3个,将平板倒置,30℃下恒温培养,3次重复。待菌丝在盖玻片上的长度大约0.5 cm后,用镊子小心拔出盖玻片,擦去背面培养物,然后将有菌的一面朝上放在载玻片上,在显微镜下镜检。
2 结果与分析
2.1 菌种初筛结果
将分离后的菌株接种于初筛培养基平板上,30℃恒温培养,能够产生透明圈的菌株共有48株,如表1所示,透明圈直径与菌落直径之比>1.4的菌株有9株。
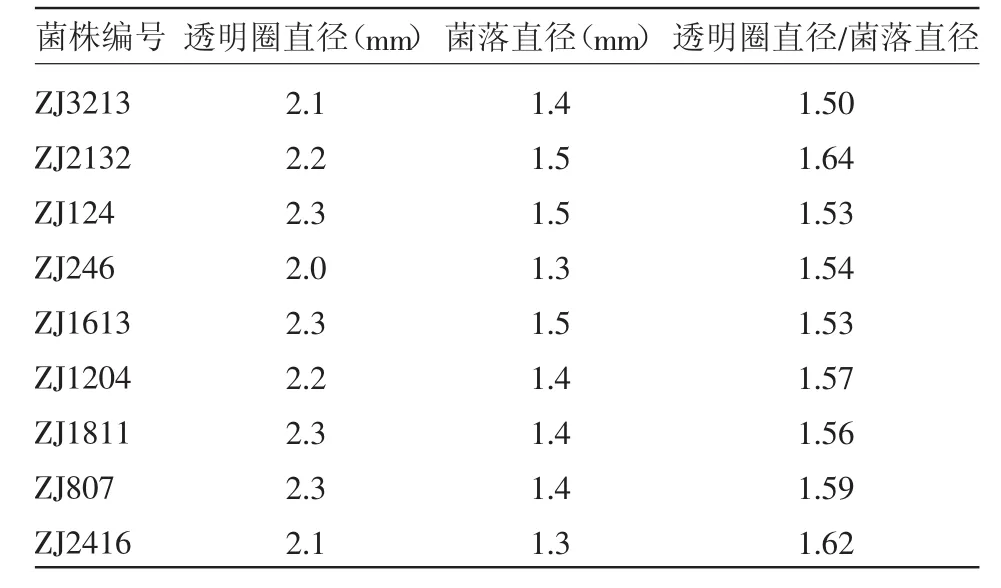
表1 平板初筛结果
2.2 菌种复筛结果
将初筛得到的9株菌株进行纯化,纯化后的菌株接种于产酶培养基中进行摇瓶培养,分析各菌株的产酶活力情况,结果如图1所示,透明圈直径与菌落直径之比最大以及酶活最高的菌株为ZJ2132,因此,确定该菌株为后续研究的出发菌株。图2为ZJ2132纯化后30℃培养48 h后产生的形态。
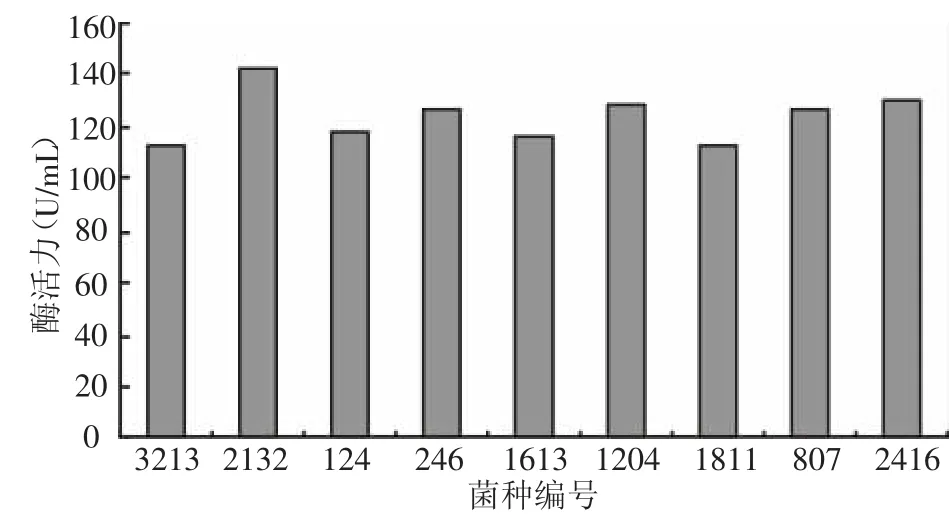
图1 初筛菌株产β-葡聚糖酶活力比较
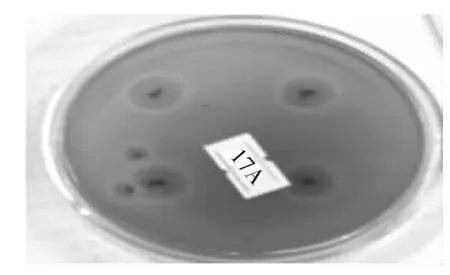
图2 ZJ2132在初筛培养基上的菌落形态
2.3 菌种鉴定
2.3.1 菌落形态特征 将活化后的ZJ2132菌种划线接种于PDA培养基上,30℃恒温培养3 d后,菌落平板如图3所示:培养1 d时,菌落呈圆形、白色、致密,菌落直径1 cm,菌丝呈白色,纤细;培养2 d时,菌落棉絮状,产孢从束区排列成同心圆轮纹,中央产生绿色孢子,中央变成绿色,大部分菌丝为基内菌丝,匍匐生长,气生菌丝较少,四周新生的菌丝为白色,菌落直径达3.0 cm,中央出现隆起;培养3 d时,菌落圆形、致密,呈同心圆环状向四周拓展,直径达5.5 cm,绿色孢子布满菌落,呈蓝绿色,白色菌丝被覆盖,培养基颜色无明显变化,没有明显的渗出物,无明显气味。
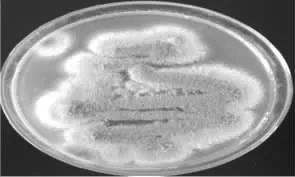
图3 ZJ2132菌种划线接种形态
2.3.2 显微镜下的观察(插片法) 菌种采用插片法进行制片,然后在显微镜下观察,结果如图4所示:菌种ZJ2132的菌丝为树枝状,非轮枝状,有隔;分生孢子梗光滑、较粗,淡褐色;顶囊呈球形,淡绿色;小梗双层、无色,分生孢子呈卵圆形。

图4 ZJ2132镜检图(油镜100倍)
根据《真菌鉴定手册》和《常见与常用真菌》中关于木霉属的描述,实验中菌落、菌丝及孢子等表现出的形态特征,将ZJ 2132菌株初步鉴定为木霉属中的Trichoderma sp.。
3 结论
从土壤中采用刚果红葡聚糖培养基对产生菌进行筛选,分离出9株透明圈直径与菌落直径之比>1.4的菌株;通过摇瓶复筛,确定了一株产β-葡聚糖酶酶活相对较高的菌株,命名为ZJ2132,其产酶活性为142.36 U/mL;通过对菌株ZJ2132的菌落和个体形态特征的观察,初步确定该菌株ZJ2132为木霉属中的Trichoderma sp.。该菌株酶活高于大多文献报道的产β-葡聚糖酶酶活,因此极具应用开发价值。
[1]郭小权,胡国良,刘 妹.β-葡聚糖的抗营养作用及β-葡聚糖酶在饲料中的应用[J].江西饲料,2001(2):11-13.
[2]张 洁、蔡敬民,吴 克,等.β-葡聚糖酶的研究与应用前景[J].安徽农业科学,2003,31(5):893-896.
[3]李孝辉、钱玉英.大麦饲料的开发及β-葡聚糖酶的应用[J].粮食与饲料工业,1997,(8):19-20.
[4]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].北京:高等教育出版社,1997.
[5]刘永举,王清吉,王江青,等.DNS法测定饲用β-葡聚糖酶活力[J].中国饲料,1999,(18):26-27.
[6]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[7]中国科学院微生物研究所《常见与常用真菌》编写组.常见与常用真菌[M].北京:科学出版社,1973.

