SCCmecIII型MRSA诱导SD大鼠肺泡巨噬细胞凋亡的研究*
黄荣宁,纵 帅,贾 伟,赵志军,潘月英,徐广贤,魏 军
2.宁夏医科大学检验学院,银川 750004;
3.宁夏医科大学附属总医院医学实验中心,银川 750004
SCCmecIII型MRSA诱导SD大鼠肺泡巨噬细胞凋亡的研究*
黄荣宁1,纵 帅2,贾 伟3,赵志军3,潘月英3,徐广贤2,魏 军3
目的 研究SCCmecIII型耐甲氧西林金黄色葡萄球菌(MRSA)诱导SD大鼠肺泡巨噬细胞(AM)凋亡的能力。方法 荧光显微镜和流式细胞仪分别用于观察和检测MRSA感染AM 2h、6h和12h后Annexin V-FITC/PI染色的凋亡细胞形态和凋亡率,实时荧光定量PCR(qRT-PCR)检测凋亡相关基因。结果 AM在MRSA感染后6h和12h时凋亡率与对照组相比差别均有统计学意义(P<0.01);感染12h时凋亡相关基因Apaf-1、caspase-9和Bax表达显著上调,Bcl-2mRNA表达显著下调(P<0.05)。结论 MRSA可通过线粒体通路经多基因参与诱导AM凋亡;AM凋亡的研究可为MRSA肺部感染时AM凋亡分子机制的进一步研究提供基础。
耐甲氧西林金黄色葡萄球菌;肺泡巨噬细胞;细胞凋亡
2.宁夏医科大学检验学院,银川 750004;
3.宁夏医科大学附属总医院医学实验中心,银川 750004
肺泡巨噬细胞(alveolar macrophage,AM)是一种高度分化、成熟的单核吞噬细胞,由血液中单核细胞迁入肺组织后分化而成,是肺部感染时免疫调节的核心细胞。国内外研究表明,不仅某些革兰阴性菌可以诱导巨噬细胞的凋亡,金黄色葡萄球菌(Staphylococcusaureus,SAU)也能够诱导包括巨噬细胞在内的多种免疫细胞凋亡[1-3]。耐甲氧西林金黄色葡萄球菌 (methicillin-resistantStaphylococcusaureus,MRSA)作为一种含有耐药基因的特殊SAU,其诱导AM凋亡的能力和途径尚未见详细报道。本研究通过建立SD大鼠AM体外培养和感染模型,研究SCCmecIII型MRSA诱导AM凋亡的能力,旨在初步探讨MRSA肺部感染时AM凋亡及其分子机制。现报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年SD雌性大鼠由宁夏医科大学动物实验中心提供,饲养至体质量为(275±25)g后用于实验。
1.1.2 主要试剂和仪器 MH 琼脂培养基,DPBS,细胞培养液(含10%胎牛血清的RPMI1640培养液),Annexin V-FITC/PI凋亡试剂盒,TRIzol,大连宝生物Prime Script RT reagent和SYBR Premix Ex TaqTM II试剂盒;实验凋亡相关基因引物由上海生工生物技术有限公司设计合成;高速低温离心机,日本OLYMPUS BX51/DP72荧光显微镜,美国Guava流式细胞仪,ABI PRISM7300Real-Time PCR仪。
1.2 实验方法
1.2.1 菌株及菌液制备 本实验所用MRSA菌株分离自宁夏医科大学附属医院烧伤科一院内感染患者,其分离、培养和鉴定依照《全国临床检验操作规程》(第3版)和美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)2010标准[4]执行。经DNA 提取,特异片段PCR扩增和琼脂糖凝胶电泳[5],鉴定为SCCmecIII型MRSA。SAU标准菌株ATCC25923作为本实验的质控菌株,同时作为甲氧西林敏感性金黄色葡萄 球 菌 (methicillin-sensitiveStaphylococcusaureus,MSSA)用于实验。MRSA与MSSA一起经药敏试验后用于实验。上述实验菌株接种于MH平板,37℃培养16~18h后,挑选单个生长菌落用生理盐水洗涤3次后细胞培养基重悬,麦氏比浊仪调节菌悬液终浓度为3个 MCF单位(9×108cfu/mL),4℃冷藏备用。
1.2.2 AM的获取和纯化 使用3.5%水合氯醛腹腔注射麻醉SD大鼠,经75%的乙醇浸泡口腔以下部位消毒后分离气管,10mL注射器吸取4℃DPBS经输液管冲洗肺泡并回抽肺泡灌洗液,重复数次,直至收集50mL灌洗液,4℃1000g离心10min,弃上清,加入细胞培养液重悬细胞,得到的即为AM。将上述细胞悬液置于6孔板5%CO2、37℃条件下培养4h,DPBS洗涤除去非贴壁细胞,得到纯化的AM。重悬至106个/mL继续培养4h贴壁,用于后续试验。
1.2.3 凋亡细胞的形态观察和凋亡率检测 将纯化后在6孔板中贴壁培养4h的AM培养液弃去并加入新鲜细胞培养液,设置2h、6h和12h3个时间点,分对照组、MRSA组和MSSA组进行试验,第1组为空白对照,第2和第3组分别加入上述MRSA和MSSA菌液100μL,于5%CO2、37℃培养后分别收集上述时间点细胞,按Annexin V-FITC/PI试剂盒说明进行染色后荧光显微镜观察凋亡细胞形态。完全相同的方法处理后用流式细胞仪检测上述时间点的AM凋亡率。实验重复3次。
1.2.4 qRT-PCR检测凋亡相关基因 凋亡基因及内参基因β-action引物由上海生工生物技术有限公司合成,序列见表1。质粒标准品的制备参照文献[6],并依次稀释为5个梯度备用。采用TRIzol一步法抽提三组AM总RNA,鉴定合格后按试剂盒说明反转录出cDNA,进而以梯度浓度的质粒标准品及cDNA为模板,按SYBR Premix Ex TaqTM II试剂盒说明配制反应体系,ABI PRISM 7300Real-Time PCR System两步法进行扩增检测。实验重复3次。

表1 细胞凋亡相关基因引物Table 1 Primers of genes associated with apoptosis
1.3 统计学方法 采用SPSS 11.5统计软件进行统计学处理,计量资料均以±s表示,经Levene检验证实方差齐(P>0.05)后行采用单因素方差分析,组间多重比较采用LSD-t检验,组内两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
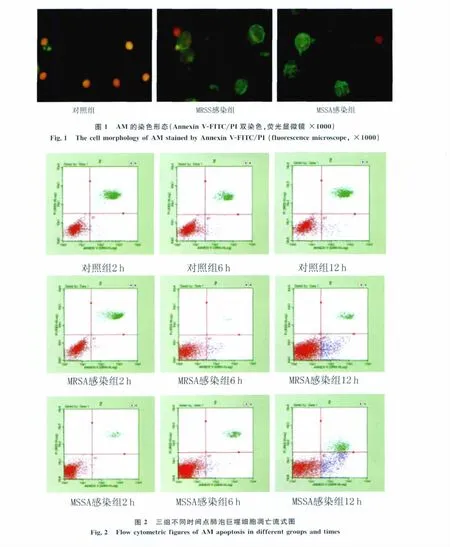
2.1 凋亡细胞在荧光显微镜下的形态 根据Annexin V-FITC/PI染色原理和说明操作,荧光显微镜下可见凋亡细胞,对照组凋亡的AM较少,MSSA和MRSA感染组均可见数量不等的凋亡细胞,其数量随着感染时间的延长而增加。感染12h的凋亡细胞染色形态见图1。根据染色原理,图中绿色细胞为凋亡细胞,细胞核呈橙/红色的细胞为死亡细胞。
2.2 不同时间点AM凋亡率的检测 Annexin VFITC/PI染色后,在488nm激发波长下经流式细胞仪检测细胞凋亡率,结果见图2,图中右下象限(LR区)内Annexin V-FITC+/PI-细胞代表早期凋亡细胞。对照组AM仅2h与12h间凋亡率差异有统计学意义,两感染组凋亡率均随感染时间的延长而增加,各时间点间差异均有统计学意义(F=114.943,P<0.01;F=56.878,P<0.01);三组间在2h的凋亡率无统计学意义(F=1.476,P=0.301),但两个感染组与对照组在6h和12h凋亡率差别有统计学意义(F=41.946,P<0.01;F=105.553,P<0.01);MRSA感染组与MSSA感染组在三个时间点的凋亡率差异均不具有统计学意义(P>0.05)。各组不同时间点凋亡率见表2。
表2 AM在三组不同时间点的凋亡率(%,±s)Table 2 The apoptosis rate of AM in different groups and times(%,±s)
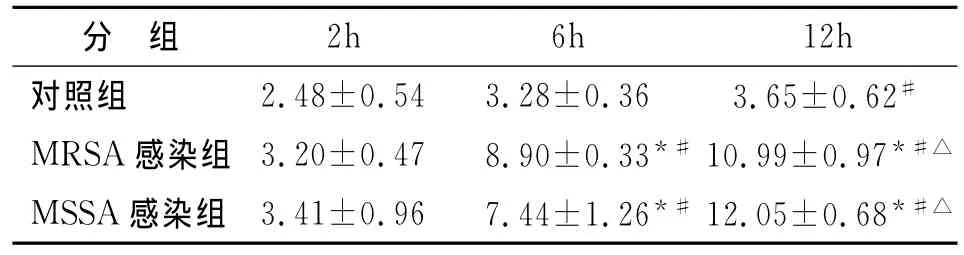
表2 AM在三组不同时间点的凋亡率(%,±s)Table 2 The apoptosis rate of AM in different groups and times(%,±s)
LSD-t test or SNK-qtest:compared with control group at the same time,*P<0.01.In the same group,compared with 2h,#P<0.01,compared with 6h,△P<0.05
分 组2h 6h 12h对照组 2.48±0.54 3.28±0.36 3.65±0.62#MRSA感染组 3.20±0.47 8.90±0.33*#10.99±0.97*#△MSSA感染组 3.41±0.96 7.44±1.26*#12.05±0.68*#△
2.3 凋亡相关基因的的qRT-PCR结果 根据上述凋亡率的实验结果和趋势分析,本实验选取12h点进行 Apaf-1、caspase-9、Bax和 Bcl-2等四种凋亡相关基因的qRT-PCR检测。实验结果显示,与对照组相比,感染12h后,Apaf-1、caspase-9和 Bax的mRNA表达显著上调(P<0.05),Bcl-2的 mRNA表达显著下调(P<0.05)。qRT-PCR相对定量结果见图3。
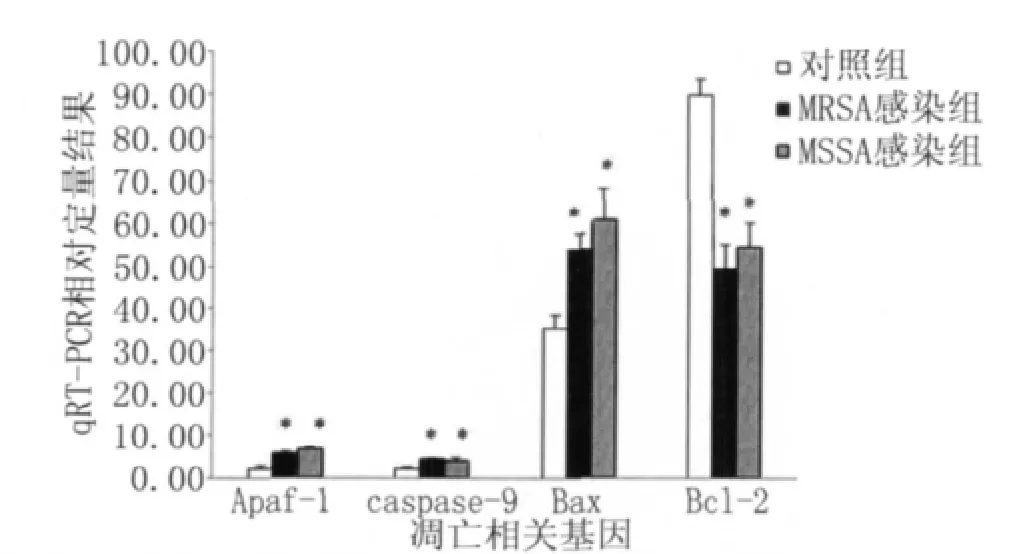
图3 四种凋亡相关基因的qRT-PCR相对定量结果Fig.3 The qRT-PCR relative quantitative results of four genes associated with apoptosis
3 讨 论
MRSA是目前最主要的医院内感染革兰阳性菌,我国大陆地区院内感染分离株以SCCmecIII型为主[7],因此,本实验选取院内感染患者分离的SCCmecIII型MRSA株来研究SD大鼠肺部感染时AM的凋亡具有代表性。在MRSA所致的严重临床感染中最重要的就是菌血症和院内获得性肺炎(HAP),同时MRSA也是引起世界范围内HAP高发病率和高死亡率的重要病原菌[8]。AM作为肺部免疫应答的核心细胞,在由微生物感染引起的肺部炎症和损伤时最早被激活并参与一系列的免疫反应,其中,介导和调控AM凋亡便是其维持肺部正常免疫稳定状态的重要方式之一。
在正常细胞,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的PS由脂膜内侧翻向外侧,同时保持细胞膜的完整性;Ca2+依赖性磷脂结合蛋白Annexin V可与PS高亲和力特异性结合,核酸染料Propidium iodide(PI)可与细胞核结合,但不能透过完整的细胞膜。基于以上原理,本实验采用Annexin V-FITC/PI双染法,可看到图1所示的凋亡细胞。在本实验三个既定的时间点,体外培养的AM自发凋亡率低,且随时间延长增加缓慢。MRSA和MSSA感染后2h时,由于细菌此时处于迟缓增长期,数量较少,诱导AM产生凋亡的数量亦较少;随着时间的延长,细菌进入快速的对数增长期,细菌大量繁殖,数量增长迅速,被吞噬进入AM内的细菌数量显著增加,继而引起细胞内一系列反应,并通过一定的途径诱导AM凋亡,细胞的凋亡率不断增加(见表2),相关研究结果与刘勇等报道相似[3]。本实验结果提示MRSA具有诱导AM凋亡的能力,但结果同时表明,MRSA和MSSA诱导AM凋亡的能力差异没有统计学意义,这可能与它们对细胞的侵袭过程和侵袭力均相似有关[9]。
AM凋亡的确切机制和具体通路至今尚未阐明,经典的细胞凋亡通路有线粒体通路和细胞膜死亡受体通路两种。作为细胞凋亡调控中心的线粒体在受到不同形式的细胞刺激信号刺激时释放细胞色素C至胞浆,在dATP/ATP存在的条件下与Apaf-1结合成多聚体,促使caspase-9与其结合形成凋亡小体,被激活的caspase-9能激活其下游的caspase-3等,继而通过级联反应诱导细胞凋亡。Bcl-2基因家族作为重要的凋亡调控因子在上述线粒体通路中扮演重要角色,Bax和Bcl-2表达的比例决定了细胞的生存或凋亡。Bcl-2可以和Bax结合抑制细胞凋亡,当Bax表达水平增加时可拮抗bcl-2的作用并促进细胞凋亡[10]。本试验结果提示,在MRSA感染AM后,可通过线粒体通路的相关凋亡基因 Apaf-1、caspase-9和 Bax表达的上调及 Bcl-2的下调诱导了细胞凋亡。但MRSA诱导的AM凋亡是否存在细胞膜死亡受体等其他通路及其机制尚有待进一步研究,本实验亦为MRSA肺部感染时AM凋亡分子机制的进一步研究提供基础。
[1]Baran J,Weglarczyk K,Mysiak M,et al.Fas(CD95)-Fas ligand interactions are responsible for monocyte apoptosis occurring as a result of phagocytosis and killing ofStaphylococcusaureus[J].Infect Immun,2001,69(3):1287-1297.
[2]Weglarczyk K,Baran J,Zembala M,et al.Caspase-8activation precedes alterations of mitochondrial membrane potential during monocyte apoptosis induced by phagocytosis and killing ofStaphylococcusaureus[J].Infect Immun,2004,72(5):2590-2597.
[3]刘勇,徐飞,管俊昌,等.金黄色葡萄球菌及其L型诱导小鼠腹腔巨噬细胞凋亡研究[J].中国人兽共患病杂志,2005,21(8):735.
[4]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing;Twentieth informa-tional supplement[S].CLSI documents M100-S20.CLSI,2010:60-75.
[5]Chongtrakool P,Ito T,Ma XX,et al.Staphylococcal cassette chromosome mec (SCCmec)typing of methicillin-resistantStaphylococcusaureusstrains isolated in 11Asian countries:a proposal for a new nomenclature for SCCmec elements[J].Antimicrob Agents Chemother,2006,50(3):1001-1012.
[6]罗勇军,刘昕.实时荧光定量PCR标准品的制备及应用[J].重庆医学,2005,34(3):414-415.
[7]Yan X,Tao X,He L,et al.Increasing Resistance in Multiresistant Methicillin-ResistantStaphylococcusaureusClones Isolated from a Chinese Hospital Over a 5-Year Period[J].Microb Drug Resist,2011,17(2):235-239.
[8]Aston JL,Dortch MJ,Dossett LA,et al.Risk factors for treatment failure in patients receiving vancomycin for hospital-acquired methicillin-resistantStaphylococcusaureuspneumonia[J].Surg Infect(Larchmt),2010,11(1):21-28.
[9]刘挺,管远志.耐甲氧青霉素金黄色葡萄球菌与敏感菌株侵袭宿主细胞过程之比较[J].基础医学与临床,2003,23(5):525-530.
[10]Brooks C,Dong Z.Regulation of mitochondrial morphological dynamics during apoptosis by Bcl-2family proteins:a key in Bak?[J].Cell Cycle,2007,6(24):3043-3047.
Apoptosis of SD rat alveolar macrophage induced by SCCmec type III MRSA
HUANG Rong-ning,ZONG Shuai,JIA Wei,ZHAO Zhi-jun,PAN Yue-ying,XU Guang-xian,WEI Jun
(SixthAffiliatedHospital,GuangxiMedicalUniversity,Yulin537000,China)
To study the apoptosis of SD rat alveolar macrophage(AM)induced by SCCmec type III methicillin-resistantStaphylococcusaureus(MRSA),the apoptosis of AM stained by Annexin V-FITC/PI at different times after infection with MRSA was determined by fluorescence microscope and flow cytometry.The genes associated with apoptosis were also detected by real-time quantitative polymerase chain reaction(qRT-PCR).Results displayed that compared with the control group,the rates for apoptosis of AM at 6hour and 12hour after infection showed statistical significance(P<0.01);the gene expression of Apaf-1,caspase-9and Bax were significantly up-regulated,whereas Bcl-2was significantly down-regulated(P<0.05).It's supposed that MRSA could induce apoptosis of AM by mitochondrial pathway,which might be the result of up-regulation and down-regulation of genes associated with apoptosis;it might provide a basis for the molecular mechanism of AM in pulmonary infections by MRSA.
methicillin-resistantStaphylococcusaureus;alveolar macrophage;apoptosis
R378.1
A
1002-2694(2011)10-0877-05
*2010年度宁夏回族自治区高等学校科学研究项目(黄荣宁和纵帅同等贡献)
魏军,Email:lydiajunwei@hotmail.com
1.广西医科大学第六附属医院玉林市第一人民医院检验科,玉林 537000;
2011-05-23;
2011-07-11

