丁基苯酞上调PGC-1α发挥内皮细胞保护作用的机制研究
魏 欢, 李 玲, 战丽萍, 张 波, 赵 嘉, 裴 中, 黄如训
过氧化物酶体增殖物激活受体γ辅激活因子-1α(peroxisome proliferators activated receptor-γ coactivator-1α,PGC-1α)是近年来备受关注的转录调控辅助激活因子。其促进线粒体增殖[1]、抗氧化[2]、促进血管内皮细胞增生[3]的作用为缺血性疾病的血管保护提供了新的药物治疗靶点。本次研究旨在探讨国家I类新药丁基苯酞(dl-3-n-butylphthalide,NBP)在糖氧剥夺 (Oxygen Glucose Deprivation,OGD)模型中,对PGC-1α这种内源性保护因子表达的影响及其可能机制;以寻找 NBP促进血管增生[4]、保护线粒体[5]的具体机制及其关键治疗靶点。
1 材料与方法
1.1 材料
1.1.1 细胞与分组 大鼠主动脉内皮细胞(SV40-transformed aortic rat endothelial cell line,SVAREC),购自上海博迈公司。随机分为对照组(Control)、单纯糖氧剥夺组(OGD)、丁基苯酞预处理+糖氧剥夺组(NBP+OGD)、丁基苯酞预处理+糖氧剥夺+特异性eNOS抑制剂组(NBP+OGD+LNIO)。
1.1.2 主要试剂与仪器 99.9%丁苯酞原液由石家庄制药集团有限公司馈赠。兔抗大鼠PGC-1α单克隆抗体(Cell Signaling);小鼠抗大鼠β-actin单克隆抗体(Multisciences Biotech Co,Ltd);山羊血清封闭液(博士德);FITC标记山羊抗兔IgG二抗(Santa Cruz Biotechnology);Anti-rabbit IgG-HRP Antibody(R&D);N5-(1-Imino ethyl)-L-ornithine·HCL,L-NIO(BIOMOL);MTT粉末(广州博理生物科技公司);一氧化氮合成酶(NOS)测试盒(南京建成科技有限公司);倒置相差显微镜(日本Olympus公司);电泳仪、电转仪、凝胶成像分析系统 (美国BIO-RAD公司);全自动酶标仪(BIO-TEK);缺氧盒、气压仪(长沙长锦科技有限公司)。
1.2 方法
1.2.1 内皮细胞培养 大鼠主动脉内皮细胞(SVAREC)种于25cm2培养瓶,置 37℃、5%CO2培养箱内静置培养。培养基为RPMI 1640+10%胎牛血清(FBS)。待细胞融合至80%左右,以1∶3的比例传代培养。
1.2.2 糖氧剥夺模型 待种植于培养皿中的细胞生长融合至80% ~90%时,吸出培养基,按不同分组分别加入预先配置好的不同浓度NBP或正常培养基,置于细胞培养箱中预处理1h。1h后各缺氧组换以缺氧液(缺氧液预先持续充以95%N+25%CO2混合气体约15min);立即将培养板/皿置于密封的缺氧盒中,自入气孔中通入95%N2+5%CO2混合气体5L/min,约30min后夹闭出入气孔,将缺氧盒置于37℃细胞培养箱中温育6h。6h后停止缺氧,将各组培养液换成正常培养基;重新放入37℃、5%CO2培养箱中。
1.2.3 内皮细胞损伤程度MTT细胞活性测定处理好的细胞吸出各孔培养基,加入无血清1640液180μl和 MTT(5mg/ml)20μl,置于5%CO2的细胞培养箱中,37℃条件下温育4h后,小心吸弃培养液,每孔加入100μl二甲亚砜,37℃振摇10min。孔板置于酶标仪上,570nm波长测定各孔吸光度值(A570nm)。
1.2.4 内皮细胞eNOS酶活性测定按试剂盒说明进行。
1.2.5 免疫荧光 处理好的细胞用冰冻PBS洗去培养基;加4%多聚甲醛溶液冰上处理20min,以固定蛋白。0.3%Triton X-100处理30min破膜。山羊血清封闭非特异性抗原30min;滴加PBS稀释的一抗;4℃孵育过夜。避光环境下滴加PBS稀释的荧光二抗37℃条件下孵育1h;Hoechst染核。在荧光显微镜下拍摄荧光照片。采用美国ImagePro Plus图像分析系统进行分析。
1.2.6 Western-Blot检测 细胞种植于直径60mm的培养皿中,各组处理同前。根据细胞蛋白提取试剂盒(BioVision)方法,提取细胞总蛋白,并测定各组蛋白浓度。取等量样品进行SDA-PAGE电泳并转导硝酸纤维素膜上,用5%脱脂奶粉封闭液室温摇床封闭1h;加入一抗,4℃摇床孵育过夜;加入HRP标记的抗兔二抗室温摇床孵育1h;洗膜后加入适量化学发光剂(0.125ml/cm2),暗室中用X光片曝光,冲洗,晾干。
1.2.7 图像分析及统计分析方法 所有结果以均数±标准差±s)。两样本的显著性比较用独立样本的t检验,采用SPSS13.0 for Windows软件进行统计分析,以P<0.05为具有统计学意义。
2 结果
2.1 不同浓度NBP对OGD损伤下内皮细胞活性的影响 OGD 6h后,内皮细胞活性下降到44.55±0.423%。NBP预处理1h能很好地保护细胞活性,呈一定的量效关系。从 NBP 0.01~10μmol,细胞活性分别上升至 51.48 ±0.513%、60.60 ±0.803%、71.26±0.596%、69.77 ± 0.826%,P 值均 < 0.05。NBP 10μmol预处理组较 NBP 1.0μmol预处理组相比,保护作用差别不大(P=0.04),略有下降,因此后续实验中均采用NBP 1.0μmol作为用药治疗组(见表1)。
2.2 NBP保护内皮细胞活性与eNOS的关系NBP 1.0μmol预处理组能使单纯OGD组细胞活性从44.77%上升至71.39%,具有统计学意义(P<0.05)。而这种保护作用在合并运用了eNOS特异性抑制剂 N5-(1-Imino ethyl)-L-ornithine·HCL(L-NIO)1.0μmol[6]后消失(47.86%),与单纯OGD组比较无明显差异(P>0.05)(见表2)。
2.3 NBP对eNOS酶活性的影响 按照试剂盒说明运用分光光度法检测内皮细胞eNOS活性,单位用U/ml表示。可以看到NBP 1.0μmol使正常及OGD条件下的内皮细胞eNOS活性均增高(P<0.05);而eNOS特异性抑制剂L-NIO在正常及OGD条件下均明显抑制eNOS活性(P<0.05);且L-NIO使NBP的保护作用消失(P<0.05)(见表3)。
2.4 NBP对OGD条件下内皮细胞中PGC-1α表达的影响及其与eNOS的关系 (1)免疫荧光结果从荧光图片上可以看到,PGC-1α这种核转录调控因子主要在细胞核内表达。与正常细胞相比,OGD 6h后细胞内 PGC-1α表达增多(P<0.05)。NBP 1.0μmol预处理组较单纯OGD组,能进一步增高细胞内 PGC-1α的表达(P<0.05)。而在合并运用eNOS抑制剂L-NIO(1.0μmol)之后 NBP的作用减轻(P <0.05)(见图1);(2)Western-blot结果:从蛋白表达水平可以看到,OGD 6h之后细胞内PGC-1α表达水平较正常对照组明显升高(P<0.05);加用NBP(1.0μmol)之后较单纯OGD组,能进一步增加PGC-1α的表达,具有统计学意义(P<0.05)。而这种增高在合并运用eNOS抑制剂L-NIO(1.0μmol)之后作用减轻(P<0.05)(见图1)。
表1 不同浓度NBP对OGD条件下内皮细胞活性的影响(MTT比色法) ± s,n=6)
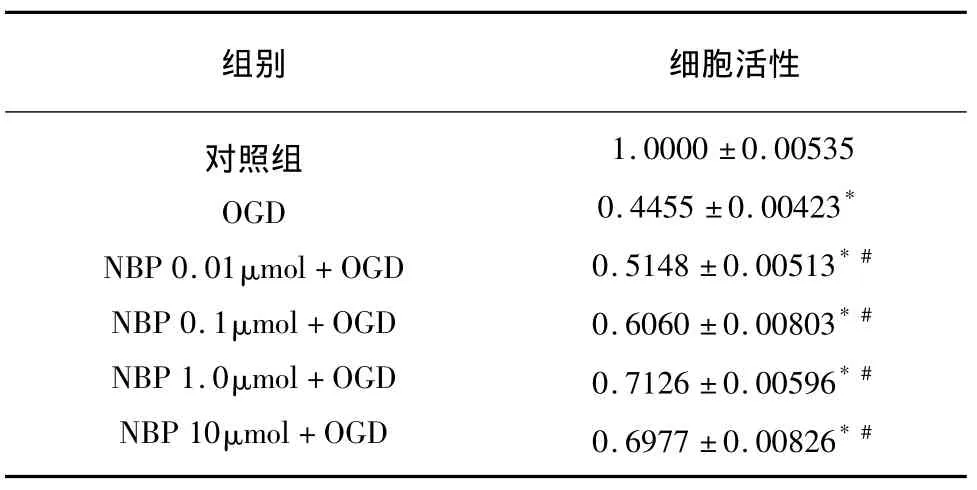
表1 不同浓度NBP对OGD条件下内皮细胞活性的影响(MTT比色法) ± s,n=6)
与正常对照组比较*P<0.05;与单纯OGD组比较#P<0.05
?
表2 NBP对内皮细胞活性的影响及其与eNOS酶活性的关系(MTT比色法) ± s,n=6)

表2 NBP对内皮细胞活性的影响及其与eNOS酶活性的关系(MTT比色法) ± s,n=6)
与正常对照组比较*P<0.05;与单纯OGD组比较#P<0.05;与OGD+NBP组相比&P<0.05
组别 细胞活性对照组NBP 1.0μmpl L-NIO 1.0μmol OGD OGD+NBP OGD+NBP+L-NIO OGD+L-NIO 1.0000 ±0.03900.9741 ±0.02830.9754 ±0.05060.4477 ±0.0565*0.7139 ±0.0234*#0.4786 ±0.0380*&0.3832 ±0.0542*#
表3 NBP对内皮细胞eNOS酶活性的影响(分光光度法)χ ± s,n=6)
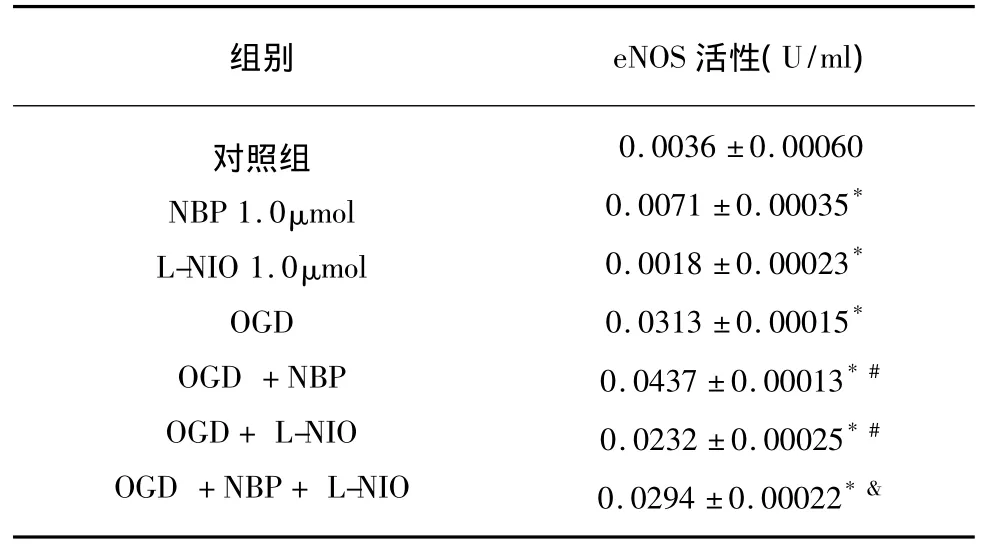
表3 NBP对内皮细胞eNOS酶活性的影响(分光光度法)χ ± s,n=6)
与正常对照组比较*P<0.05;与单纯OGD组比较#P<0.05;与OGD+NBP组相比&P<0.05
组别 eNOS活性(U/ml)对照组NBP 1.0μmol L-NIO 1.0μmol OGD OGD+NBP OGD+L-NIO OGD+NBP+L-NIO 0.0036 ±0.000600.0071 ±0.00035*0.0018 ±0.00023*0.0313 ±0.00015*0.0437 ±0.00013*#0.0232 ±0.00025*#0.0294 ±0.00022*&
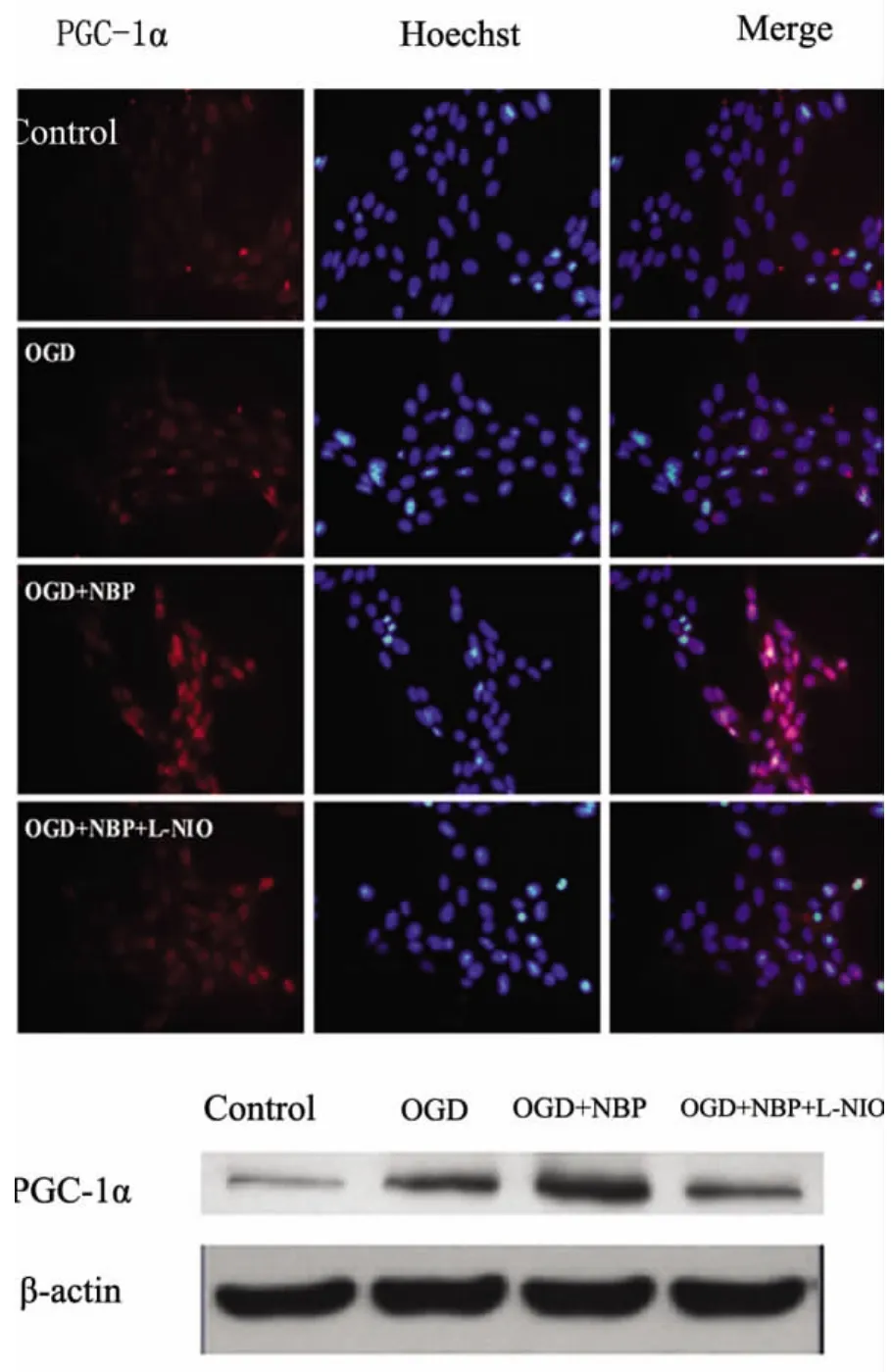
图1 NBP对OGD情况下内皮细胞中PGC-1α表达的影响其与eNOS的关系
3 讨论
丁基苯酞(dl-3-n-butylphthalide,NBP)又名芹菜甲素(apium graveolens linn),是从芹菜籽挥发油中分离得到的有效成分。临床上已制备成恩必普软胶囊(活性成分为NBP)在12个国家药品临床研究基地完成了多中心开放实验,推荐作为急性缺血性卒中的早期用药[7]。目前研究发现,NBP抗脑缺血的保护作用主要体现在保护线粒体[5]、改善微循环[8]、抗氧化损伤[9]等。然而 NBP 脑保护的具体机制和药物作用靶点仍需进一步探讨。
过氧化物酶体增殖物激活受体γ辅激活因子-1(peroxisome proliferators activated receptor-γcoactivator-1,PGC-1)是近年来备受关注的转录调控辅助激活因子[1]。它在血管内皮细胞上也有表达;能上调内皮细胞抗氧化相关基因[2]、抑制线粒体活性氧簇(reactive oxygen species,ROS)的产生、增强内皮细胞抗氧化损伤能力[10]。最新 Zoltan[3]等的研究还发现,缺氧条件下PGC-1α能通过辅助激活雌激素相关受体(oestrogen-related receptor-a,ERR-α)启动血管内皮生长因子(vascular endothelial growth factor,VEGF)基因的表达,与传统的缺氧诱导因子-1(Hypoxia inducible factor-1,HIF-1)路径不相关。因此运动和各种刺激下主要用于调控线粒体功能的PGC-1α也参与调控了新的血管增生的路径;从而为缺血组织供应氧气和营养物质。可以说PGC-1α的相关研究为缺血性疾病的治疗提供了新的靶点。
因此本课题研究的目的旨在探讨NBP发挥细胞保护作用的靶点与同样具有保护线粒体、促进内皮细胞增生的因子PGC-1α之间的相关性。近年来,在多种细胞类型的实验中均发现,一氧化氮(Nitrite Oxygen,NO)能增加PGC-1α的表达、促进线粒体的增生[11~13]。国内有学者观察原代培养的胎鼠皮质神经细胞外液的NO水平,发现NBP能使低糖低氧条件下皮质神经细胞外液NO水平明显升高[14]。这就提示我们NBP通过影响血管内皮细胞中NOS及NO水平可能是其保护内皮细胞、调控PGC-1α的途径之一。
通过实验我们发现,NBP 1.0μmol对OGD损伤下的血管内皮细胞有很好的保护作用,能使细胞活性上升约26.7%。继续增加NBP浓度并未使保护作用进一步增加,考虑是因为药物作用靶点已达到饱和所致;过多地增加药物浓度,可能会产生细胞毒副作用。既往研究发现,内源性eNOS活性在缺氧发生的早期阶段(2~6h)表达增高[15]。本实验OGD 6h后eNOS活性增高;NBP 1.0μmol预处理1h组能进一步增高eNOS活性,并促进PGC-1α的表达;而特异性的eNOS抑制剂则使PGC-1α的表达下降。说明在OGD条件下eNOS活性的增高促进了PGC-1α的表达,参与了缺血缺氧早期内皮细胞保护、促进血管增生的过程。同时也证明了NBP保护内皮细胞、促血管增生现象部分是通过保护eNOS酶活性、上调PGC-1α而实现的。
因此,本实验在离体细胞模型上探明了缺氧条件下独立于HIF的另外一个促血管增生的因子PGC-1α在OGD条件下的表达情况;并证明了NBP在OGD条件下对内皮细胞中PGC-1α的上调作用。首次在细胞模型上证明了NBP促内皮细胞增生的作用部分是通过保护eNOS酶活性、上调PGC-1α而实现的。然而NBP是如何调控eNOS酶活性,eNOS-NO、PGC-1α、HIF-1α三者之间的调控关系如何;仍需继续探讨。下一步可采用siRNA干扰的方法敲除内皮细胞中PGC-1α,HIF-1α等;从而更深层次地探讨NBP发挥血管保护作用的靶点所在。
[1] Wu Z,Puiqserver P,Andersson U,et al.Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J].Cell,1999,98(1):115 -124.
[2] Valle I,Alvarez-Barrientos A,Arza E,et al.PGC-1a regulates the mitochondrial antioxidant defense system in vascular endothelial cells[J].Cardiovasc Res,2005,66(3):562 - 573.
[3] Arany Z,Foo SY,Ma Y,et al.HIF-independent regulation of VEGF and angiogenesis by the transcriptional coactivator PGC-1a[J].Nature,2008,451(7181):1008 -1012.
[4] Liu CL,Liao SJ,Zeng JS,et al.dl-3n-butylphthalide prevents stroke via improvement of cerebral microvessels in RHRSP[J].J Neurol Sci,2007,260(1 ~2):106 -113.
[5] 熊 杰,冯亦璞.丁基苯酞对局灶性脑缺血过程中线粒体损伤的保护作用[J].药学学报,2000,35(6):408-412.
[6] Ho WY,Lu PJ,Hsiao M,et al.Adenosine modulates cardiovascular functions through activation of extracellular signal-regulated Kinases1 and 2 and endothelial nitric oxide synthase in the nucleus tractus solitarii of rats[J].Circulation,2008,117(6):773 - 780.
[7] 崔丽英,刘秀琴,朱以诚,等.dl-3-正丁基苯酞治疗中度急性缺血性脑卒中的多中心、随机、双盲和安慰剂对照研究[J].中华神经科杂志,2005,38(4):251 -254.
[8] 徐皓亮,冯亦璞.丁基苯酞对局灶性脑缺血大鼠软脑膜微循环障碍的影响[J].药学学报,1999,34(3):172-175.
[9] 董高翔,冯亦璞.丁基苯酞对局部脑缺血再灌注大鼠线粒体ATPase,抗氧化酶活性和脂质过氧化的影响[J].中国医学科学院学报,2002,24(1):93 -97.
[10] St-Pierre J,Drori S,Uldry M,et al.Suppression of reactive oxygen species and neurodegeneration by the PGC-1 transcriptional coactivators[J].Cell,2006,127(2):397 - 408.
[11] Nisoli E,Clementi E,Paolucci C,et al.Mitochondrial biogenesis in mammals:the role of endogenous nitric oxide[J].Science,2003,299(5608):896-899.
[12] Borniquel S,Valle I,Cadenas S,et al.Nitric oxide regulates mitochondrial oxidative stress protection via the transcriptional coactivator PGC-1[J].FASEB J,2006,20(11):1889 - 1891.
[13] Gutsaeva DR,Carra way MS,Suliman HB,et al.Transient Hypoxia Stimulates Mitochondrial Biogenesis in Brain Subcortex by a Neuronal Nitric Oxide Synthase-Dependent Mechanism[J].J Neurosci,2008,28(9):2015 -2024.
[14] 阎超华,冯亦璞.丁基苯酞对原代培养胎大鼠皮质神经细胞外液NO及胞浆内cGMP水平的影响[J].药学学报,1998,33(6):418-423.
[15] Wada K,Chatzipanteli K,Busto R,et al.Role of nitric oxide in traumatic brain injury in the rat[J].J Neurosurg,1998,89(5):807 -818.

