上皮细胞间质化与肿瘤的转移
赵荣志 综述 吴志浩 周清华 审校
恶性肿瘤的转移是恶性肿瘤患者死亡以及治疗失败的常见原因,肿瘤细胞侵润周围组织,诱导新生血管形成,侵润血管,进入血液循环并存活下来,在转移部位再侵出血管并形成新的转移灶,这一过程非常复杂,受到肿瘤微环境的影响,许多分子机制参与其中[1]。上皮细胞间质化(epithelial-mesenchymal transition, EMT)在生理状况下与胚胎发育有关[2],近些年其在肿瘤转移方面的作用及其相关机制的研究,逐渐受到大家的重视,成为有关肿瘤转移研究方面的热点之一[3]。
1 EMT概念及分类
人体的组织主要包括两种细胞类型:上皮细胞和间质细胞,两者在细胞表型以及细胞功能上明显不同。上皮细胞通过紧密连接、粘附连接、桥粒和缝隙连接彼此相互连接,具有极性;相反间质细胞没有极性,缺少细胞间连接,能够通过细胞外基质游走[4]。
上皮细胞表型和间质细胞表型在某些情况下可以相互之间转化。Greenburg[5]于1982年首次提出了EMT的概念。EMT就是上皮细胞在一些生理或病理因素的作用下,失去细胞极性,丢失细胞间紧密连接和粘附连接,变成了具有间质细胞形态和特性的细胞,从而获得了浸润性和游走迁移的能力[6,7],这种改变被定义为EMT。
EMT根据不同的环境背景可分为三种类型:I型主要发生在胚胎发育过程中,参与原肠胚(EMT发生时原始的上皮细胞形成间质细胞)以及神经嵴(早期的神经上皮细胞形成神经嵴细胞)的形成;II型主要发生在器官纤维化以及炎症过程中,与器官的纤维化以及炎症的修复有关(上皮或内皮细胞形成成纤维细胞);III型则与肿瘤的侵润和转移有关。原发肿瘤的上皮细胞转化成间质细胞,获得了运动的能力,脱离原发部位侵袭周围组织进入血液循环,在远隔部位通过间质细胞上皮化(mesenchymal-epithelial transition, MET)形成新的转移灶[6,8,9]。
2 EMT与恶性肿瘤侵润和转移的关系
在人体的恶性肿瘤中90%以上是上皮细胞性肿瘤。由于EMT是上皮细胞获得迁移能力的有效方式,它成为上皮细胞癌浸润转移的一个重要途径,研究[10]表明它与上皮细胞恶性肿瘤的侵润和转移关系密切,受到了越来越大的关注。
肿瘤的转移是一个复杂而连续的过程,包括肿瘤细胞在原发部位的生长、侵及周围正常组织、穿透基底膜、侵及脉管进入循环系统并存活下来到达远隔部位,侵出脉管并在新的部位形成转移灶[11]。
有研究显示在原发肿瘤局部侵润的边缘有EMT特定基因的表达,显示出EMT可能是肿瘤侵出基底膜侵润周围正常组织的必备条件[12,13],而诱导肿瘤细胞发生EMT还能增加其穿过血管内皮细胞进入血液循环的能力[11,14]。这些都显示EMT与肿瘤转移的早期阶段密切相关。此外还有研究把诱导EMT特定基因(twist)过表达的肿瘤细胞通过鼠尾静脉注射,增加了肿瘤细胞肺转移的能力,显示出EMT可能与肿瘤细胞的血管外侵有关系。当肿瘤细胞到达转移部位通过MET增殖形成与原发肿瘤类型相同的新的转移灶[15]。
此外,还有研究[16-18]显示EMT与肿瘤细胞对于表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂(吉非替尼、厄洛替尼)的敏感性有关,发生EMT的肿瘤细胞对于EGFR酪氨酸激酶抑制剂有抗药性。
3 EMT判定标准及标志物
肿瘤细胞发生EMT时除了在细胞形态、细胞极性、侵袭游走能力、抗凋亡能力等形态学和生物学行为的变化之外,还同时伴有细胞表面蛋白、细胞骨架蛋白、细胞外基质蛋白以及某些转录因子表达的异常[9]。如何判断肿瘤细胞是否发生了EMT,需要综合上述多种因素。体外实验判断的标准目前较为一致观点认为,符合下述情况可以判定细胞发生了EMT:细胞由多角形上皮细胞形态转变成纺锤形的间质细胞形态,失去细胞极性;迁移和侵袭能力增加;抗凋亡能力增加;诱导EMT的因素移除后仍然能够维持表型的稳定;一些上皮细胞标志物(如上皮性-钙粘蛋白、细胞角蛋白、紧密连接蛋白ZO-1)表达的降低或缺失,同时一些间质细胞标志物(成纤维细胞特异性蛋白1、波形蛋白、I型胶原、纤粘连蛋白)的出现和表达的升高;一些分子的移位和转化(如β-连环蛋白由细胞核外转移至核内[19];上皮性-钙粘蛋白转化成神经性-钙粘蛋白[20,21])以及某些转录因子(Snail、Slug或Twist[22-24])表达的升高。
体内肿瘤细胞EMT的判定是一个难题,原因是理论上认为发生EMT的肿瘤细胞只占原发肿瘤的很少一部分。一些基因、转录、蛋白水平的改变往往为原发肿瘤所掩盖,较难确认和捕捉到已经发生转化的上皮性肿瘤细胞。最为直接的证据就是存在新形成的成纤维细胞以及基底膜的降解[25]。一些EMT的标志物可以参考体外实验,表1列举了一些EMT的分子标志物。
3.1 E-cadherin 上皮性-钙粘蛋白,人类的E-cadherin编码基因定位于16号染色体q22.1附近,分子量为120 kDa。分子中存在一个疏水基因,位于跨膜区,氨基末端位于细胞膜外,是钙离子的结合位点,对钙离子有高度敏感性,羟基末端位于细胞浆内。E-cadherin形成二聚体,胞外部分相互连接形成粘附连接,细胞内部分与β-连环蛋白(β-catenin)或γ-连环蛋白(γ-catenin)结合,β-catenin通过与α-连环蛋白(α-catenin)结合后与肌动蛋白丝结合,而γ-catenin可以直接与肌动蛋白丝结合。E-cadherin/catenin复合物在维持上皮细胞表型和粘附连接中具有重要作用[26,27]。许多研究[26,28-30]显示E-cadherin/catenin复合物的降解,或者E-cadherin表达的降低或缺失与肿瘤细胞的分化、肿瘤的分期、侵润、转移以及预后密切相关。E-cadherin是EMT最为重要的标志物之一[31]。
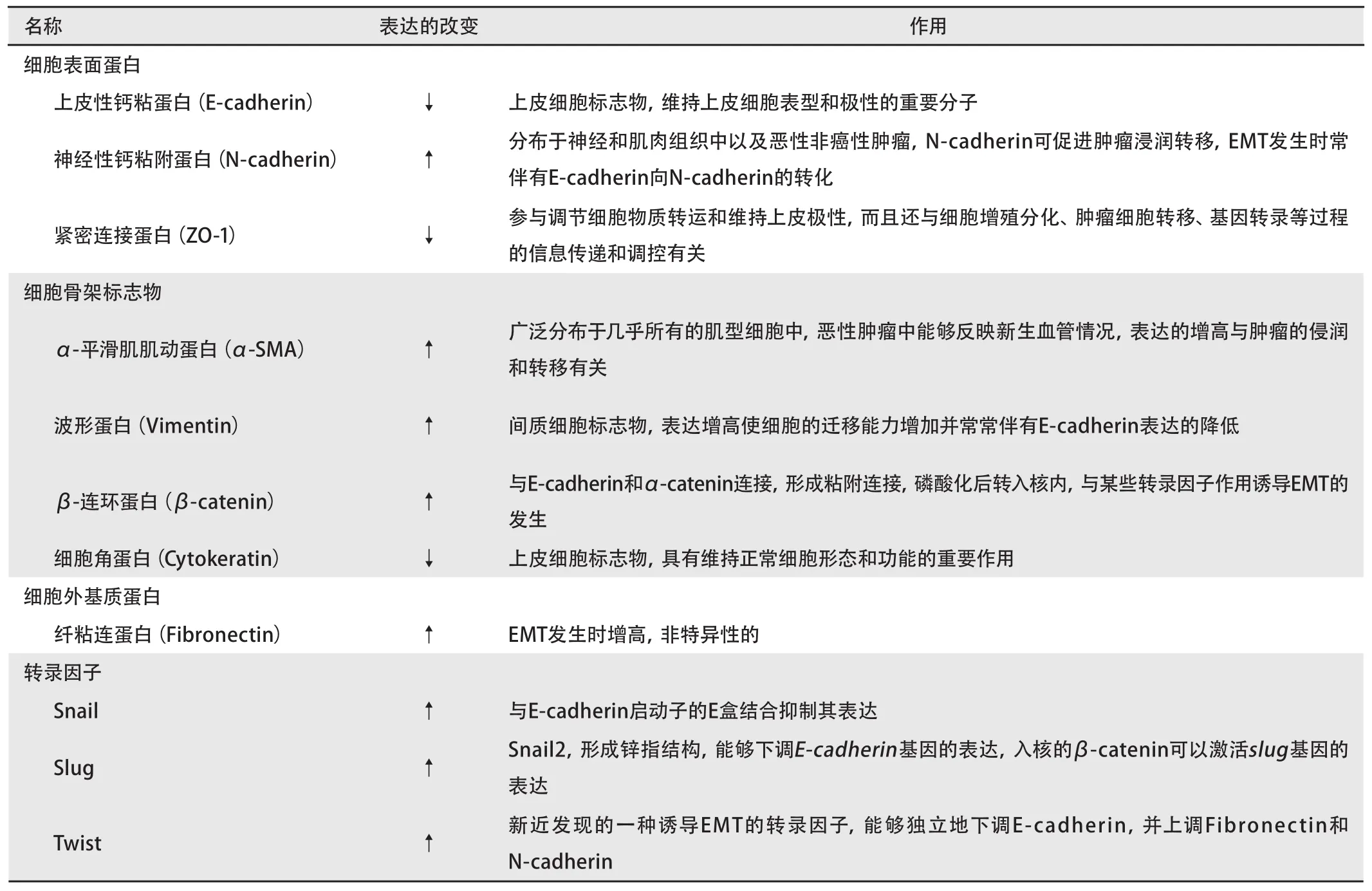
表 1 EMT常见的一些标志物Tab 1 Common biomarkers of EMT
3.2 Fibronectin 纤粘连蛋白,是高相对分子质量的粘附性的糖蛋白。纤粘连蛋白以可溶的形式存在于血浆和各种体液中,称为血浆纤维粘连蛋白;以不溶的纤维存在于细胞外基质、细胞之间及某些细胞表面,称为细胞纤维粘连蛋白。由两个亚基组成的二聚体,每个亚基的相对分子质量约250 kDa,各亚基在C末端形成两个二硫键交联。EMT发生时伴有Fibronectin的增高,但是非特异性的,因为很多细胞(如成纤维细胞、单核细胞、上皮细胞)都可以产生Fibronectin[32,33]。
3.3 Snail 其基因产物结合到E-cadherin启动子的E盒,从而抑制其表达[34]。在一些上皮性肿瘤细胞中是EMT的诱导因子。当上皮细胞获得间质细胞表型时,snail蛋白表达增高并结合到E-cadherin启动子的E盒并抑制其活性。EMT的许多信号传导通路都是通过snail发挥作用[35]。Snail的表达增高与肿瘤的侵润转移和预后也存在密切联系[36,37]。近年来slug[38]、twist、CBF-A和KAP-1等转录因子也逐渐受到大家的重视[39]。
EMT的发生机制十分复杂,不同的肿瘤存在不同的调控机制,而同一肿瘤细胞EMT的调控也可能存在多个途径。EMT的信号传导途径是一个复杂而庞大的网络。有关EMT对于乳腺癌、肺癌、直肠癌、肝癌、前列腺癌转移影响的研究[33,40]显示TGF-β/Smad、RTK/RAS、Wint/β-catenin等均能够诱导EMT在不同肿瘤中的发生。近期的研究显示NF-kB[41]、GSK-3β、STAT3/LIV-1等信号途径也会诱导EMT的发生[42]。不同的信号传导通路之间也存在相互关联。
4 问题与展望
多数有关EMT与肿瘤侵润、转移相关性的研究仅仅局限于体外实验以及少数的动物实验,至今仍存在很多的争议之处。原因是在体内发生侵润转移的肿瘤细胞只占原发肿瘤的很少一部分,当它们发生EMT时的一些基因、转录、蛋白水平的改变往往为原发肿瘤所掩盖。如何确认和捕捉到已经发生转化的上皮性肿瘤细胞是一个难题[43]。新的显像技术以及细胞标记方法为问题的解决带来了希望。目前理论上认为肿瘤细胞的转移需要经过EMT和MET两个过程。两者的发生是一个动态连续的过程,受到肿瘤微环境的影响。相关的分子机制、动物模型、分子探针以及人体研究将来有望成为肿瘤研究领域的热点,为肿瘤转移早期的诊断、预后的评估提供有价值的信息,并且有望为肿瘤的治疗提供新的靶点[44-46]。

