铝胁迫对黑麦草种子萌发和幼苗生长的影响
陈志刚,张红蕊,周晓红,张 珂
(江苏大学 环境学院,江苏 镇江 212013)
铝是地球上含量最多的金属元素,占地壳总质量的7.45%。同时铝作为高价、半径小的元素,易水解形成难溶解的氢氧化铝,并进行相互转化,在土壤溶液中非常活跃,尤其是在酸性条件下形成大量的Al3+、Al(OH)+2和Al(OH)2+等,从而对植物产生毒害作用,在土壤 pH=5.0或更低时,毒害作用更强[1]。在我国酸性土壤遍布南方15个省区,总面积达203万km2,约占耕地面积的21%[2],因此,铝毒害已成为我国酸性土壤中限制作物生长的最重要的因素之一[3],铝毒严重影响到草本植物的生长。
近年来,我国对草食畜产品的需求不断增加,因此有必要探究金属铝对草本植物萌发及其生长的影响。草本植物黑麦草(Lolium multif lorum),是我国南方广泛种植的具有经济价值的栽培牧草,具有生长迅速、根系发达、生物量大、可多次刈割,植物再生能力强等诸多优点。有报道显示,黑麦草对重金属具有很强的抗性,且对重金属有富集作用[4-5],因此可被广泛用于污染环境的生态修复中。近年来,关于黑麦草对重金属富集的报道较多,且主要集中在生物化学或分子机制方面,但对于轻金属铝胁迫下黑麦草种子萌发的研究较少,而种子萌发及幼苗的生长是作物对外部环境反应的开始,也是植物最早接受金属胁迫的阶段,因此,本试验研究不同铝浓度对黑麦草种子萌发和幼苗生长的影响,将为酸性土壤中黑麦草的合理利用以及评价黑麦草对金属铝的抗逆性提供一定的理论依据。
1 材料和方法
1.1 植物材料
选取颗粒饱满、大小均匀的多花黑麦草种子,先用0.1%的 HgCl2消毒10 min,然后用去离子水反复冲洗数次,用滤纸吸干后移入试验容器中开展试验。
1.2 试验方法
试验容器为加有一层纱布的培养皿。每个培养皿(直径×高:90 mm×15 mm)中放置100颗种子。根据前期预试验以及参照文献[6-8],铝以 AlCl3的形式加入,铝浓度梯度设置为0 mg/L(以不添加铝离子的蒸馏水作为对照)、10,50,100,200,300,500 mg/L共7个处理,然后用0.1 mol/L的 HCl溶液分别调节各浓度处理液 pH至4.5。每组铝浓度分别设3组重复。随后将装有黑麦草种子的培养皿置于培养箱中(温度 :25/15 ℃日/夜;光周期:16/8 h光/暗;相对湿度70%~85%;光照 558~661μmol/(m2◦s),PAR)。每天补加等量的处理液使纱布保持湿润,同时调节pH为4.5。
1.3 指标测定
1.3.1 发芽率、发芽指数测定及其计算 试验开始2 d后统计黑麦草种子萌芽数,发芽以胚根突破种皮1 mm长为标准,连续2 d发芽种子数无增长视为发芽完全记发芽率。发芽期间,逐日统计发芽粒数,计算发芽指数。发芽率和发芽指数计算公式如下:发芽率=供试种子的发芽数/供试种子数×100%

式中 :Gt——在 t日的发芽数;Dt——相应的发芽试验天数。
1.3.2 株高、根长测定 试验第7天时,各处理组的种子发芽已全部完成,此时每天随机选取培养皿中10根植株,开始用直尺测定其根长株高的变化情况,连续测定7 d。
1.3.3 质膜透性测定及其计算 试验开始后,分别在第7天和第13天测定浸种液电导率,并以相对电导率(%)来反映种子的质膜透性 。试验参照魏林[10]等测定浸种液相对电导率的方法:随机取培养皿中萌发种子25粒,将其置于100 ml锥形瓶中,加入50 ml蒸馏水,于25℃条件下浸泡 2 h,用 HI8733便携式电导率仪测定浸泡液的电导率值S1,然后将锥形瓶置于沸水浴中20 min,取出后定容至50 ml,冷却后测定电导率值 S2,相对电导率=S1/S2×100%,重复3次,取平均值。
1.4 数据分析
试验数据采用 Microsoft Excel软件进行处理,并采用SPSS 16.0软件进行统计分析。
2 结 果
2.1 铝胁迫对黑麦草种子发芽指数和发芽率的影响
发芽指数是反映种子萌发的快慢和整齐程度的指标。发芽指数高表明该种子发芽所用时间短,发芽速度快。表1为不同铝浓度下黑麦草种子的发芽率及其发芽指数。由表1可知,10~50 mg/L铝浓度处理时,黑麦草种子发芽指数与对照无显著差异(p>0.05);而当铝浓度大于50 mg/L时,随着铝浓度的升高,黑麦草种子萌发的速度明显变慢(p<0.05),当铝处理浓度为500 mg/L时,发芽指数仅为对照的2.8%。
同时,由表 1可知,铝浓度对黑麦草种子的发芽率有一定的影响。随着铝处理浓度的升高,黑麦草种子发芽率先升高后降低。当铝浓度介于10~50 mg/L范围内,发芽率与对照无显著差异(p>0.05),其中10 mg/L铝浓度处理下,发芽率最大,高于对照;之后,随着铝处理浓度的升高,种子萌发受到显著抑制(p<0.05),当铝浓度为500 mg/L时,发芽率仅为6.3%。

表1 铝胁迫对黑麦草种子发芽指数和发芽率的影响
2.2 铝胁迫对黑麦草幼苗株高和根长的影响
2.2.1 铝胁迫对黑麦草幼苗株高的影响 由图1可知,随试验时间的延长,株高呈上升趋势,但随着铝浓度的增加黑麦草株高增长速度逐渐降低,且铝浓度越高抑制作用越明显。具体表现为:在试验初始的7~9 d,50 mg/L铝处理下株高与对照差异显著(p<0.05),比对照降低38.8%~50.5%;而试验的第10~13 d时,10 mg/L铝处理显著抑制植株生长(p<0.05),而50 mg/L铝处理下株高比对照降低51.0%~57.0%。
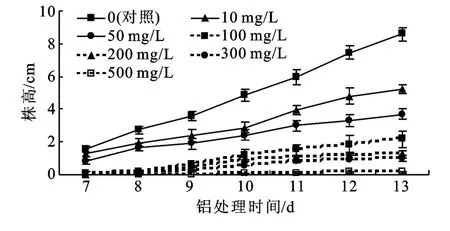
图1 不同浓度铝处理下黑麦草株高变化
2.2.2 铝胁迫对黑麦草幼苗根长的影响 由图2可知,当铝浓度介于0~50 mg/L时,黑麦草幼苗在试验第7天有根的生长,但随着试验时间的延长,10 mg/L、50 mg/L试验组的根系增加非常缓慢,试验第10天时,两组幼苗根长仅增加了21.0%和16.8%;而试验第13天时,两组幼苗根长仅增加了26.0%和19.3%,与对照组差异显著(p<0.05),对照组根长增加2.58倍。当铝浓度大于50 mg/L时,黑麦草幼苗无根的生长。

图2 不同浓度铝处理下黑麦草根长变化
2.3 铝胁迫对黑麦草种子质膜透性的影响
本文中黑麦草种子质膜透性采用相对电导率来表示,相对电导率高,质膜透性大,植株受害严重。由图3可知,10 mg/L的铝浓度显著降低了黑麦草种子质膜透性(p<0.05),在铝处理的第7天和第13天,相对电导率比对照降低44.2%和50.7%;而随着铝浓度的升高,相对电导率显著增加(p<0.05),试验第7天,50,10,200,300,500 mg/L铝浓度处理组相对电导率较对照增加 0.7倍、1.2倍、2.4倍、2.9倍、4.2倍,且随着试验时间的延长,在50~100 mg/L铝浓度处理下,各试验组相对电导率增加显著(p<0.05)。

图3 铝胁迫下黑麦草浸种液相对电导率变化
3 讨 论
铝是植物生长的非必须元素,通常以难溶性硅酸盐或氧化铝形式存在,对植物没有毒害,但 p H<5时,可溶性铝含量将增加[1],从而将影响植物种子的萌发和幼苗生长。本次试验结果表明,10~50 mg/L的铝处理对黑麦草种子萌发无明显影响(p>0.05),但随着铝浓度的升高,种子萌发将受到显著抑制(p<0.05)。孙冬花等[11]的研究显示,铝处理下秋葵(Hibiscusmoscheutos L)和两个小麦(Triticum aestivum L)品种种子的萌发率均没有显著变化。而张芬琴[12]和刘鹏[13]等的研究表明低浓度的铝促进种子萌发,高浓度铝抑制种子萌发,这表明不同物种的种子萌发对铝胁迫存在不同的反应机制[11]。
研究表明,植物根系是铝毒害的最初作用点。本文研究表明,随着铝浓度的增加,黑麦草幼苗株高、根长呈显著的下降趋势(p<0.05),10 mg/L的铝处理即可抑制黑麦草株高和根系的生长,表明黑麦草株高和根系对铝胁迫的反应较为敏感,这与刘强[14]等关于铝毒胁迫下油菜(Brassica campestris L)幼苗生长的研究相似。另外,本次试验中当铝处理浓度 ≥100 mg/L时,黑麦草根系停止生长,表明铝对根系的抑制作用更为直接和明显。
质膜包在细胞外面,所以又称细胞膜,它不仅是区分细胞内部与周围环境的动态屏障,更是细胞物质交换和信息传递的通道,其稳定性是细胞进行正常生理功能的基础。逆境胁迫下,铝毒与细胞膜作用,改变膜透性,使细胞内物质向外渗漏作用加强,用于植株正常生长发育的同化物减少,植物生长减缓,生物量下降。本研究显示,10 mg/L铝处理能显著降低质膜透性(p<0.05);之后随着铝浓度的升高质膜透性明显变大(p<0.05),这与王芳[15]等的研究结果相一致。而张芬琴[12]等的研究结果显示,低浓度的铝浸种后,苜蓿(Medicago sativa)种子的电解质外渗率微高于对照,高浓度铝浸种后,其电解质外渗率明显高于对照处理。Ishikawa S等的研究同样表明:铝毒直接作用于根系,使根系生长减慢或停止。同时,铝毒与细胞膜作用,改变膜透性,使细胞内物质向外渗漏作用加强[16],表明不同物种的细胞对铝胁迫的反应不同。
综上,多花黑麦草在一定程度上具有耐铝性,但随着铝浓度升高,铝毒害程度变大。因此,对于铝浓度较低的酸性土壤,可以考虑栽培黑麦草。但关于铝胁迫下,黑麦草生理特性的变化及其对铝的富集情况有待进一步研究,从而为黑麦草对金属铝污染的酸性土壤进行生态修复提供理论支撑。
[1] Larsen P B,Stenzler L M,Tai C Y,et al.Molecular and physiological analysis of Arabidopsis mutants exhibiting altered sensitivities to aluminum[J].Plant Soil,1997,192(1):3-7.
[2] 林咸永,王建林.植物对Al毒胁迫的适应机制[M]//张福锁.植物营养的生态生理学和遗传学.北京:中国科学技术出版社,1993:248-290.
[3] Taylor G J.Aluminum toxicity and tolerance in plants[J].Biological and Ecological Effects,1989,107(2):327-361.
[4] 廖敏,黄昌勇.黑麦草生长过程中有机酸对镉毒性的影响[J].应用生态学报,2002,13(1):109-112.
[5] 徐卫红,熊治庭,王宏信,等.锌胁迫对重金属富集植物黑麦草养分吸收和锌积累的影响[J].水土保持学报,2005,19(4):32-35.
[6] Jones D L,Prabowo A M,Kochian L V.Aluminum-organic acid interactions in acid soil[J].Plant Soil,1996,182(2):229-237.
[7] Gunse B,Garzon T,Barcelo J.Study of Aluminum toxicity by means of vital staining profiles in four cultivars of Phaseolus vulgaris L.[J].Plant Physiol,2003,160(12):1447-1450.
[8] Flaten T P.Aluminum in tea-concentrations,speciation and bioavailability[J].Coord.Chem.Rev.,2002,228(2):385-395.
[9] Silva I R,Smyth T J.Differential aluminum tolerancein soybean:an evaluation of the role of organic acids[J].Physiol.Plant,2001,112(2):200-210.
[10] 魏林,梁志怀,曹福祥,等.哈茨木霉 T2-16代谢产物对花生种子活力和抗黄曲霉菌浸染能力的影响[J].中国油料作物学报,2009,31(3):370-373.
[11] 孙冬花,田秋英,张文浩.铝对秋葵、小麦种子萌发和幼苗生长的影响[J].云南植物研究,2006,28(5):523-528.
[12] 张芬琴,于爱兰.铝处理对苜蓿种子萌发及其幼苗生理生化特性的影响[J].草业学报,1999,8(3):61-65.
[13] 刘鹏,徐根娣,姜雪梅,等.铝对大豆种子萌发的影响[J].种子,2003,22(1):30-32.
[14] 刘强,龙婉婉,胡萃,等.铝胁迫对油菜种子萌发和幼苗生长的影响[J].种子,2009,28(7):5-10.
[15] 王芳,刘鹏,徐根娣,等.铝对荞麦根系的影响[J].广西植物,2006,26(3):321-324.
[16] Ishikawa S,Wagatsuma T,Ikarashi T.Comparative toxicity of Al3+,Yb3+,and La3+to root-tip cells differing in tolerance to high Al3+in terms of ionic potentials of dehydrated trivalent cations[J].Soil Sci.Plant Nutr.,1996,42(3):613-625.

