小肠结肠炎耶尔森菌前增菌方式的选择
牛 蕾,祝长青,2,周光宏,*,徐幸莲,李 彬,江 芸
(1.南京农业大学 国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;2.江苏出入境检验检疫局,江苏 南京 200001)
小肠结肠炎耶尔森菌前增菌方式的选择
牛 蕾1,祝长青1,2,周光宏1,*,徐幸莲1,李 彬1,江 芸1
(1.南京农业大学 国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;2.江苏出入境检验检疫局,江苏 南京 200001)
小肠结肠炎耶尔森菌作为一种食源性致病菌逐渐引起了关注。本实验利用胰蛋白胨培养基、改良磷酸盐缓冲液和氯苯酚-替卡西林-氯酸钾培养基对小肠结肠炎耶尔森菌前增菌,并采用实时荧光PCR方法对增菌效果进行检验。结果表明:在纯菌体系中胰蛋白胨培养基对小肠结肠炎耶尔森菌的增菌作用优于其他两种培养基,并且增菌24h后即可检测到该菌。在混菌体系中小肠结肠炎耶尔森菌经过改良磷酸盐缓冲液增菌后灵敏性最高,并且增菌时间可缩短至8h。因此在实际检测中可采用改良磷酸盐缓冲液对该菌进行增菌检测。
小肠结肠炎耶尔森菌;前增菌;实时荧光PCR;培养基;食源性致病菌
小肠结肠炎耶尔森菌(Yersinia enterocolitica)是一种革兰氏阴性短杆菌。它在畜禽中含量较高,猪带菌率最高。本菌是一种嗜冷菌,在0~4℃仍能继续繁殖并产生毒素。在冰箱内存放的污染该细菌的食品对人仍具有感染性[1]。自20世纪80年代以来,小肠结肠炎耶尔森菌成为全球广泛关注的一种要的食源性致病菌。1985—1987年我国从20 个省市的39412例腹泻患者中检出患小肠结肠炎耶尔森菌病例为256例,占0. 64%[2]。小肠结肠炎耶尔森菌所致疾病有回肠炎、肠系膜淋巴结炎、阑尾炎、结节性红斑、关节炎、败血症和各种脓肿等[3]。
目前国内外各标准中规定的小肠结肠炎耶尔森菌的检测方法均为传统生化鉴定方法,此方法既耗时又需要大量的劳动力。实时荧光PCR方法由于具有实时监测反应进程、快速、特异性强以及灵敏性高等优点而成为目前检验该菌的主要方法[4-12]。但由于食品体系较复杂且杂菌率较高以致检出率较低,所以在使用实时荧光PCR方法检测小肠结肠炎耶尔森菌之前增菌是十分必要的。本实验选取胰蛋白胨培养基(TSB)、改良磷酸盐缓冲液(PSB)和氯苯酚-替卡西林-氯酸钾培养基(ITC)3种培养基作为增菌液,分别在纯菌体系和杂菌体系中对小肠结肠炎耶尔森菌进行前增菌,利用PCR方法对增菌效果进行验证。
1 材料与方法
1.1 材料、培养基与试剂
小肠结肠炎耶尔森菌标准菌株(CICC21565)购自中国工业微生物菌种保藏管理中心。阴性肉样为市售肉制品。
PSB培养基、TSB培养基、CIN-1培养基、小肠结肠炎耶尔森菌生化鉴定套装培养基 北京陆桥技术有限公司;ITC培养基及配套添加剂 青岛海博公司。
DNA提取试剂盒 天根生化科技有限公司;PCR预混液GoTaq Green Master Mix 美国Promega公司;Taqman探针预混液2×Premix Ex TaqTM大连宝生物科技有限公司。
1.2 仪器与设备
Mastercycler PCR仪 美国Eppendorf公司;ABI7500实时荧光PCR仪 美国Applied Biosystems公司;LX-100手掌型离心机 江苏海门市麒麟医用仪器厂;Anke TGL-16G 高速台式离心机 上海安亭科学仪器厂;WH-2 微型旋涡混合仪 上海沪西分析仪器有限公司;ZKSY-42智能恒温水箱 南京科尔仪器设备有限公司;LD ZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;BIO-RAD凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 前增菌培养
1.3.1.1 纯菌体系
取4.8×104CFU/mL小肠结肠炎耶尔森菌纯菌液0.1mL分别接种于100mL PSB、TSB、ITC增菌液中,并置于26℃培养箱中培养48h。每隔8h取菌体沉淀一次,并取一定稀释度的菌液0.1mL涂布于CIN-1选择培养基上,置于26℃培养48h后进行计数。
1.3.1.2 杂菌体系
以480CFU/g肉样为标准将小肠结肠炎耶尔森菌接种于10g阴性肉样中,并将此肉样分别置于装有90mL PSB、TSB、ITC增菌液的三角瓶中,置于26℃培养箱中培养48h,每隔8h取菌体沉淀一次,取菌液划线接种于CIN-1选择培养基上,置于26℃培养箱中培养48h,另外将可疑菌落接种于小肠结肠炎耶尔森菌生化鉴定套装培养基上进行生化鉴定。
1.3.2 DNA提取
取各时间点保留的菌体沉淀,参照天根生化科技有限公司细菌DNA提取试剂盒操作流程提取DNA。提取出来的DNA作为反应模板,以备后续PCR反应使用。
1.3.3 普通PCR反应
反应体系:GoTaq Green Master Mix预混液12.5μL,上、下游引物(10μmol/L)各0.75μL,模板DNA 2μL,双蒸水补足体积到25μL。引物序列:上游引物ail-F为5'-ACT CGA TGA TAA CTG GGG AG-3'(664-683),下游引物ail-R为5'-CCC CCA GTA ATC CAT AAA GG -3'(814-833)。引物由大连宝生物科技有限公司合成。
反应程序:95℃预变性5min;95℃变性45s,54℃退火45s,72℃延伸34s,共40个循环。
1.3.4 琼脂糖凝胶电泳
利用1%琼脂糖凝胶对PCR产物进行电泳,观察目的基因扩增情况。
1.3.5 实时荧光PCR反应
反应体系:预混液2×Premix Ex TaqTM10μL (DNA聚合酶、反应用Buffer、dNTP、Mg2+等),引物ail-F和ail-R (10μmol/L)各0.4μL,探针(10μmol/L)0.2μL,50×Rox Reference Dye Ⅱ0.4μL,模板DNA 2μL,双蒸水补足体积到20μL。探针为FAM-TCG TTT GCT TAT ACT CAT CAGGGA - Eclipse (692-715),其5'-端标记报告基团为FAM,3'-端标记淬灭基团为非荧光基团Eclipse。探针由大连宝生物科技有限公司合成。
反应程序:95℃预变性30s;95℃变性5s,60℃退火及延伸34s,共40个循环。
结果判断:Ct值≥40,可判断样品结果为阴性,可直接报告未检出相应致病菌;Ct 值<40,可判断该样品结果为阳性。
2 结果与分析
2.1 传统培养方法
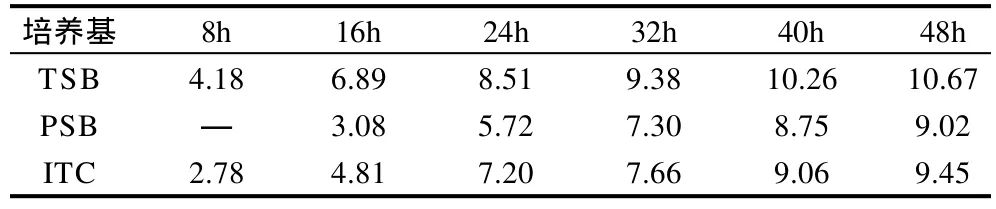
表1 纯菌体系中对小肠结肠炎耶尔森菌增菌不同时间后平板计数结果Table 1 The plate count of Yersinia enterocolitica after different cultivation time lg(CFU/mL)
如表1所示,在TSB培养基中该菌生长速度较快,PSB培养基是3种培养基中增菌效果较差的一种。在杂菌体系中通过对各培养基进行划线分离,并进行生化鉴定,小肠结肠炎耶尔森菌生化鉴定结果如表2所示。在杂菌体系中检验结果显示TSB培养基和PSB培养基经16h以上增菌 时间后均有阳性菌株被分离出来,但TSB 培养基检出率不如PSB培养基高,而ITC培养基并未分离出小肠结肠炎耶尔森菌阳性菌株。
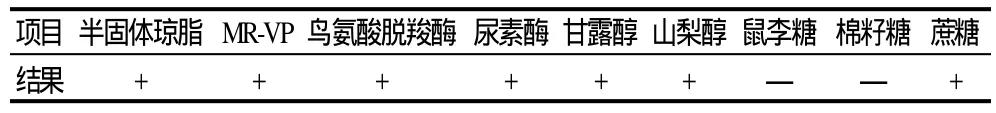
表2 杂菌体系中小肠结肠炎耶尔森菌生化鉴定结果Table 2 Biochemical identification of Yersinia enterocolitica
2.2 普通PCR反应结果
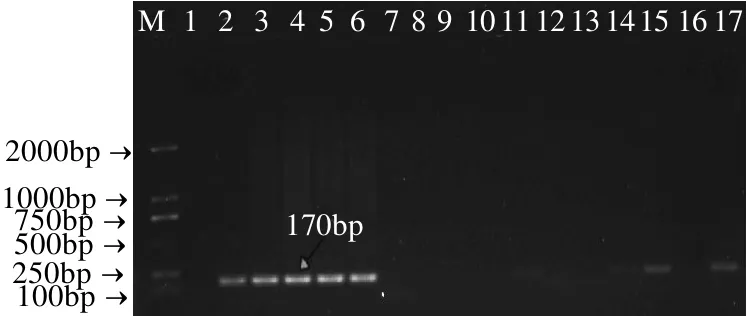
图1 纯菌体系中小肠结肠炎耶尔森菌经不同培养基及不同时间培养后PCR扩增产物电泳结果Fig.1 Electrophoresis results of PCR amplified products of pure Yersinia enterocolitica after various cultivation time and media
如图1所示,根据电泳条带亮度可知在纯菌体系条件下TSB培养基增菌效果较好,增菌 16h即可检出该菌。在混合菌体系中小肠结肠炎耶尔森菌目的基因扩增结果如图2所示。从电泳条带亮度可以看出PSB培养基在杂菌体系中增菌效果较好,且经16h增菌后即可检测出该菌。但是由于琼脂糖凝胶电泳灵敏度较低,所以各培养基具体前增菌效果需要通过实时荧光PCR方法进行验证。

图2 人工污染小肠结肠炎耶尔森菌后经不同培养基及不同时间培养后PCR扩增产物电泳结果Fig.2 Electrophoresis results of PCR amplified products of artificially contaminated Yersinia enterocolitica after various cultivation time and media
2.3 实时荧光PCR反应结果
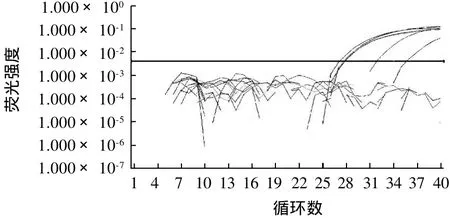
图3 纯菌体系中小肠结肠炎耶尔森菌经不同培养基及不同时间培养后实时荧光PCR扩增曲线Fig.3 Real-time PCR amplification curve of pure Yersinia enterocolitica after various cultivation time and media
根据实时荧光PCR原理,可以根据扩增曲线的Ct值判断起始菌液浓度的高低进而得到各培养基的增菌效果。
由图3可以看出,纯菌体系中小肠结肠炎耶尔森菌只有经过TSB培养基增菌后才有扩增曲线。

表3 纯菌体系中小肠结肠炎耶尔森菌经TSB培养基不同时间增菌后实时荧光PCR结果Table 3 Real-time PCR results of pure Yersinia enterocolitica in TSB medium after different cultivation time
由表3可知,8h和16h的Ct值明显大于其他时间点的Ct值,所以小肠结肠炎耶尔森菌在经过TSB培养基增菌24h后可稳定的被检测出来。
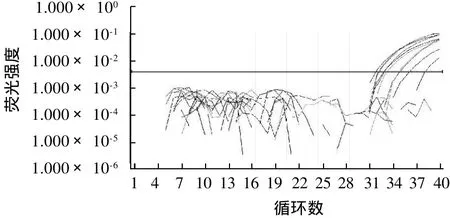
图4 人工污染小肠结肠炎耶尔森菌经不同培养基及不同时间培养后实时荧光PCR扩增曲线Fig.4 Real-time PCR amplification curve of artificially contaminated Yersinia enterocolitica after various cultivation time and media

表4 人工污染小肠结肠炎耶尔森菌经不同培养基及不同时间培养后实时荧光PCR结果Table 4 Real-time PCR results for artificially contaminated Yersinia enterocolitica after different cultivation time and media
如图4及表4所示,在杂菌体系中PSB培养基和TSB培养基均对小肠结肠炎耶尔森菌有增菌作用。但根据Ct值可知PSB培养基的增菌效果较好,并仅需8h即可检测出该菌的存在。
3 结论与讨论
经过普通PCR反应后,结果显示纯菌体系中TSB培养基是效果较好的增菌液。TSB培养基增菌8h后条带较暗,这可能是由于小肠结肠炎耶尔森菌正处于延滞期,所以菌液中含菌量较低。然而PSB和ITC培养基增菌后并未有电泳条带产生可能是由两个原因所致:首先PSB对于小肠结肠炎耶尔森菌的增菌效果不如TSB好,这与计数结果一致;其次由于小肠结肠炎耶尔森菌在PSB培养基中为无色透明状,所以很难获得菌体沉淀从而致使提取DNA浓度较低。在杂菌体系中TSB培养基效果不如PSB培养基好,这可能是由于在TSB培养基中大多数细菌均适合增长,导致杂菌与小肠结肠炎耶尔森菌对营养物质形成了竞争关系。PSB培养基则选择性较强,从而更适合小肠结肠炎耶尔森菌的增长。通过传统培养鉴定的方法可以在杂菌系体系中分离出阳性菌株,从而排除了PCR反应假阳性结果的出现。
实时荧光PCR反应结果显示,小肠结肠炎耶尔森菌处于纯菌体系中时在TSB培养基中增菌效果优于其他两种增菌液,并且增菌24h时即可稳定检测。将该菌接种于阴性肉样,用于模拟实际样品检验时的杂菌体系环境,此时 PSB培养基的增菌效果好于TSB和ITC培养基,这与等[13]的研究结果基本一致,并且他还指出TSB培养基与PSB培养基相比更容易引起假阴性结果的出现。在小肠结肠炎耶尔森菌接种量为480CFU/g的肉样杂菌体系中,使用PSB增菌液对小肠结肠炎耶尔森菌经过8h的增菌即可进行实时荧光PCR的检测。
小肠结肠炎耶尔森菌毒力检测基因包括:质粒上的黏附素基因(yadA)、毒力活化因子基因(virF),染色体上的黏附侵袭位点基因(ail)、耐热肠毒素基因(ystA)[14]。在这4种毒力基因中,质粒由于在菌种培养过程中易丢失,而Yst基因由于在多种致病菌中均出现而难以保证特异性检测该菌,所以选定特异性较高的ail基因作为检测目的基因。本实验利用Nakajima等[15]设计的引物进行PCR扩增,该引物通过实验结果显示特异性较好进而极大的减少了假阳性结果的产生。在实时荧光PCR实验中根据普通PCR中的引物选择探针,本实验探针3'端使用的淬灭基团并非为通常采用的TAMRA基团,而采用了非荧光基团Eclipse。这种淬灭基团由于本身不产生荧光而降低了本底信号,可使反应的效率和可靠性增加。
随着近年来多起食品安全事件的发生,食源性致病菌的检测显得尤其重要。传统培养分离鉴定方法依然是检测致病菌的主要方法,但其具有时间长、工作量大以及需要具有一定经验的人员操作等特点。本实验通过对小肠结肠炎耶尔森菌的前增菌方法的研究发现,利用PSB培养基对样品进行8h前增菌,结合实时荧光PCR反应可快速准确地检测致病性小肠结肠炎耶尔森菌。
[1] 刘琳. 肉中革兰氏阴性食源性致病菌[J].肉类研究, 2008, 22(6): 33-45.
[2] 郑浩轩, 姜泊. 小肠结肠炎耶尔森菌研究概况[J]. 中国微生态学杂志, 2006, 18(5): 416-419.
[3] 王炜, 丁洁, 吴咏梅, 等. 几种检验猪扁桃体中小肠结肠炎耶尔森菌方法的对比[J]. 职业与健康, 2007, 23(22): 2046-2047.
[4] JOURDAN A D, JOHNSON S C J, WESLEY I V. Development of a fluorogenicnuclease PCR assay for detection of the ail gene of pathogenic Yersinia enterocolitica[J]. Appl Environ Microbiol, 2000,66(9): 3750-3755.
[5] BHADURI S. Comparison of multiplex PCR, PCR-ELISA and fluorogenicnuclease PCR assays for detection of plasmid-bearing virulent Yersinia enterocolitica in swine feces[J]. Molecular and Cellular Probes, 2002, 16: 191-196.
[6] VISHNUBHATLA A, FUNG D Y C, OBERST R D, et al. Rapidnuclease (TagMan) assay for detection of virulent strains of Yersinia enterocolitica[J]. Appl Environ Microbiol, 2000, 66: 4131-4135.
[7] FUKUSHIMA H, TSUNOMORI Y, SEKI R. Duplex real-time SYBR Green PCR assay for detection of 17 species of food- or waterborne pathogenic in stools[J]. Clin Microbiol, 2003, 41(11): 5134-5146.
[8] 郑浩轩, 张明军, 孙勇, 等. 实时定量聚合酶链反应检测腹泻粪便中小肠结肠炎耶尔森菌的研究和评价[J]. 中华医学杂志, 2006, 86(32):2281-2284.
[9] JACOBSEN N R, BOGDANOVICH T, SKURNIK M, et al. A realtime PCR assay for the specific identification of serotype O:9 of Yersinia enterocolitica[J]. Journal of Microbiological Methods, 2005, 63(2):151-156.
[10] FREDRIKSSON-AHOMAA M, HARTMANN B, SCHEU P, et al.Detection of pathogenic Yersinia enterocolitica in meat using real-time PCR[J]. Journal of Consumer Protection and Food Safety, 2007, 2(2):202-208.
[11] NILSSON A, LAMBERTZ S T, STALHANDSKE P, et al. Detection of Yersinia enterocolitica in food by PCR amplification[J]. Applied Microbiology, 1998, 26(2): 140-144.
[12] BHADURI S, WESLEY I V, BUSH E J. Prevalence of pathogenic Yersinia enterocolitica strains in pigs in the United States[J]. Applied and Environmental Microbiology, 2005, 71(11): 7117-7121.
[14] 王鑫, 邱海燕, 肖玉春, 等. 小肠结肠炎耶尔森菌耐热性肠毒素B基因(yst)初步研究[J]. 中国人兽共患病杂志, 2005, 21(6): 449-453.
[15] NAKAJIMA H, INOUE M, MORI T, et al. Detection and identification of Yersinia pseudotuberculosis and pathogenic Yersinia enterocolitica by an improved polymerase chain reaction method[J]. Journal of Clinical Microbiology, 1992, 30(9): 2484-2486.
Selection of Pre-enrichment Methods for Yersinia enterocolitica
NIU Lei1,ZHU Chang-qing1,2,ZHOU Guang-hong1,*,XU Xing-lian1, LI Bin1,JIANG Yun1
(1. Nantional Center of Meat Quality and Safety Control, Nanjing Agricultual University, Nanjing 210095, China;2. Jiangsu Entry-Exit Inspection and Quarantine Bureau, Nanjing 200001, China)
Yersinia enterocolitica has been paid so much attention as a kind of foodborne pathogen. The pre-enrichment of Yersinia enterocolitica was conducted by using the cultivation in TSB, PSB and ITC media. The pre-enrichment effect was evaluated by real-time PCR. The results indicated that the cultivation in TSB medium was better than other two media for pure Yersinia enterocolitica system. The enrichment time was 24 h. In addition, an enhanced sensitivity and shorten enrichment time (8 h) of Yersinia enterocolitica were achieved in the mixed microbe system containing TSB and ITC. Therefore, PSB can be used in the detection of Yersinia Enterocolitica in samples.
Yersinia enterocolitica;pre-enrichment;real-time PCR;culture medium;foodborne pathogen
TS251.1
A
1002-6630(2011)05-0168-04
2010-05-13
国际科技合作项目——食品质量安全控制技术研究 (2009DFA31770);国家自然科学基金项目(31071614)
牛蕾(1985—),女,硕士研究生,主要从事肉品质量安全检测研究。E-mail:hingis1985@126.com
*通信作者:周光宏(1960—),男,教授,博士,主要从事肉品科学研究。E-mail:ghzhou@njau.edu.cn

