表面等离子体共振技术在农药残留检测研究中的应用
林 钊,刘 霞 *,李 迎
(湖南农业大学食品科技学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
表面等离子体共振技术在农药残留检测研究中的应用
林 钊,刘 霞 *,李 迎
(湖南农业大学食品科技学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
表面等离子共振(SPR)技术具有灵敏度高、操作简单、能够实时监测反应的动态过程,只需对样品进行简单的预处理,无需进行标记,也可以无需纯化各种生物组分,耗样量少,检测时间短,已被广泛应用于各个研究领域。该技术不仅可以检测分析物,而且可以测定分子间相互作用的动力学常数。目前,SPR在检测食品和环境领域中的农药残留做了大量的研究工作。本文简单介绍SPR的基本原理以及SPR生物传感器的类型,重点综述SPR生物传感器应用于农药检测中传感芯片的识别分子种类,检测方法以及目前SPR检测农药的研究现状,最后对SPR生物传感器应用于农药检测领域的发展前景作出展望。
表面等离子共振(SPR);传感器;农药;检测
表面等离子共振(surface plasmon resonance,SPR)现象自1902年Wood[1]发现至今已有一百多年的历史。20世纪80年代初,Nylander等[2]和Liedberg等[3]首次将SPR技术用于化学领域,并成功地研制出第一个SPR气体传感器。从此应用SPR传感器在检测领域的研究进入了快速发展阶段。目前,SPR技术已应用到生物[4]、药物[5]、环境[6]、食品安全[7]等多个领域。
随着世界人口的增加和社会的发展,人类对农产品的需求量越来越大,不可避免地对果蔬使用大量农药。农药的使用不仅会残留在果蔬上,也会污染土壤、水等人类生存的环境。农产品和环境中残留的农药则会通过食物链等途径,直接或间接地影响生态系统的平衡和人类的健康,严重时甚至会导致人畜出现急性中毒或造成三致毒性、神经毒性、遗传基因毒性、免疫毒性等慢性危害[8],因此对农药残留的检测是十分重要的。近年来发展了多种农药残留的检测方法[9-15],其中SPR传感器具有高度的专一性、快速、简单、高灵敏、可实时监测反应的动态过程、无需标记、耗样量极少等优点,在农药残留的检测领域具有明显的优势,具有潜在的应用前景。
1 SPR工作原理
SPR是一种物理光学现象。当一束P偏振光以一定的角度入射到棱镜中,若入射角大于临界角时,光线将发生全内反射,在全内反射的情况下,电场在金属与棱镜的界面处并不立刻消失,而是向金属介质中传输振幅呈指数衰减的消失波。该消失波可引发金属薄膜中的自由电子,使其形成表面等离子体(surface plasmon,SP)(图1中A-2)。当入射光波长为某一适当值的条件下,由SP形成的表面等离子波(surface plasmon waves,SPW)与消失波的频率和波数相等时,二者将发生共振。此时入射光被吸收,使反射光能量急剧下降,在反射光谱上出现共振峰(即反射光强度最低值,对应的角度为共振角,见图1中B-2)。SPR对金属表面的介质折射率微小变化是极其敏感的,待测物与金属薄膜接触时若存在吸附、生化反应或构象的改变,则金属表面的折射率就会发生变化,共振角随即发生改变[16-18],据此,可对待测物进行检测和分析。如图1中A-1所示,在传感器金膜表面上固定抗体(生物识别分子),然后使游离的抗原缓缓通过流通池,当抗原抗体发生特异性结合时,SPR的共振角就会随之发生改变(图1中B-2),并且随着反应时间的改变共振角也会发生相应的改变,直至抗原-抗体反应达到平衡(图1中B-3),共振角也不会再发生改变,故通过SPR反射光谱的共振峰的变化可对抗原进行高灵敏度的检测。
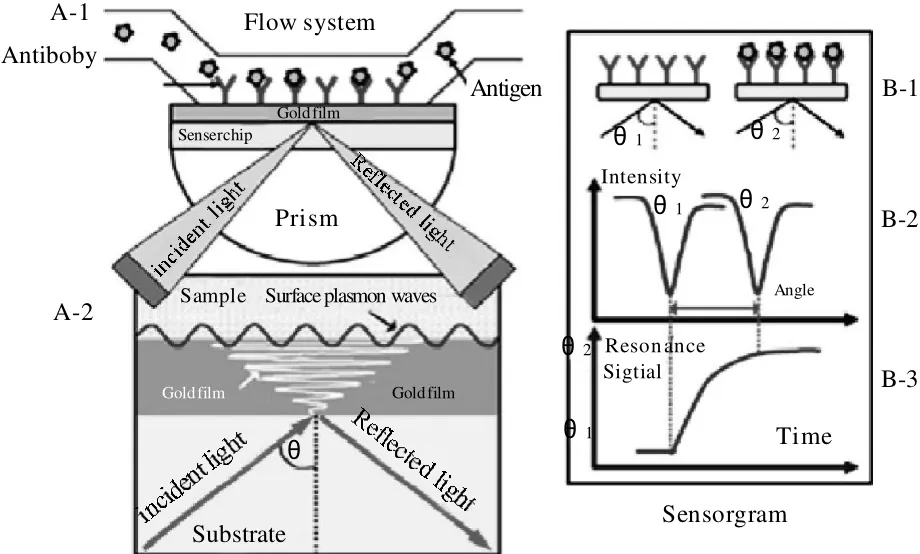
图1 SPR传感器原理示意图[18]Fig.1 Principle of the surface plasmon resonance sensor[18]
2 SPR传感器类型
目前常用的SPR传感器,根据其耦合器件的不同可分为3种类型,分别为:棱镜型SPR传感器、光纤型SPR传感器和光栅型SPR传感器[16]:1)棱镜型SPR传感器是利用棱镜做为光的耦合器件,是当今世界上应用最广泛的传感器。该传感器具有容易再生,使用成本相对较低等优点。早在1990年该传感器就已经实现了商品化,至今为止有众多公司或机构在研发和生产,如美国Biacore AB公司生产的Biacore 1000、Biacore 2000、Biacore 3000,美国Affinity Sensors公司生产的IASys,日本Nippon Laser Electronics生产的SPR-670,中国科学院电子研究所研制的SPR-2000,西班牙SENSIA,SL公司生产的SPR传感器等[19]。国内外也有不少实验室使用自组装棱镜型的SPR传感器如:Liu等[20]自组装的波长检测型的棱镜型SPR传感器;2)光纤型SPR传感器是利用光纤作为光的耦合器件,该传感器非常容易小型化,具有方便野外作业的优点,但由于其再生性不好,使用成本高,而导致使用程度低于棱镜型SPR传感器。Rajan等[21]报道了利用光纤型的SPR传感器来进行实验研究;Tsai等[22]研究了增强的光纤形SPR传感器信号的方法;3)光栅型SPR传感器采用的是衍射光栅耦合入射光,其结构比棱镜型SPR传感器复杂,并且在实际分析中存在着溶液对光的吸收问题。与棱镜耦合入射光的方式相比较,光栅耦合法在计算方面极其复杂,无法应用麦克斯韦方程去求解边界条件,因此使用较少[16]。
3 SPR检测农药的识别分子种类及检测方法
SPR传感器首次检测农药(除草剂阿特拉津(atrazine)和西玛津(simazine))是在20世纪90年代。随着SPR仪器的发展和研究的深入,目前已发展了多种应用于SPR检测农药的识别分子和检测方法。
3.1 SPR检测农药的识别分子种类
SPR传感芯片上固定的识别分子必须具有高度专一性,即结构上具有的特异结合位点只能与特定生物分子发生相互作用。不难发现,只要能跟农药特异性结合的物质都可以考虑作为SPR检测农药的识别分子。根据近年来的报道,应用于农药检测的SPR传感芯片的识别分子主要有以下几种类型。
3.1.1 抗体
抗体作为传感芯片的识别分子,一般以农药或其衍生物作为抗原物质。利用抗体作为识别分子检测农药是目前世界上应用最广、最普遍的SPR检测方法,近年来有大量的文献报道[18,23-31]。早在1993年Minunni等[25]将Atrazine的一个衍生物固定在传感器表面,Atrazine的抗体与含有除草剂的样品混合,当抗体与固定在传感器表面的Atrazine衍生物反应时,SPR响应信号的强度随着样品中Atrazine的浓度不同而改变。最低检测限为0.05ng/mL,分析时间为15min。Mouvet等[26]在1997年用Simazine的单克隆抗体Anti-simazine作为识别分子测定了地表水中的Simazine,单个样品的测定时间为22min,检测范围为0.2~2.4μg/L,传感芯片经过约200次重复测定后没有明显变化,重现性好。
3.1.2 酶
有机磷和氨基甲酸酯类农药是乙酰胆碱酯酶(AChE)的抑制剂,这些农药通过与AChE的活性位点丝氨酸(Ser200)残基形成共价键从而抑制了AChE的活性[32],因此可以应用AChE作为SPR生物传感器的生物识别分子进行农药的检测。2006年Lin等[33]报道了以AChE作为识别分子,利用金纳米粒子作为基质膜的光纤型SPR传感器,检测对氧磷。该实验小组首先将5cm清洁后的裸露光纤浸泡在含有金胶体的溶液中,使光纤表面自组装单分子层的金纳米粒子。然后将修饰了纳米金粒子的传感器芯片浸泡在胱胺盐酸盐(cystamine dihydrochloride)溶液中2h,接着在室温条件下用2.5%戊二醛溶液中浸泡40min,再用水冲洗并风干。以上处理使传感芯片表面固定的醛基与AChE中的胺基发生共价结合,从而在传感芯片上组装AChE。最后将对氧磷溶液通入AChE修饰的传感芯片进行检测。他们的研究表明,利用酶作为识别分子检测对氧磷,检测上限为0.234nmol/L,该方法检测对氧磷具有高的灵敏度和稳定性。
3.1.3 信使核糖核酸(mRNA)
以mRNA作为识别分子,是由于某种mRNA与特定的农药具有特异性。其检测方法是:首先在传感芯片表面固定亲和素,再将生物素化的DNA/RNA探针组装到亲和素上,然后引入mRNA标记的农药,由于DNA/RNA探针能与农药特异结合的mRNA互补配对,从而可以进行农药的SPR检测。亲和素是由4个相同的含128个氨基酸的亚基组成,并且每一个亚基含有一个与生物素结合的位点,能与生物素或其衍生物形成高度稳定的化合物[34],生物素-羟基琥珀亚胺酯(biotinhydroxysuccinimide,BNHS)末端羧基可与蛋白质、糖类、DNA和酶等多种类型的大小分子形成生物素化的产物,而且不影响这类物质的生物活性。亲和素-生物素[35]的结合是已知的生物大分子与小分子配体非共价结合最强的一例,其具有结合快,在多种有机溶液中可稳定存在的特点。Lim等[36]在2000年报道了利用该方法进行除草剂Atrazine的检测,应用的是对Atrazine具有特异性的酿酒酵母菌的P450 mRNA。该实验小组首先将链霉亲和素(streptavidin)固定在SPR传感芯片的表面,然后将生物素化的寡核苷酸探针(oligonucleotide probes)组装在链酶亲和素上,P450 mRNA与寡核苷酸探针发生互补,从而对Atrazine进行检测。他们的研究结果表明,该方法的SPR响应灵敏度有很大的提高,最低检测限达到1pg/mL。
“你不同意,我就跟你把官司打到高院去。”龙斌目光坚定地看着竹韵。竹韵没有回答他,不轻不重地掐了他一把,然后咬咬唇,上前抓住了轮椅扶手。海力先是略略一愣,也马上上前抓住另一边扶手,和竹韵一起推着龙斌慢慢走出了法庭。
3.1.4 光合反应中心(reaction centers,RCs)
光系统Ⅱ(photosystemⅡ,PSⅡ)是植物类囊体膜的一种光合作用单位,它含有两个捕光复合物和一个光反应中心。三嗪类(triazine)除草剂可以取代该光反应中心的主要组分D1蛋白上的第二个醌结合位点(QB),从而抑制光合作用中的光反应,因此可以利用该方法对三嗪类除草剂进行检测。但由于Alsoother类除草剂也可以与D1蛋白结合,故其特异性不佳[37-38]。一些研究者通过研究紫细菌(purple bacterial)的RCs后,发现其结构和功能均与植物的D1蛋白相似,能与QB结合,并且与Triazine类除草剂结合强度远远大于其他除草剂,因此RCs也可以作为识别分子,应用于SPR检测Triazine类除草剂。在2000年,Nakamura等[39]报道了一种直接检测三嗪类除草剂的方法,该小组应用的检测方法是利用紫细菌(purple bacterium)的RCs。他们将组氨酸标记的RCs固定在SPR传感器芯片表面上,并利用镍-氨基三乙酸(nickel-nitrilotriacetic acid)作为桥梁结合一个Triazine类除草剂Atrazine。他们的研究发现Atrazine在0.1~1μg/mL的质量浓度范围内与SPR的响应信号呈比例关系,并且应用RCs组装传感芯片的方法直接检测农药的灵敏度高于应用抗体组装传感芯片的方法。他们[40]在2003年还报道了将大量亚基组氨酸标记的反应中心(heavy-subunit-histidine-tagged RCs,HHisRCs)固定在传感芯片表面作为识别分子(图2),由于HHisRCs会与Atrazine发生化学的螯合作用而结合,从而能够检测Atrazine。同时他们还对含氯除草剂敌草隆(DCMU)和2-甲,4-氯丙酸(MCPP)进行对比检测。他们的研究表明Atrazine的最低检测限为1μg/mL,DCMU的最低检测限为20μg/mL,MCPP信号不明显。

图2 阿特拉津与反应中心结合过程[40]Fig.2 Schema of atrazi binding to the RC[40]
3.2 检测方法
由于小分子很难引起足够大的折射率变化, 所以一般情况下SPR检测分子质量小于500D的物质较困难[41-42]。农药属于小分子物质,因此利用SPR传感器对农药的直接检测灵敏度还不是很高[43]。鉴于此,研究人员采取一些增强SPR检测信号的方法进行农药的SPR检测。
3.2.1 竞争法
所谓的竞争法是指先在芯片表面固定半抗原-蛋白交联物,然后注入被分析物与固定浓度的抗体混合液,使表面固定的半抗原和溶液中的被分析物竞争的结合溶液中抗体的方法(图3),当溶液中被分析物浓度减少时则芯片表面结合的抗体就多,SPR响应信号就大。因此SPR传感器的响应信号与被分析物浓度成反比。竞争法可明显提高SPR检测小分子的灵敏度,是目前检测农药的最常用的方法。Dostalek等[23]利用竞争法来检测Atrazine和2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D),该研究小组首先把牛血清白蛋白和Atrazine结合物(BSA-atrazine),牛血清白蛋白和2,4-D结合物(BSA-2,4-D)组装在传感器芯片上。接着将Atrazine标准品溶解在氰化甲烷(acetonitrile)中,质量浓度为1mg/mL;2,4-D标准品则准备在磷酸盐缓冲液(PBS)中,质量浓度为20μg/mL。然后分别用PBS把上述两种溶液稀释成10-3~103ng/mL一系列质量浓度,并逐一与10μg/mL的单克隆抗体混合后,注入SPR传感器进行检测,此时组装在传感器表面的农药和固定抗体浓度的混合溶液中的农药(农药标准品)竞争相同数量的抗体。他们通过竞争法增强SPR响应信号得到的Atrazine和2,4-D最低检测限分别为0.07ng/mL和0.16ng/mL。Mauriz等[24]利用竞争法,比较了单一和同时分析毒死蜱(有机磷类)、西维因(氨基甲酸酯类)、DDT(有机氯类)3种农药,得出单一和同时分析的最低检测限分别为:DDT:32ng/L和18ng/L;毒死蜱:54ng/L和52ng/L;西维因:1.38μg/L和0.05μg/L。他们的研究表明:DDT和西维因同时分析的灵敏度高于单一分析,毒死蜱在单一和同时分析时灵敏度十分接近。Kim等[44]利用竞争法检测2,4-D,得到的最低检测限为0.1ng/mL。
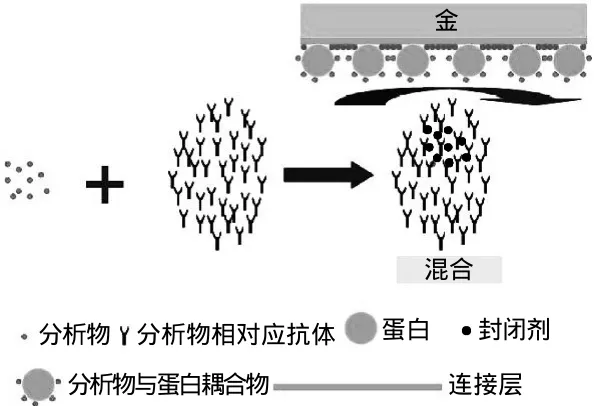
图3 竞争抑制实验示意图Fig.3 Schema of the competitive immunoassay format
3.2.2 三明治夹心法
传统的三明治夹心法就是将抗体固定在SPR传感器芯片的表面,然后引入抗原,使其与固定在芯片表面的抗体结合,此时加入二抗增强SPR响应信号[16]。该方法是利用在传感器芯片上结合更多的物质,使得SPR信号增强的一种方法(图4)。Shimomura等[45]利用三明治夹心法进行了Atrazine的检测,他们先在传感器表面组装Atrazine抗体(anti-atrazine),然后注入含有Atrazine和辣根过氧化物酶(HRP)的混合溶液。Atrazine和HRP也能发生特异性结合,混合溶液中同时存在Atrazine和Atrazine-HRP两种物质。当Atrazine和Atrazine-HRP与Anti-atrazine特异性结合后,最后注入HRP的抗体(antibody against HRP),在质量浓度为5ng/mL的Atrazine样品中检测到信号放大比率为1.9。
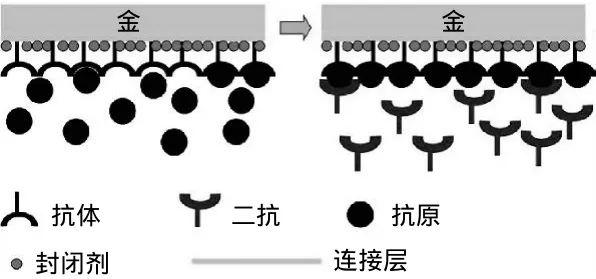
图4 三明治夹心法Fig.4 Schema of the sandwich method
3.2.3 利用银膜作为传感芯片
SPR研究的是反射光谱,选择不同的金属材料作为构成表面等离子体共振的基质膜将会对SPR光谱产生很大的影响,所以要首先考虑反射率较高的金属,在可见光范围内,金属Ag、Al、Au、Cu的反射率高,Au的反射率虽然不如Ag膜,但它的稳定性最好,故SPR最常用Au膜作为基质膜[46]。但由于银的高反射率,也有研究者应用银膜进行农药的检测。Rajan等[21]利用Ag作为基质膜的光纤型SPR传感器检测了毒死蜱,该研究小组利用蒸镀技术在纤芯直径为600μm和0.40数值孔径的光纤上蒸镀了一层大约55nm厚银膜。在镀膜前先要除去光纤上约20cm包层,然后再用丙酮清洗,接着把清洗后的的光纤置于真空室中,调节真空室气压为1.33322×10-4Pa。在真空处理15min后,加热烘烤20min,完成烘烤5min后,真空管完全打开直到真空状态完成。最后增加电压直到银完全蒸发,待冷却后从真空室取出,银膜厚度约55nm。使用该方法检测毒死蜱,最低检测浓度为0.1μmol/L。应用Ag作为基质膜要现镀现用,并采取措施保护Ag膜防止其氧化。
3.2.4 金纳米粒子(gold nanoparticles,AuNPs)
应用AuNPs是增强SPR响应信号的一种有效手段,尤其适用于小分子物质的检测。由于AuNPs本身的折射率大以及AuNPs的表面等离子体子与金膜本身的表面等离子体子发生了耦合[16](图5),引入AuNPs可明显提高SPR传感器灵敏度。金纳米粒子已成功地应用于生各种物分子的标记,如酶[47]和DNA[48]和抗体[48-52]等,利用金纳米粒子标记除草剂Atrazine抗体也有相关报道[53]。2009年Huang等[43]报道了利用AuNPs标记氨基甲酸盐(carbamate)农药从而提高SPR响应信号的方法。该研究小组利用AuNPs标记Carbamate的过程如下,首先把Carbamate置于酒精溶液中配制成合适的浓度。接着在持续搅拌条件下缓慢滴加AuNPs溶液,在室温、黑暗环境中保存过夜。然后以1200r/min的速度离心10min,收集沉淀物,用PBS缓冲液调制成悬浮液。最后利用紫外可见光谱对该耦合物表征,以确认Carbamate已被AuNPs标记。他们首先将酶固定在经过巯基十一酸修饰SPR芯片上,然后通入AuNPs标记的Carbamate,进行检测。他们的检测结果显示利用AuNPs增强SPR信号方法检测两个不同醚键的Carbamate 4a与4b,最低检测限分别达到7.0pmol/L和12pmol/L。2008年Valera等[53]研究了利用金纳米粒子标记Atrazine抗体,进行Atrazine的高灵敏SPR检测。2010年该研究小组[54]利用金纳米粒子标记Atrazine的抗体,扩大SPR信号,检测红酒中的Atrazine,实验得到的最低检测限远远低于欧洲标准中红葡萄酒的Atrazine最大残留量(50μg/kg)的标准。
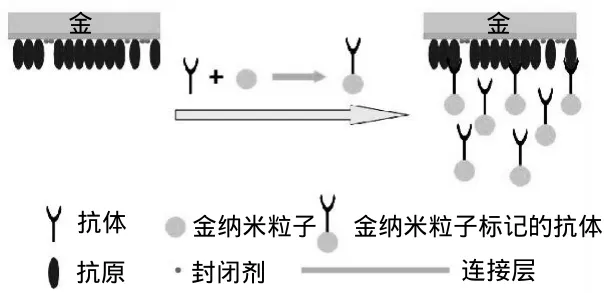
图5 金纳米粒子增强法Fig.5 Schema of SPR biosensor based on AuNPs signal enhancement
4 SPR 检测农药的研究现状
目前从国内外的研究现状来看,SPR技术对农药残留的研究主要集中于环境监控和饮用水中的杀虫剂和除草剂检测。
4.1 有机磷类杀虫剂检测
20世纪40年代,施拉德的第一个有机磷杀虫剂进入德国市场后,这一领域有了突飞猛进的发展。至今为止,有机磷农药超过了300个品种[55]。随之应用SPR生物传感器检测有机磷农药的研究也逐渐增多。
Mauriz等[29]利用SPR生物传感器检测有机磷酸酯类杀虫剂毒死蜱。他们应用竞争法进行检测,先将农药与BSA结合,然后固定在SPR传感器芯片上。检测到毒死蜱的最低检测限为50pg/mL左右,检测芯片经过200次的再生循环灵敏度没有发生明显的改变。2006年该实验小组[56]对实际样品地表水和饮用水中的毒死蜱进行检测,利用抗体作为生物识别分子,通过研究得到毒死蜱的最低检测限为55ng/L,检测时间约20min。Yang等[57]也有应用SPR Biacore 3000和光流环共振器(opto-fluidic ring resonator,OFRR)两种仪器分别检测机磷农药的报道。Kaufiman等[58]报道了应用SPR测定农药有机磷和甲基2-苯并咪唑氨基甲酸酯。
4.2 苯氧羧酸类除草剂检测
苯氧羧酸类除草剂在环境中容易被降解[55],但在大量使用的情况下也会在环境形成残留,利用SPR检测苯氧羧酸类除草剂的研究开展得较早,在20世纪末已有关于检测此类农药的报道。
1998年,Revoltellalr等[59]利用SPR、酶联免疫(enzyme-linked immunosorbent assay,ELISA)、放射免疫(radioimmunoassay,RIA)技术3种方法分别对2,4-D进行检测。他们研究结果表明利用SPR方法检测2,4-D,在0.001~1.0mg/L范围内呈线形,因而SPR更适合检测2,4-D。2000年Svitel等[27]利用两种方法检测2,4-D,并进行了对比。方法一是在传感器芯片上直接固定牛血清白蛋白和2,4-D耦合物(BSA-2,4-D),然后注入2,4-D单克隆抗体进行检测,最后用葡萄糖再生;方法二是首先在传感芯片上修饰一层葡聚糖,接着在葡聚糖上固定伴刀豆蛋白A和2,4-D耦合物(Con-A-2,4-D),然后注入2,4-D单克隆抗体进行检测,最后用葡萄糖再生。结果显示第一种检测方法不能再生;第二种检测方法再生性好,在两个月内进行约200次重复实验,结果没有显著差异。Kaur等[28]报道利用A蛋白(protein A)作为连接层,分别将BSA-2,4-D和BSA-atrazine的耦合物固定在传感芯片的表面,应用竞争法检测了2,4-D和Atrazine。Gobi等[60]报告了利用物理的吸附作用把2,4-D-BSA组装到传感芯片的表面的方法,进行2,4-D的SPR检测。他们的研究发现,利用这种方法所制造的芯片检测2,4-D在重复使用20次左右都具有良好的重现性。随后,该研究小组[30]同样利用静电吸附作用,分别在SPR传感芯片表面固定BSA-2,4-D耦合物与卵清蛋白和2,4-D耦合物(OVA-2,4-D),利用竞争法进行了2,4-D的检测,BSA-2,4-D与OVA-2,4-D的最低检测限分别是0.5nmol/L和0.1nmol/L。Kim等[61]研究了应用SPR技术直接对自然界水体中的2,4-D进行检测。Soh等[62]也报道了采用竞争法对二恶英的前体物质2,4-D的SPR检测。
4.3 三氮苯类除草剂的检测
三氮苯类化合物的除草活性于1952年被发现,1957年商品化。这类化合物至今仍是很有价值的旱田除草剂,以用于玉米田的Atrazine最为突出[55]。SPR对此类除草剂的研究也较多,特别是针对Atrazine的检测。
Chegel等[41]利用SPR生物传感器检测了抑制光合作用的农药Atrazine,该方法是将蛋白质D1固定在传感芯片金膜的表面,当蛋白质D1中的质体醌遇到Atrazine时,Atrazine会将质体醌置换,从而可利用SPR生物传感器来检测Atrazine。该实验小组利用以上原理对Atrazine的水溶液进行检测,其检测范围为0.05~5.0μg/mL。2007年Farré等[63]报道了利用一种便携式的SPR生物传感器检测水中的Atrazine。首先在传感器金膜芯片表面用烷基硫醇(alkanethiolate)修饰,然后固定Atrazine的衍生物。将Atrazine样品和多克隆抗体混合后,注入SPR的流通池并进行分析。最低检测限稳定在20pg/mL,该传感器的循环再生时间大约需要25min。Sasaki等[64]利用有机硅修饰SPR传感芯片,再将Atrazine单克隆抗体固定在芯片表面。用SPR分别测定添加了0.05μg/L Atrazine的河水与0.05μg/L的标准溶液,研究结果表明两者有十分接近的响应值。Strachan等[65]利用对Atrazine具有特异性的单链抗体片段进行实验,他们的研究表明来源于植物和细菌的两种单链抗体片段,与单克隆抗体比较有相似的结合比率。但是单体的植物和细菌单链抗体片段,与二聚的单链抗体片段和单克隆抗体在固定抗原方面相比较,呈现出较低的亲合力。Kusharyoto等[66]利用SPR Biacore 3000研究了几种不同的抗原结合片段(fragment of antigen binding,Fab)与Atrazine的动力学参数。Nabok等[67]还报道了利用特异性抗体固定在传感芯片表面,分别对Atrazine和Simazine进行检测。Harris等[68]利用抗Simazine的IgG抗体与抗Simazine Fab片段分别检测Simazine,得到的最低检测限前者为0.16μg/L,后者为0.11μg/L。
4.4 有机氯类杀虫剂、氨基甲酸酯类杀虫剂和其他类型杀虫剂的检测
有机氯类农药曾是世界上应用最广泛的杀虫剂。1939年瑞士化学家保罗·米勒制成DDT,从此开始了生产和使用有机氯农药的历史[55]。由于DDT在环境中不容易降解,并且DDT会通过生物富集作用存在于食品中,许多国家已经禁止使用。但是直到目前,DDT在环境中的残留情况还是比较严重。氨基甲酸酯类杀虫剂因其有高的生物活性和选择性以及易于生物降解等特点而成为农药中的一大类。近年来SPR对其的研究也有报道。
2006年Mauriz等[12]利用自组装单分子膜(SAM)的形式在裸露的传感芯片表面固定巯基烷酸,由于巯基烷酸的巯基端可与金相互作用发生键合并稳定的吸附在金膜上,巯基烷酸的羧基端作为活性基团,通过EDC/NHS激活后可与抗体连接。并用抗体作为识别分子检测西维因,得到的最低检测限为1.38μg/L。同一年,该研究小组也利用该方式,检测了含量不超过欧洲法规标准的天然水中DDT、毒死蜱、西维因3种有机污染物[69]。Mauriz等[70]也利用SPR生物传感器检测DDT,其检测方法是竞争法。他们先将DDT衍生物固定在自组装烷基硫醇单分子膜的传感芯片上,分别利用DDT的单克隆抗体、DDT与其代谢物的单克隆抗体,用竞争法来进行实验。结果显示单独检测DDT的最低检测限是15pg/mL,DDT与其代谢物的最低检测限是31pg/mL。Keegan等[71]分别利用SPR和超高效液相色谱-串联四极杆质谱(UPLC-MS-MS)对牛奶样品中的苯并咪唑氨基甲酸酯进行检测,该实验研究发现SPR更适合用于苯并咪唑氨基甲酸酯检测。2004年Obataya等[72]报道了把缩氨酸固定在芯片表面,应用SPR技术对农药中间体二氯苯胺进行检测,发现缩氨酸对二氯苯的识别具有特异性。Devlin等[73]报道了利用SPR技术对联吡啶类除草剂百草枯(paraquat)进行检测,实验结果表明单链抗体片段对百草枯的特异性与Fab片段相似。在生物杀虫剂方面,Gunning等[74]报道了,利用SPR研究棉铃虫酯酶与苏云金杆菌杀虫剂Cry1Ac毒素的相互作用。等[75]研究了农药二苯脲的单克隆抗体-抗原复合物,获得IgG和其Fab片段的键合动力学速率常数,他们的研究表明,随着温度的下降,两者的键合能力增强,在15min内便可完成0.1μg/L半抗原的测定。
5 SPR检测农药的现存问题及解决方法
根据SPR检测农药的研究现状,存在的问题与解决措施主要有以下几个方面:1)农药多属小分子物质,SPR检测小分子物质的灵敏度还有待于提高。以往研究提高SPR检测小分子灵敏度的方法,主要集中在利用竞争法代替直接法,目前随着新材料的运用(如纳米材料)、新技术的发展(如SPR与其他仪器的联用)、新方法的出现(如多检测方法结合),在不久的将来这一瓶颈极其有可能被突破。2)目前SPR的检测成本比较高,一次性使用的传感芯片是检测成本居高不下的重要因素。据此,多个实验室已经开展传感芯片循环再生的相关研究工作。3)SPR应用于农药检测的研究开展的相对较晚,实际推广使用的条件还不够成熟,并且面临着很多的挑战(如重现性),但是随着今后实验条件的优化以及研究的进一步深入,SPR检测农药技术的推广使用必将会成为现实。
6 SPR检测农药的发展前景
尽管SPR应用于农药的检测已经做了很多研究工作,针对目前农药检测的现状和SPR检测技术的不断改进,SPR技术应用于农药检测可以向以下方面发展:1)对于有机磷类、氨基甲酸酯类农药的检测,用酶作为生物识别分子,可以考虑利用其他来源更广、成本更低并且具有特异性的酶类,代替乙酰胆碱酯酶,比如:利用植物胆碱酯酶,以降低实验成本,有利于SPR技术用于检测农药的推广使用。2)在目前SPR检测微生物领域中出现了一种识别分子:噬菌体[76-77]。利用噬菌体作为识别分子,可以尝试寻找并建立SPR检测微生物源农药(天然源农药如阿维菌素)的方法。3)利用多种方法结合,以增大SPR的响应信号,如金纳米粒子增强SPR信号法与三明治法结合使用。4)目前SPR对农药检测的研究主要集中在3类杀虫剂和两类除草剂,分别是:有机磷类杀虫剂、氨基甲酸酯类杀虫剂、有机氯类杀虫剂和苯氧羧酸类除草剂、三氮苯类除草剂。而有机氮类、拟除虫菊酯类、有机金属类的研究较少;杂环类检测主要集中于有机污染物方面。在以后的SPR研究中可扩大检测农药的种类,使得SPR检测农药的应用范围更广。
随着SPR技术的进一步发展与成熟, SPR技术将在农药残留的检测中发挥越来越重要的作用,为农产品检测、环境监控提供一种高灵敏、实时、方便、快捷的检测方法。
[1] WOOD R W. On a remarkable case of uneven distribution of light in a diffraction grating spectrum[J]. Proceedings of the Physical Society of London, 1902, 18(1): 269-275.
[2] NYLANDER C, LIEDBERG B, LIND T. Gas detection by means of surface plasmons resonance[J]. Sensors and Actuators, 1982/1983, 3: 79-88.[3] LIEDBERG B, NYLANDER C, LUNDSTROM I. Surface plasmons resonance for gas detection and biosensing[J]. Sensors and Actuators,1983, 4: 299-304.
[4] POLLET J, DELPORT F, JANSSEN K P F, et al. Fiber optic SPR biosensing of DNA hybridization and DNA-protein interactions[J].Biosensors and Bioelectronics, 2009, 25(4): 864-869.
[5] ROCHE P J R, NG S M, NARAYANASWAMY R, et al. Multiple surface plasmon resonance quantification of dextromethorphan using a molecularly imprintedβ-cyclodextrin polymer: A potential probe for drug-drug interactions[J]. Sensors and Actuators B: Chemical, 2009,139(1): 22-29.
[6] FORZANI E S, FOLEY K, WESTERHOFF P, et al. Detection of arsenic in groundwater using a surface plasmon resonance sensor[J].Sensors and Actuators B: Chemical, 2007, 123(1): 82-88.
[7] PILIARIK M, PAROVA L, HOMOLA J. High-throughput SPR sensor for food safety[J]. Biosensors and Bioelectronics, 2009, 24(5):1399-1404.
[8] 张志恒. 农药合理使用规范和最高残留限量标准[M]. 北京: 化学工业出版社, 2007: 1-7.
[9] LAMBROPOULOU D A, ALBANIS T A. Liquid-phase micro-extraction techniques in pesticide residue analysis[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(2): 195-288.
[10] QIAN Guoliang, WANG Limin, WU Yunru, et al. A monoclonal antibody-based sensitive enzyme-linked immunosorbent assay (ELISA) for the analysis of the organophosphorous pesticides chlorpyrifos-methyl in real samples[J]. Food Chemistry, 2009, 117(2): 364-370.
[11] SILVA M G D, AQUINO A, DOREA H S, et al. Simultaneous determination of eight pesticide residues in coconut using MSPD and GC/MS[J]. Talanta, 2008, 76(3): 680-684.
[12] MAURIZ E, CALLE A, ABAD A, et al. Determination of carbaryl in natural water samples by a surface plasmon resonance flow-through immunosensor[J]. Biosensors and Bioelectronics, 2006, 21(11): 2129-2136.
[14] BERNAL J L,J J, RIVERA J M, et al. On-line solid-phase extraction coupled to supercritical fluid chromatography with diode array detection for the determination of pesticides in water[J]. Journal of Chromatography A, 1996, 754(1/2): 145-157.
[15] KLEIN C, SCHNEIDER R J, MEYER M T, et al. Enantiomeric separation of metolachlor and its metabolites using LC-MS and CZE[J].Chemosphere, 2006, 62(10): 1591-1599.
[16] 刘霞. 波长检测型表面等离子体子共振传感器的性能改进及其应用[D]. 长春: 吉林大学, 2006.
[17] 吴英才, 袁一方, 徐艳平. 表面等离子共振传感器的研究进展[J]. 传感器技术, 2004, 23(5): 1-5.
[18] SHANKARAN D R, GOBI K V, MIURA N. Recent advancements in surface plasmon resonance immunosensors for detection of small molecules of biomedical, food and environmental interest[J]. Sensors and Actuators B: Chemical, 2007, 121(1): 158-177.
[19] 程慧, 黄朝峰, 段子渊. SPR生物传感器及其应用进展[J]. 中国生物工程杂志, 2003, 23(5): 46-49.
[20] LIU Xia, SUN Ying, SONG Daqian, et al. Enhanced optical immuosensor based on surface plasmon resonance for determination of transferrin[J].Talanta, 2006, 68(3): 1026-1031.
[21] RAJAN S, CHAND S, GUPT B D. Surface plasmon resonance based fiber-optic sensor for the detection of pesticide[J]. Sensors and Actuators B: Chemical, 2007, 123(2): 661-666.
[22] TSAI W H, LIN Yucheng, TAI Jiukai, et al. Multi-step structure of sidepolished fiber sensor to enhance SPR effect[J]. Optics & Laser Technology,2010, 42(3): 453-456.
[23] DOSTALEK J, PRIBYL J, HOMOLA J, et al. Multichannel SPR biosensor for detection of endocrine-disrupting compounds[J]. Analytical and Bioanalytical Chemistry, 2007, 389(6): 1841-1847.
[24] MAURIZ E, CALLE A, MANCLUS J J, et al. Multi-analyte SPR immunoassays for environmental biosensing of pesticides[J]. Analytical and Bioanalytical Chemistry, 2007, 387(4): 1449-1458.
[25] MINUNNI M, MASCHINI M. Detection of pesticide in drinking water using real-time biospecific interaction analysis(BIA)[J]. Analytical Letters,1993, 26(7): 1441-1460.
[26] MOUVET C, HARRIS R D, MACIAG C, et al. Determination of simazine in water samples by waveguide surface plasmon resonance[J].Analytica Chimica Acta, 1997, 338(1/2): 109-117.
[27] SVITEL J, DZGOEV A, RAMANATHAN K, et al. Surface plasmon resonance based pesticide assay on a renewable biosensing surface using the reversible concanavalin A monosaccharide interaction[J]. Biosensors and Bioelectronics, 2000, 15(7/8): 411-415.
[28] KAUR J, SINGH K V, SCHMID A H, et al. Atomic force spectroscopybased study of antibody pesticide interactions for characterization of immunosensor surface[J]. Biosensors and Bioelectronics, 2004, 20(2):284-293.
[29] MAURIZ E, CALLE A, MANCLUS J J, et al. Single and multi-analyte surface plasmon resonance assays for simultaneous detection of cholinesterase inhibiting pesticides[J]. Sensors and Actuators B: Chemical,2006, 118(1/2): 399-407.
[30] GOBI K V, KIM S J, TANAKA H, et al. Novel surface plasmon resonance (SPR) immunosensor based on monomolecular layer of physically-adsorbed ovalbumin conjugate for detection of 2,4-dichlorophenoxyacetic acid and atomic force microscopy study[J]. Sensors and Actuators B: Chemical, 2007, 123(1): 583-593.
[31] PETZ M. Recent applications of surface plasmon resonance biosensors for analyzing residues and contaminants in food[J]. MonatshefteChemie/Chemical Monthly, 2009, 140(8): 953-964.
[32] 杨娟, 杨芳芳. 浅谈用于广东蔬菜有机磷农药残留检测的几种生物识别酶[J]. 中外企业家, 2009(6): 135-136.
[33] LIN Tsaojen, HUANG Kuangtse, LIU Chiayu. Determination of organophosphorous pesticides by a novel biosensor based on localized surface plasmon resonance[J]. Biosensors and Bioelectronics, 2006, 22(4): 513-518.
[34] VAKNIN D, ALS-NIELSEN J, PIEPENSTOCK M, et al. Recognition processes at a functionalized lipid surface observed with molecular resolution[J]. Biophysical Journal, 1991, 60(6): 1545-1552.
[35] BASSIL N, MAILLART E, CANVA M, et al. One hundred spots parallel monitoring of DNA interactions by SPR imaging of polymerfunctionalized surfaces applied to the detection of cystic fibrosis mutations[J]. Sensors and Actuators B: Chemical, 2003, 94(3): 313-323.
[36] LIM T K, OYAMA M, IKEBUKURO K, et al. Detection of atrazine based on the SPR determination of P450 mRNA levels in Saccharomyces cerevisiae[J]. Analytical Chemistry, 2000, 72(13): 2856-2860.
[37] PILETSKAYA E, PILETSKY S, LAVRIK N, et al. Towards the D1 protein application for the development of sensors specific for herbicides[J]. Analytical Letters, 1998, 31(15): 2577-2589.
[38] PILETSKAYA E V, E'SKAYA S A, SOZINOV A A, et al. D1 protein: an effective substitute for immunoglobulins in ELISA for the detection of photosynthesis inhibiting herbicides[J]. Analytica Chimica Acta, 1999,398(1): 49-56.
[39] NAKAMURA C, HASEGAWA M, SHIMADA K, et al. Direct triazine herbicide detection using a self-assembled photosynthetic reaction center from purple bacterium[J]. Biotechnology and Bioprocess Engineering,2000, 5(6): 413-417.
[40] NAKAMURA C, HASEGAWA M, NAKAMURA N, et al. Rapid and specific detection of herbicides using a self-assembled photosynthetic reaction center from purple bacterium on an SPR chip[J]. Biosensors and Bioelectronics, 2003, 18(5/6): 599-603.
[41] CHEGEL V I, SHIRSHOV Y M, PILETSKAYA E V, et al. Surface plasmon resonance sensor for pesticide detection[J]. Sensors and Actuators B: Chemical, 1998, 48(1/3): 456-460.
[42] 张微微, 陈宇春, 王菊英, 等. 表面等离子体共振技术在环境污染物分析中研究[J]. 环境科学与技术, 2007, 30(5): 95-98.
[43] HUANG Xi, TU Haiyang, ZHU Danhua, et al. A gold nanoparticle labeling strategy for the sensitive kinetic assay of the carbamate-acetylcholinesterase interaction by surface plasmon resonance[J]. Talanta, 2009,78(3): 1036-1042.
[44] KIM S J, GOBI K V, IWASAKA H, et al. Novel miniature SPR immunosensor equipped with all-in-one multi-microchannel sensor chip for detecting low-molecular-weight analytes[J]. Biosensors and Bioelectronics, 2007, 23(5): 701-707.
[45] SHIMOMURA M, NOMURA Y, ZHANG Wei, et al. Simple and rapid detection method using surface plasmon resonance for dioxins, polychlorinated biphenylx and atrazine[J]. Analytica Chimica Acta, 2001, 434(2):223-230.
[46] 赵晓君. 表面等离子共振化学和生物传感器的研究[D]. 长春: 吉林大学, 1999.
[47] DU Dan, CHEN Shizhen, CAI Jie, et al. Immobilization of acetylcholinesterase on gold nanoparticles embedded in sol-gel film for amperometric detection of organophosphorous insecticide[J]. Biosensors and Bioelectronics, 2007, 23(1): 130-134.
[48] QIAO Feiyan, LIU Jun, LI Furong, et al. Antibody and DNA duallabeled gold nanoparticles: Stability and reactivity[J]. Applied Surface Science, 2008, 254(10): 2941-2946.
[49] CHOI J W, KANG D Y, JANG Y H , et al. Ultra-sensitive surface plasmon resonance based immunosensor for prostate-specific antigen using gold nanoparticle-antibody complex[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2008, 313/314: 655-659.
[50] MAO Xun, JIANG Jianhui, LUO Yan, et al. Copper-enhanced gold nanoparticle tags for electrochemical stripping detection of human IgG[J]. Talanta, 2007, 73(3): 420-424.
[51] MAO Shun, LU Ganhua, YU Kehan, et al. Specific biosensing using carbon nanotubes functionalized with gold nanoparticle-antibody conjugates[J]. Carbon, 2010, 48(2): 479-486.
[52] SAFENKOVA I V, ZHERDEV A V, DZANTIEV B B. Correlation between the composition of multivalent antibody conjugates with colloidal gold nanoparticles and their affinity[J]. Journal of Immunological Methods, 2010, 357(1/2): 17-25.
[53] VALERA E, JAVIER R A, SANCHEZ F J, et al. Conductimetric immunosensor for atrazine detection based on antibodies labelled with gold nanoparticles[J]. Sensors and Actuators B: Chemical, 2008, 134(1): 95-103.
[54] VALERA E, JAVIER R A, BARRANCO A, et al. Determination of atrazine residues in red wine samples. A conductimetric solution[J].Food Chemistry, 2010, 122(3): 888-894.
[55] 夏世钧, 孙金秀, 白喜耕, 等. 农药毒理学[M]. 北京: 化学化工出版社, 2008: 266-333.
[56] MAURIZ E, CALLE A. Real-time detection of chlorpyrifos at part per trillion levels in ground, surface and drinking water samples by a portable surface plasmon resonance immunosensor[J]. Analytica Chimica Acta, 2006, 561(1/2): 40-47.
[57] YANG G, WHITE I M, FAN X. An opto-fluidic ring resonator biosensor for the detection of organophosphorus pesticides[J]. Sensors and Actuators B: Chemical, 2008, 133(1): 105-122.
[58] KAUFIMAN B M, CLOWER M. Immunoassay of pesticides: an update[J]. Journal of AOAC International, 1995, 78(4): 1079-1090.
[59] REVOLTELLALR P, ROBBIOL L, LIEDBERG B. Comparison of conventional immunoassays (RIA, ELISA) with surface plasmon resonance for pesticide detection and monitoring[J]. Biotherapy, 1998, 11(2/3):135-145.
[60] GOBI K V, TANAKA H, SHOYAMA Y, et al. Highly sensitive regenerable immunosensor for label-free detection of 2,4-dichlorophenoxyacetic acid at ppb levels by using surface plasmon resonance imaging[J].Sensors and Actuators B: Chemical, 2005, 111/112: 562-571.
[61] KIM S J, GOBI K V, TANAKA H, et al. A simple and versatile selfassembled monolayer based surface plasmon resonance immunosensor for highly sensitive detection of 2,4-D from natural water resources[J].Sensors and Actuators B: Chemical, 2008, 130(1): 281-289.
[62] SOH N, TOKUDA T, WATANABE T, et al. A surface plasmon resonance immunosensor for detecting a dioxin precursor using a gold binding polypeptide[J]. Talanta, 2003, 60(4): 733-745.
[63] FARRE M, MARTINEZ E, RAMON J, et al. Part per trillion determination of atrazine in natural water samples by a surface plasmon resonance immunosensor[J]. Analytical and Bioanalytical Chemistry, 2007,388(1): 207-214.
[64] SASAKI S, NAGATA R, HOCK B, et al. Novel surface plasmon resonance sensor chip functionalized with organic silica compounds for antibody attachment[J]. Analytica Chimica Acta, 1998, 368(1/2): 71-76.
[65] STRACHAN G, GRANT S D, LEARMONTH D, et al. Binding characteristics of anti-atrazine monoclonal antibodies and their fragments synthesised in bacteria and plants[J]. Biosensors and Bioelectronics,1998, 13(6): 665-673.
[66] KUSHARYOTO W, PLEISS J, BACHMANN T T, et al. Mapping of a hapten-binding site: molecular modeling and site-directed mutagenesis study of an anti-atrazine antibody[J]. Protein Engineering, 2002, 15(3):233-241.
[67] NABOK A V, TSARGORODSKAYA A, HASSAN A K, et al. Total internal reflection ellipsometry and SPR detection of low molecular weight environmental toxins[J]. Applied Surface Science, 2005, 246(4):381-386.
[68] HARRIS R D, LUFF B J, WILKINSON J S, et al. Integrated optical surface plasmon resonance immunoprobe for simazine detection[J].Biosensors and Bioelectronics, 1999, 14(4): 377-386.
[69] MAURIZ E, CALLE A, MONTOYA A, et al. Determination of environmental organic pollutants with a portable optical immunosensor[J].Talanta, 2006, 69(2): 359-364.
[70] MAURIZ E, CALLE A, MANCLUS J J, et al. Optical immunosensor for fast and sensitive detection of DDT and related compounds in river water samples[J]. Biosensors and Bioelectronics, 2007, 22(7): 1410-1418.
[71] KEEGAN J, WHELAN M, DANAHER M, et al. Benzimidazole carbamate residues in milk: Detection by surface plasmon resonance-biosensor,using a modified QuEChERS (quick, easy, cheap, effective, rugged and safe) method for extraction[J]. Analytica Chimica Acta, 2009, 654(2):111-119.
[72] OBATAYA I, NAKAMURA C, ENOMOTO H, et al. Development of a herbicide biosensor using a peptide receptor screened from a combinatorial library[J]. Journal of Molecular Catalysis B: Enzymatic, 2004, 28(4/6):265-271.
[73] DEVLIN C M, BOWLES M R, GORDON R B, et al. Production of a paraquat-specific murine single chain Fv fragment[J]. J Biochem, 1995,118(3): 480-487.
[74] GUNNING R V, DANGG H T, KEMP F C, et al. New Resistance mechanism in Helicoverpa armigera threatens transgenic crops expressing Bacillus thuringiensis Cry1Ac toxin[J]. Applied and Environmental Microbiology, 2005, 71(5): 2558-2563.
[76] NANDURI V, BHUNIA A K, TU S I, et al. SPR biosensor for the detection of L. monocytogenes using phage-displayed antibody[J].Biosensors and Bioelectronics, 2007, 23(2): 248-252.
[77] CRISTINA G A, XAVIER M B, JENKINS A T A, et al. Surface plasmon resonance assay for real-time monitoring of somatic coliphages in wastewaters[J]. Applied and Environmental Microbiology, 2008, 74(13): 4054-4058.
Recent Advances in Application of Surface Plasmon Resonance in Determining Pesticide Residues
LIN Zhao,LIU Xia*,LI Ying
(Hunan Province Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Surface plasmon resonance (SPR) has been widely applied in various fields owing to its simplicity, low cost, no labeling, high selectivity, and real-time monitoring. SPR can be used not only for detecting analytes, but also determining kinetic parameters of molecular interactions. Interest in the development of SPR based immunosensors for the detection of low molecular weight pesticides in foods and environment has been rapidly increased over the last ten years. In this paper, the SPR principle and instrument types are briefly introduced. The category of recognized molecules immobilized on the SPR sensor surface, detection methods and their applications in pesticide detection are introduced emphatically. In addition, trends of SPR in the area of pesticide detection are also prospected.
surface plasmon resonance (SPR);sensor;pesticide;detection
TS207.53
A
1002-6630(2011)05-0342-09
2010-07-12
湖南省教育厅优秀青年项目(10B050);长沙市科技计划重点项目(K1005181-21);
湖南农业大学引进人才基金项目(08YJ07);湖南省研究生创新基金项目(CX2010B281)
林钊(1985—),男,硕士研究生,研究方向为食品安全与控制。E-mail:linq004@163.com
*通信作者:刘霞(1976—),女,副教授,博士,研究方向为食品生物技术与分析。E-mail:liuxia608@gmail.com

