乙烯利对香菇液体菌种菌丝体干重和胞外多糖得率的影响
王秀艳,田艳春
(赤峰学院 生命科学学院,内蒙古 赤峰 024000)
乙烯利对香菇液体菌种菌丝体干重和胞外多糖得率的影响
王秀艳,田艳春
(赤峰学院 生命科学学院,内蒙古 赤峰 024000)
在香菇液体培基中加入不同浓度乙烯利作为刺激因子,测量乙烯利对香菇菌丝体干重和胞外多糖含量的影响.实验表明乙烯利浓度在小于10ppm时对菌丝体干重及胞外多糖得率均有促进作用,并测出浓度为8ppm时作用最强.乙烯利浓度大于10ppm时有抑制作用,其中,当乙烯利浓度为8ppm时菌丝体干重最重、菌丝体胞外多糖得率最高.
香菇;乙烯利;菌丝体干重;胞外多糖
香菇(Flammulina velutipes)又称花蕈、香信、椎茸、冬菰、厚菇、花菇.在分类学上隶属真菌门,担子菌纲,伞菌目,口蘑科,香菇属,学名Lentinus edodes(Berk.)sing.
香菇子实体含大量的蛋白质,其中氨基酸多达18种,人体必需的氨基酸在香菇中就有7种,脂肪中含有大量的亚麻油酸,灰分中含有大量的钙、铁、锰等都是造血物质,营养价值很高.此外,香菇还有很好的药用价值,它能预防感冒和肝硬化,并有降低血压、减少胆固醇和增强人体对癌症的免疫力.香菇是人们重要的食用、药用菌和调味品.
乙烯利是一种用途很广的生长调节剂,容易被真菌吸收,乙烯利进入细胞后,逐渐分解释放出乙烯,能起到内源激素乙烯的生理作用,促进菌丝生长,本实验研究了不同浓度乙烯利对香菇液体菌种菌丝体干重、胞外多糖得率的影响,以期为生产合理添加有关营养成分,保证高产稳定提供参考.
1 材料与方法
1.1 实验材料
1.1.1 供试菌种:江苏省江都市天达食用菌研究所提供
1.1.2 实验药品:乙烯利
1.1.3 仪器:超净工作台、灭菌锅、水浴锅、愠温培养箱、723分光光度计、烘干箱
1.1.4 供试培养基
PDA培养基:马铃薯(去皮)200g、葡萄糖20g、琼脂20g、水1000mL
液体培养基:玉米粉3%、硫酸镁0.3%、磷酸二氢钾0.15%、维生素B1微量、蔗糖1%、玻璃珠10粒.
1.2 刺激因子(乙烯利)浓度设置为2ppm、4ppm、8ppm、10ppm、15ppm,以0ppm为参照,每组设4个重复.
1.3 实验方法
1.3.1 PDA培养基的制备灭菌及检测
选择质量较好的马铃薯(无病、未出芽、不干缩)洗净去皮,挖去芽眼,切成厚度均匀的薄片称取200g,加水1000mL,煮沸10—15min,至酥而不烂的程度,用6层纱布过滤一次,取其滤液,加入琼脂20g,用小火加热至琼脂全部溶解(加琼脂的过程中需边加边用玻璃棒搅拌),煮沸后加入葡萄糖20g,使药品全部溶解.制备好的培养基趁热分装到20mm×200mm的干燥试管中.一般装入量为试管总长度的1/5.分装时应尽量注意勿使培养基黏附在试管口壁上,如有黏附则应用干净纱布擦去,分装好的试管塞上棉塞,棉塞在试管内外的比例为2:1.
塞好棉塞的试管每10支捆成一捆,上面用二层报纸包扎好,以免灭菌时水蒸气浸湿棉塞.然后竖直放入高压锅内灭菌30min,灭菌压力1.47×105Pa,温度为 121℃.
灭菌后,待灭菌锅内的温度降到60℃时取出试管摆成斜面,以防止冷凝水积聚过多,斜面的长度以占试管总长度的3/4为宜.
灭菌后的斜面培养基,在使用前应进行无菌检测,即从制备的斜面培养基中随机抽取3-5支,置于30±1℃恒温培养箱中培养3d,如果3d后培养基表面光滑,无杂菌出现方可使用.
1.3.2 母种的扩繁及培养
转管扩大培养工作在紫外灯杀菌环境的无菌超净工作台中进行.接种前,将斜面培养基,接种工具,香菇母种,洒精灯,75%洒精棉等放入超净工作台,封闭进行紫外灯照射消毒30min,然后关闭紫外灯,打开吹风,进行扩繁.
首先将洗干净的双手伸入超净工作台中,用洒精棉擦拭双手和菌种试管外壁,点燃洒精灯,灼烧接种铲.然后,左手拿斜面试管和菌种管,用右手小拇指和无名指夹住试管的棉塞拔出,将灼烧的接种铲在火焰上方慢慢伸入母种试管中,待温度不能灼伤菌种时,铲出蚕豆大小的菌块,慢慢将菌种铲抽出,注意不要使菌种块及菌种铲碰到试管内壁,取出后不可使菌块通过火焰,迅速将接种铲在火焰旁伸进另一试管,将菌块放在培养基中部,菌丝朝上,慢慢抽出接种铲后,勿碰试管内壁,然后塞好棉塞,重复上述操作.将接好的试管放在恒温培养箱内24±1℃黑暗条件下培养7d左右,在此期间应每天观察一次,如有杂菌感染应及时将试管取出,以免污染其它菌种,待菌丝长满斜面,挑选菌丝生长健壮、洁白、浓密、均匀进行使用或保藏.
1.3.3 液体培养基的制备
首先按配方在70℃恒温水浴锅里乳化玉米粉,过滤后取其上清液粉状到250ml锥形瓶内,每瓶100ml,然后每瓶加入硫酸镁0.15g、磷酸二氢钾0.3g、维生素B15mg、蔗糖1g、玻璃珠10粒、最后用8层纱布封口,用报纸包好后与接种铲、镊子、小托盘一起放入灭菌锅内灭菌30min.
1.3.4 液体菌种接种、静置培养及摇床培养
首先将灭菌锅内的锥形瓶与接种铲、镊子、小托盘从灭菌锅内取出置于超净工作台内,筛选出几只长势较好的斜面菌种放入超净工作台内,紫外线灭菌30min.30min后关掉紫外灯,打开风机,洗净双手伸进超净工作台.用洒精棉球擦拭双手,点燃洒精灯.灼烧接种铲,边灼烧边伸入试管内,待接种铲冷却后,铲出面积为1.5cm2的菌块(尽量保持所有的菌块大小一致),用右手掀去锥形瓶纱布将菌块接入液体培养基内,保持菌丝朝上,封好棉塞,连续接种.将接好菌种的锥形瓶放入24±1℃恒温箱内,静置培养24h,然后置于摇床上振荡培养7d(培养条件:温度为24±1℃,转速为160R/min),在培养期间要每天观察1—2次,首先看是否有杂菌感染,其次是保持通风保证菌丝体有氧呼吸,最后观察菌丝球的生长状况,菌丝球分布均匀,菌液澄清,有菇香味为生长成熟,即制备好种子液,挑选优质的备用.
1.3.5 刺激因子(乙烯利)的添加
首先按1.3.3方法制备液体基础培养基,制备好后同优质种子液、乙烯利母液,移液枪等工具一同放入超净工作台,紫外灯灭菌30min.
然后向每个锥形瓶加入10ml种子液,用移液枪向锥形瓶中分别加入不同量的乙烯利母液.使其浓度分别为 2ppm、4ppm、8ppm、10ppm、15ppm,以0ppm为参照,每组设4个重复.
最后将接好种子液及乙烯利的锥形瓶封好口放至24±1℃,160rpm的摇床中培养.在培养期间每天观察2次,(如有污染,应及时处理)观察各锥形瓶中菌种的长势,培养3-4d待液体菌种菌丝球成熟,胞外液澄清,有淡淡的菇香味关闭摇床.
1.3.6 菌丝体干重的测定
用6层纱布过滤,将过滤的菌丝球放入烘干箱,60℃烘干至恒重,测其干重,并胞外液放入4℃冰箱中保存1-2d,以待进行胞外多糖测定.
1.3.7 胞外多糖的测定
1.3.7.1 标准曲线的绘制
采用苯酚-硫酸法测胞外多糖,准确称取烘干后的葡萄糖0.1g,用去离子水定容到100mL的容量瓶中,其葡萄糖浓度为1mg/mL.准确称取苯酚9g,加54mL去离子水,得浓度为15%的苯酚溶液.取9支试管,1支为空白对照管,另外选取8个浓度的葡萄糖溶液来做平行实验,分别加入葡萄糖0μL,160μL,180μL,200μL,220μL,240μL,260μL,280μL,300μL,再分别加蒸馏水 2.0mL,1.84mL,1.82mL,1.80mL,1.78mL,1.76mL,1.74mL,1.72mL,1.70mL,每管中再加入15%的苯酚1mL,振荡,摇匀,再加入5mL浓硫酸,迅速振荡摇匀.(具体的药品添加量见表1).置25℃水浴锅中保温20min,取出,于490nm光下测定其光吸收值(见表2所测结果).以葡萄糖浓度作为横坐标,以光吸收值作为纵坐标,绘制标准曲线(见图1).
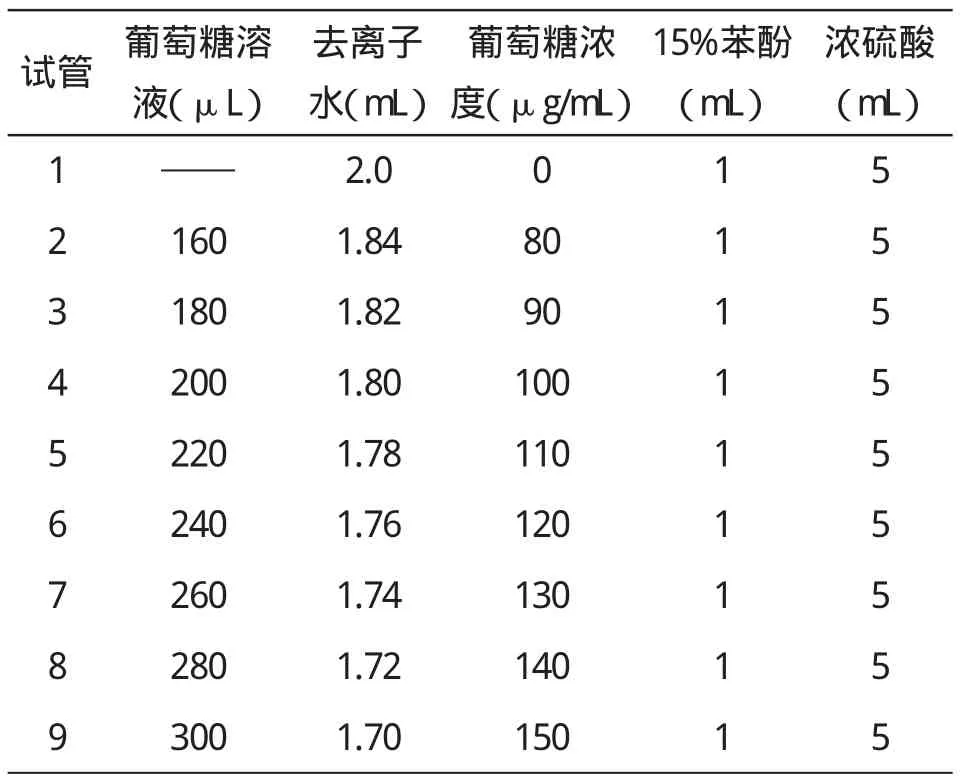
表1 绘制标准曲线所加药品列表
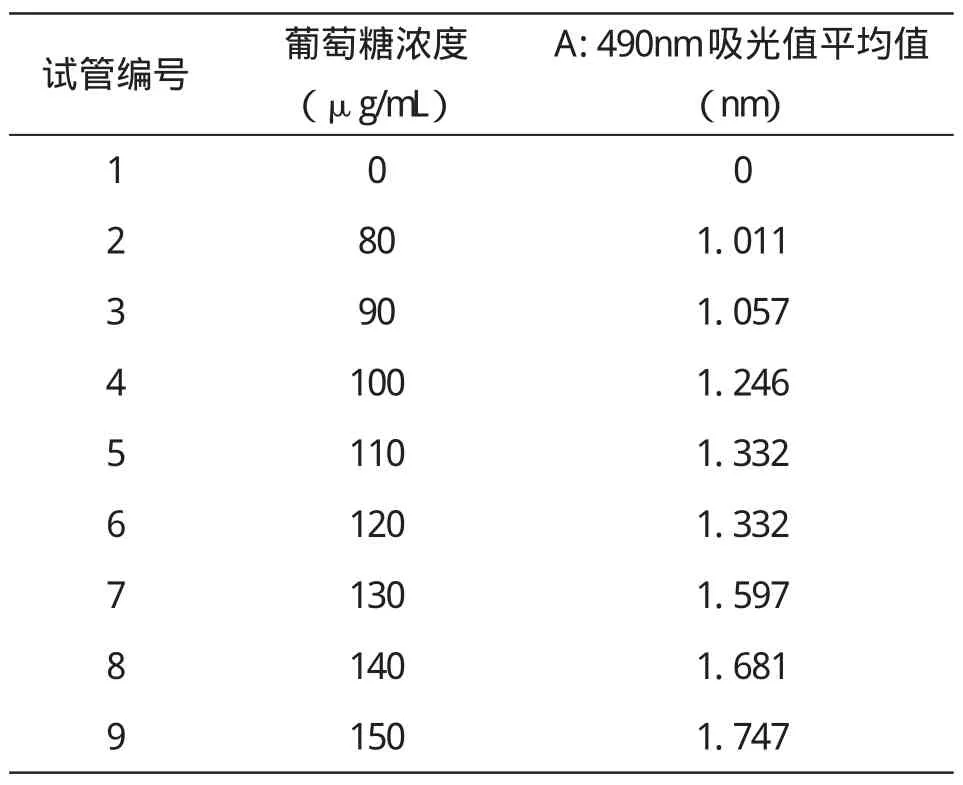
表2 490nm处测定不同葡萄糖浓度吸光值结果
1.3.7.3 样品多糖含量的测定
取样品液稀释500倍,即用移液枪吸取20μL样品液,加入9.98mL去离子水,稀释后的样品体积为10mL,五个小组各取稀释后的样品液2mL,各加入1mL的15%的苯酚,5mL的浓硫酸,振荡混匀后,在25℃的水浴箱中保温20min,取出后,于490nm处测定吸光值.吸取一定量的试管中的液体于石英杯中,保证透光面干净,外表面无液体,按顺序放入暗槽中进行测量.每一样品的OD值都按上述步骤操作,用标准曲线计算其多糖含量.每管两次,取平均值以保证其准确性.
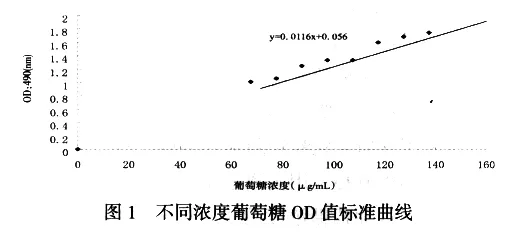
根据葡萄糖标准曲线得出所得同线的方程表达式y=0.0116x+0.056,又表3所得出的样品光吸收值可以求出样品中葡萄糖得率,如表4所示.
2 结果与分析
2.1 不同浓度乙烯利对菌丝体干重的影响

表3 样品光吸收值的测定结果
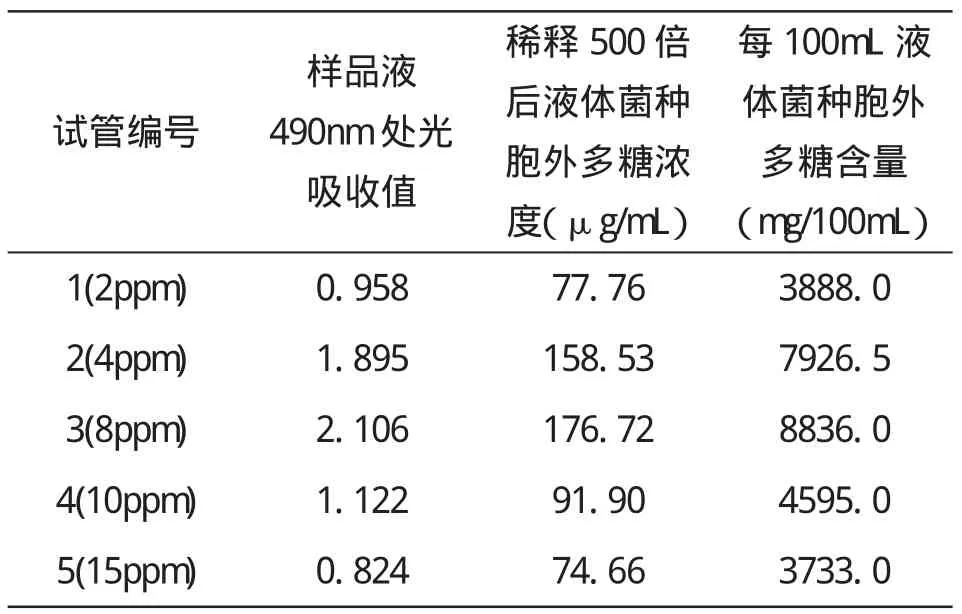
表4 由标准曲线所得样品中葡萄糖得率
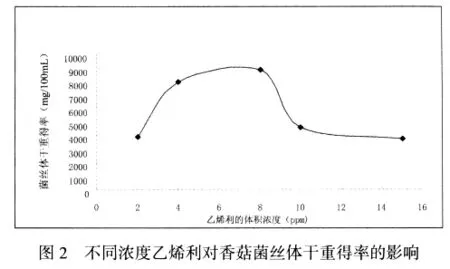
由图2分析可知,香菇菌丝体在乙烯利浓度为2—8ppm的范围内均能生长.当乙烯利浓度在2—10ppm之间时对菌丝体生长均有促进作用,在该浓度范围内随着乙烯利浓度的增高菌丝体干重得率增加,二者呈正相关,且在浓度为8ppm时菌丝体干重得率最大,较其它处理相比,菌丝体干重得率达到了极显著的水平,菌丝体长势良好,菌丝球洁白,分枝均匀、浓密、粗壮.当乙烯利浓度在8—10ppm之间时,对菌丝体生长也有促进作用,但二者呈负相关.当乙烯利浓度大于8ppm,随着乙烯利浓度的增加菌丝体干重得率减小,即菌丝体生长受到抑制.
2.2 不同浓度乙烯利对香菇菌丝体胞外多糖得率的影响
由图3分析可知,当乙烯利浓度在2—8ppm之间时胞外多糖含量随着乙烯利浓度的增加不断的升高,二者呈正相关,且在乙烯利浓度为8ppm时,胞外多糖含量达到峰值;当乙烯利浓度在8—10ppm之间时,对菌丝体生长也有促进作用,但二者呈负相关.当乙烯利浓度大于10ppm时胞外多糖的含量随乙烯利浓度的增加不断下降.
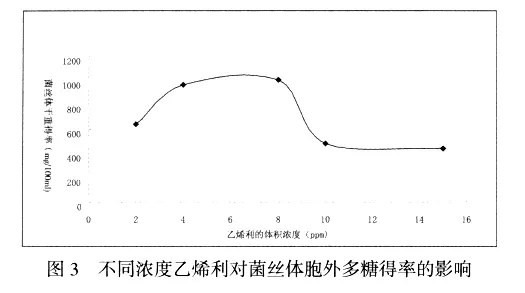
由图2、3共同分析可知,乙烯利浓度对菌丝体干重和胞外多糖得率的影响图示趋势基本一致.当乙烯利浓度在2—10ppm之间时对菌丝体干重得率和胞外多糖得率均有促进作用,即该乙烯利浓度范围内对菌丝体生长有促进作用,且二者均在乙烯利浓度为8ppm时达到峰值.乙烯利浓度大于10ppm之后时菌丝体干重得率和胞外多糖得率均随乙烯利浓度增加而降低,即超出该乙烯利浓度范围内对菌丝体生长有抑制作用.
3 结论
3.1 在培养基中加入同体积不同浓度的乙烯利对香菇菌丝体生长均有不同程度的影响.
3.2 当乙烯利浓度为8ppm时,菌丝体干重得率和胞外多糖得率均达到峰值.
3.3 刺激因子乙烯利在2—8ppm范围内与香菇菌丝体干重得率和胞外多糖得率呈正相关,即随乙烯利浓度的升高香菇菌丝体干重和胞外多糖含量增加.
3.4 刺激因子乙烯利在8—10ppm范围内与香菇菌丝体干重得率呈负相关,在大于10ppm之后对菌丝体生长有抑制作用.在8—10ppm范围内与香菇菌丝体胞外多糖得率呈负相关,大于10ppm之后对菌丝体生长有抑制作用.
由以上分析可知,当香菇液体培养基中加入体积浓度为8ppm的乙烯利时对菌丝体干重和胞外多糖含量影响最明显,同时菌丝体干重得率和胞外多糖得率达到峰值.这些应用到具体的生产实践中可以提高香菇的产量,对香菇液体产品开发和利用具有重要意义.因此,在实际生产中可通过调节乙烯利浓度指导生产,促进稳定高产.
〔1〕王桂芹,王秀艳.食用菌栽培[M].呼和浩特:内蒙古科技技术出版社,2001.
〔2〕卯晓岚.中国大型真菌[M].郑州:河南科学技术出版社,2000.
〔3〕黄清荣,姜华,董洪新,刘林德,贾莉.榆黄菇发酵菌丝体及胞外多糖的影响因子的研究[J].安徽农业科学,2006,34(22):5792-5793.
〔4〕卢青达,马启明.食用菌[M].济南:山东科技出版社,1986.
〔5〕贡济宇.苯酚硫酸法测定灵芝多糖含量的研究[J].长春中医学院学报,1997(2):82—86.
〔6〕张桂春,辛小林,李绍龙.榆黄菇发酵全液多糖提取工艺优化[J].食用菌,2005(4):62—64.
〔7〕王谦,张俊刚,郝利民,等.黄伞深层液体发酵条件的优化研究[J].食品工业科技,2004(25):498—499.
〔8〕Solomko EF.Eliseera GS,Biosynthesis of Bvitam ins by the hroom Pluertus sdtreatrs in the submerged culture:peikl Bim ikroviol.1998,24(2):164-169.
S646.1
A
1673-260X(2011)11-0144-04

