雷帕霉素协同去甲氧柔红霉素诱导人急性T淋巴细胞白血病Jurkat细胞株凋亡的作用
赵妍敏,吴康妮,王颖佳,吴功强,曹伟杰,于晓红,黄 河
(浙江大学医学院附属第一医院骨髓移植中心,浙江杭州310003)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,Akt/mTOR)信号通路调节异常与白血病等多种肿瘤形成、细胞恶性转化相关。Akt/mTOR在大部分急性髓系白血病细胞中存在组成性活化,mTOR上游蛋白Akt和下游蛋白4E-BP1、S6K均处于持续磷酸化状态。在慢性粒细胞白血病和急性淋巴细胞白血病细胞中也证实了mTOR信号通路的过度激活。mTOR信号转导通路的异常激活不仅参与白血病细胞的增殖、存活、代谢、细胞周期调控和葡萄糖转运等过程,而且可能与白血病对化疗药物的耐药相关。
急性T淋巴细胞白血病(T cell acute lymphoblastic leukemia,T-ALL)是一种恶性程度高、预后差的淋巴系统恶性克隆性疾病。近年来随着大剂量联合化疗方案的应用,T-ALL的预后有了较大改善,但仍有部分T-ALL患者对标准治疗耐药,出现难治或复发。蒽环类药物是治疗T-ALL诱导缓解方案的常用药物,对蒽环类药物信号通路的研究发现,其在引起细胞凋亡的同时,可激活Akt/mTOR和Raf/MEK/ERK等的信号通路,因而容易产生耐药[1-4]。
联合新型分子靶向治疗能克服化疗耐药、提高疗效,是近年来研究的热点。我们前期研究表明,mTOR抑制剂雷帕霉素(rapamycin,Rapa)在T-ALL细胞中能有效地抑制PI3K/Akt/mTOR信号通路,并呈时间、浓度依赖地抑制细胞生长[5]。基于这些理论,我们拟研究雷帕霉素联用蒽环类代表药物去甲氧柔红霉素(idarubicin,IDA)治疗T-ALL的可能性,是否有助于克服T-ALL的耐药及其机制。
1 材料与方法
1.1 细胞株 急性T淋巴细胞白血病细胞株Jurkat由中科院上海细胞所引进。
1.2 主要试剂 雷帕霉素购于Sigma公司,以DMSO溶解,配成浓度为1 mmol/L贮存液,分装后-20℃贮存。IDA由辉瑞公司惠赠,以PBS溶解,配成浓度为5 μmol/L的贮存液,分装后-20℃贮存。贮存液于临用前再稀释至合适浓度,本实验DMSO终浓度不超过0.5%。CCK-8购于日本Dojindo公司。Annexin V/PI凋亡检测试剂盒购于美国BD-Pharmingin公司。Caspase3、Caspase9、Caspase8、PARP、Akt、p-Akt、P70S6K、p-P70S6K、ERK 和 p-ERK 抗体购于美国Cell Signaling Technology公司;Actin和GAPDH抗体购于Santa Cruz公司;辣根标记山羊抗兔、山羊抗鼠IgG(H+L)购于北京中山生物技术公司。
1.3 细胞培养 Jurkat细胞采用含10%FBS的RPMI 1640培养液,在37℃、5%CO2、饱和湿度培养箱中培养,2~3 d换液传代1次。取对数生长期细胞为实验对象。
1.4 CCK-8法检测细胞增殖 选择对数生长期Jurkat细胞,接种于96孔板,各孔总体积200 μl,含有4×104个细胞,分别加入不同终浓度(0、1、2.5、5、10、25 和 50 nmol/L)的 IDA 或不同终浓度的IDA联合10 nmol/L雷帕霉素,培养24 h,同时设定对照组,每组设4个复孔。到达时点后,加入CCK-8 10 μl/孔,继续培养4 h,于酶标仪450/630 nmol/L双波长测定吸光度A值。按以下公式计算细胞生长抑制率:细胞生长抑制率=(对照组A值-实验组A值)/对照组A值×100%,并计算半数抑制浓度(50%inhibition concentration,IC50)剂量。
1.5 Isobologram法分析两药联合作用的性质
将单用雷帕霉素或IDA的IC50为横纵坐标末端点,以直线相连;将联用雷帕霉素和IDA使细胞生长抑制率为50%的不同剂量为横纵坐标描点。若联合用药点在直线之下表示联合指数(combination index,CI)小于1,两药联合有协同作用;在直线上表示联合指数等于1,两药联合有相加作用;在直线之上表明联合指数大于1,两药联合有拮抗作用[6]。
1.6 透射电镜形态学观察 收集细胞,以PBS洗涤2次,1 000 r/min离心,沿管壁逐滴加入3%戊二醛固定,包埋切片后,定位观察并照相。
1.7 流式细胞仪检测细胞凋亡 参照Annexin V/PI细胞凋亡检测试剂盒说明书操作。细胞以5×105/ml接种于6孔培养板,并以单药及联合用药处理细胞。选取单药24 h生长抑制率小于20%的浓度,因此选取IDA 5 nmol/L、雷帕霉素10 nmol/L浓度处理细胞。同时,设DMSO对照组,24 h后收获细胞。收集1×106个细胞,冷 PBS洗涤2次,1 000 r/min离心,4℃ 7 min,弃上清。将细胞重悬于1 ml 1×Binding buffer,取 100 μl细胞置于流式细胞仪专用试管中,加 5 μl Annexin V FITC 和 5 μl PI,轻轻混匀,避光室温反应15 min,加入300 μl 1×Binding buffer,立即用流式细胞仪检测,Cellquest 1.2分析软件分析结果。
1.8 免疫印迹实验 药物处理剂量同上。即收集经IDA 5 nmol/L、雷帕霉素10 nmol/L、IDA 5 nmol/L联合雷帕霉素10 nmol/L处理24 h细胞及对照组细胞,提取总蛋白,采用Brad-ford法检测蛋白浓度。将50 g蛋白经10% ~12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后,转移至PVDF膜,于摇床上封闭2 h,然后分别加入单克隆抗 Caspase3、PARP、Caspase8、Caspase9、Akt、pAkt、P85S6K、p-P85S6K 、P70S6K、p-P70S6K、ERK、p-ERK 一抗,4 C过夜,TBS/T充分漂洗。加入辣根过氧化物酶连接的二抗,室温孵育1.5 h,同上漂洗,与ECL化学发光试剂反应1 min,常规方法显影、定影。以Quality One软件计算蛋白产物条带的相对光密度值。
1.9 统计分析方法 采用SPSS 12统计处理软件分析,计量资料实验数据以均数±标准差(±s)表示。多组资料均数之间的比较采用One way ANOVA,两两比较采用 SNK-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 雷帕霉素联合IDA对Jurkat细胞株的增殖抑制作用 CCK8法检测发现IDA作用Jurkat细胞24 h的IC50为21.8 nmol/L,雷帕霉素作用Jurkat细胞24 h的IC50为344 nmol/L,联合10 nmol/L的雷帕霉素能使IDA的IC50降至 2.95 nmol/L。单用 1 nmol/L、2.5 nmol/L、5 nmol/L的IDA作用Jurkat细胞24 h的增殖抑制率分别为(4.06±4.3)%、(4.25±1.48)%、(19.72±13.06)%,而与10 nmol/L雷帕霉素联用后,增殖抑制率分别增加为(36.73±10.19)%、(38±11.08)%、(55.37±16.3)%(图1-A)。
按Isobologram方法[6]得出两药的联合指数小于1,说明两药对Jurkat细胞株的增殖抑制具有协同效应(图1-B)。
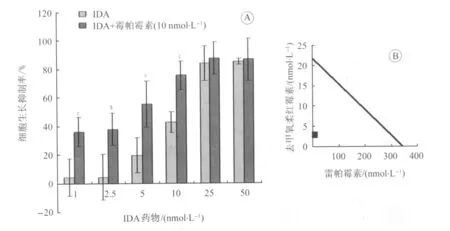
图1 IDA单用及联用雷帕霉素作用Jurkat细胞24 h的生长抑制作用Fig.1 Inhibition rate of Jurkat cell viability exposed to IDA or IDA+rapamycin for 24 hours
2.2 雷帕霉素增强IDA对Jurkat细胞株的诱导凋亡作用
2.2.1 形态学观察 光镜下观察未经处理的Jurkat细胞呈现圆形或椭圆形,大小均一,部分成团生长,折光度强;经低浓度IDA处理的细胞形态上无明显差异,少部分出现体积减小;经10 nmol/L雷帕霉素联合低浓度IDA处理24 h的细胞出现明显的空泡化、体积缩小变形,折光度降低,并有较多的细胞碎片。采用电镜进一步观察,发现未经处理和单用低浓度IDA处理的细胞体积均较大,核仁明显,染色质疏松;经IDA和雷帕霉素联用处理后体积变小,胞核固缩不规则,染色质浓缩边集,胞核成半月形(图2)。

图2 IDA单用及联用雷帕霉素作用Jurkat细胞24 h的电镜观察Fig.2 Morphological changes of Jurkat cells exposed to IDA or IDA+rapamycin for 24 hours under electron microscope
2.2.2 PS转位分析 Annexin VFITC和PI双标记细胞后经流式细胞仪检测结果显示,10 nmol/L雷帕霉素、5 nmol/L IDA及5 nmol/L IDA+10 nmol/L雷帕霉素作用于Jurkat细胞24 h,凋亡细胞百分数分别为(7.21±2.63)%、(17.51±3.20)%、(50.17±5.19)%,与空白对照组(6.78±2.17)%相比,IDA组及IDA+雷帕霉素组的凋亡细胞百分数均有升高(P<0.01),而IDA+雷帕霉素组较IDA组的凋亡细胞百分数显著升高(P<0.01,图3)。说明雷帕霉素单药虽不能引起Jurkat细胞发生明显的凋亡,但可增强IDA诱导凋亡的作用。
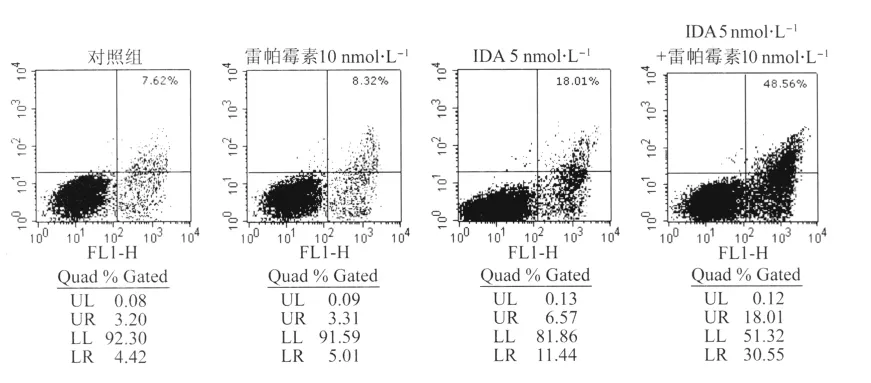
图3 IDA单用及联用雷帕霉素作用Jurkat细胞24 h的凋亡比例Fig.3 Apoptosis in Jurkat cells after treatment of IDA and/or rapamycin for 24 hours using Annexin V/PI staining method
2.3 Caspase3、8、9及 PARP活性的分析 分别以 10 nmol/L雷帕霉素、5 nmol/L IDA、5 nmol/L IDA+10 nmol/L雷帕霉素处理Jurkat细胞24 h,经Western blot检测可见IDA单用组Caspase3、Caspase9、PARP激活带不明显,Caspase8激活带较弱,而联用组出现明显的Caspase3、8、9 和 PARP 激活带(图4)。
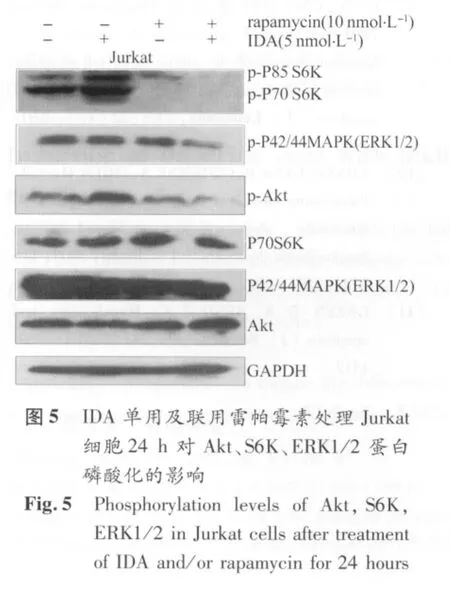
2.4 雷帕霉素联合IDA对Jurkat细胞株的Akt/mTOR、ERK信号通路的影响 本实验在Jurkat细胞株中检测了IDA对Akt/mTOR、ERK信号通路的活化状态的影响。结果发现5 nmol/L IDA明显促进Jurkat细胞S6K的磷酸化,且增强Akt的磷酸化,明确了IDA对Akt/mTOR信号通路活化的作用,而联用10nmol/L雷帕霉素能使Jurkat细胞株P70S6K和Akt磷酸化水平明显降低。此外,单用5nmol/L IDA或10nmol/L雷帕霉素对ERK的磷酸化均无明显影响,但两药一旦联用,则能协同下调ERK的磷酸化水平(图5、表1)。说明两药联用能通过抑制Akt/mTOR、ERK信号通路而发挥抗T-ALL作用。
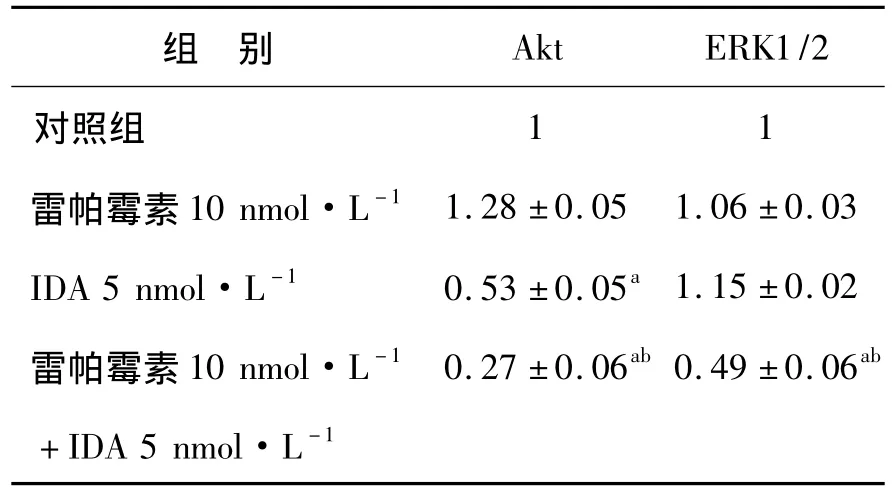
表1 IDA单用及联用雷帕霉素处理Jurkat细胞24 h磷酸化Akt、ERK1/2蛋白的半定量表达Table 1 Semi-quantitation of phosphorylation levels of Akt and ERK1/2 in Jurkat cells after treatment of IDA and/or rapamycin for 24 hours

3 讨论
近年来研究发现,雷帕霉素可与传统化疗药物存在着协同作用。在多发性骨髓瘤中,雷帕霉素能够协同地塞米松引起细胞凋亡[7-8];NPM-ALK阳性的间变性大细胞淋巴瘤易产生地塞米松的耐药,而雷帕霉素能克服其耐药并增强了地塞米松诱导凋亡的作用[9];在B-ALL的非肥胖性糖尿病/重度联合免疫缺(NOD/SCID)小鼠模型中,雷帕霉素的衍生物RAD001与长春新碱联用,可明显延长小鼠的生存时间[10]。
本研究经CCK-8实验证实,低浓度的雷帕霉素能显著增强IDA对Jurkat细胞的增殖抑制作用。IDA与雷帕霉素两者联用时能明显抑制细胞的增殖,联合指数小于1。但这种协同作用主要发生在IDA浓度较低时,当IDA剂量超过半数抑制浓度后,两者联合用药几乎没有作用,这提示低浓度雷帕霉素与小剂量IDA联用,有助于提高疗效,减低IDA的毒副反应。
本研究利用AV/PI染色流式细胞仪检测发现,虽然单用雷帕霉素不能引起Jurkat细胞明显凋亡,但能显著增强IDA的诱导凋亡作用;电镜形态学观察也证实了雷帕霉素对IDA诱导凋亡的增强作用。
细胞凋亡是多细胞生物体内的一个重要生命现象,胱天蛋白酶Caspases被认为是凋亡的中心实施者。依据凋亡信号起源的不同,细胞凋亡的Caspase通路分为细胞外(死亡受体)和细胞内(线粒体)通路。细胞色素C的释放可以启动Caspase的细胞内通路(线粒体途径)。细胞色素C一旦释放即与细胞凋亡蛋白酶活化因子-l(Apaf-1)结合,活化Caspase9,继而激活下游 Caspase3和 Caspase7,诱导细胞凋亡[11]。Caspase的细胞外通路(细胞膜途径)是由Fas/FasL信号或TNF/TNFR-1信号启动,通过胞质中Fas相关死亡域(FADD)与Caspase8结合,使Caspase8自身裂解而活化,然后激活下游的Caspase3导致细胞凋亡。
在本实验中,IDA联用雷帕霉素较IDA单用更显著地激活了Caspase3和底物聚腺苷酸二磷酸核糖转移酶PARP(poly ADP-ribosepolymerase),再一次证实了雷帕霉素对IDA引起凋亡的增敏作用。而Caspase8和Caspase9在两药联用组都呈现出最明显的激活,这说明两药联用后是通过细胞膜和线粒体双途径影响细胞凋亡的。
既往研究认为,蒽环类药物在某些实体肿瘤中可激活Akt/mTOR和MAPK/ERK信号通路而产生耐药性。与Akt/mTOR信号类似,MAPK/ERK信号的异常激活也常与白血病细胞的增殖和耐药相关[1-4]。本实验在Jurkat细胞株中检测了IDA对Akt/mTOR和ERK信号通路的活化状态的影响,结果发现IDA能促进Akt和S6K蛋白的磷酸化,明确了IDA对Akt/mTOR信号通路活化的作用,而联用雷帕霉素能使P70S6K和Akt酸化水平明显降低。此外,单用小剂量的IDA和雷帕霉素对ERK的磷酸化均无明显影响,但两药一旦联用,则能协同下调ERK的磷酸化水平。这说明两药联用能通过抑制Akt/mTOR、ERK信号通路而发挥抗T-ALL作用。
本研究证实,雷帕霉素和IDA对 T-ALL Jurkat细胞的生长抑制具有协同作用。两药联用时能通过线粒体和细胞膜双途径增强凋亡效应。此外,雷帕霉素能逆转IDA引起的Akt/mTOR信号通路的激活,并协同抑制ERK信号的活化,为临床上两药的联用提供了体外实验证据。
[1]LAURENT G,JAFFREZOU J P.Signaling pathways activated by daunorubicin [J].Blood,2001,98:913-924.
[2]YU H G,AI Y W,YU L L,et al.Phosphoinositide 3-kinase/Akt pathway plays an important role in chemoresistance ofgastric cancercellsagainst etoposide and doxorubicin induced cell death [J].Int J Cancer,2008,122(2):433-443.
[3]MCCUBREY J A,ABRAMS S L,LIGRESTI G,et al.Involvement of p53 and Raf/MEK/ERK pathways in hematopoietic drug resistance.[J].Leukemia,2008,22(11):2080-2090.
[4]GARCIA M G,ALANIZ L D,CORDO RUSSO R I,et al.PI3K/Akt inhibition modulates multidrug resistance and activatesNF-kappaB in murine lymphoma cell lines[J].Leuk Res,2009,33(2):288-296.
[5]ZHAO Y M,ZHOU Q,XU Y,et al.Antiproliferative effect of rapamycin on human T-cell leukemia cell line Jurkat by cell cycle arrest and telomerase inhibition[J].Acta Pharmacol Sin,2008,29(4):481-488.
[6]SCHRAPPE M,CAMITTA B,PUI C H,et al.Longterm results of large prospective trials in childhood acute lymphoblastic leukemia [J].Leukemia,2000,14(12):2193-2194.
[7]YAN H,FROST P,SHI Y,et al.Mechanism by which mammalian target of rapamycin inhibitors sensitize multiple myeloma cells to dexamethasoneinduced apoptosis[J].Cancer Res,2006,66(4):2305-2313.
[8]STRÖMBERG T,DIMBERG A,HAMMARBERG A,et al.Rapamycin sensitizes multiple myeloma cells to apoptosis induced by dexamethasone[J].Blood,2004,103(8):3138-3147.
[9]GU L,GAO J,LI Q,et al.Rapamycin reverses NPM-ALK-induced glucocorticoid resistance in lymphoid tumor cells by inhibiting mTOR signaling pathway,enhancing G1 cellcycle arrestand apoptosis[J].Leukemia,2008,22(11):2091-2196.
[10]CRAZZOLARA R,CISTERNE A,THIEN M,et al.Potentiating effects of RAD001(Everolimus)on vincristine therapy in childhood acute lymphoblastic leukemia [J].Blood,2009,113(14):3297-3306.
[11]GREEN D R,REED J C.Mitochondria and apoptosis[J].Science,1998,281(5381):1309-1312.
——雷帕霉素

