中间水分食品体系中乳球蛋白糖基化位点的鉴定
余园芳,陶冠军,刘小鸣,周 鹏
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
中间水分食品体系中乳球蛋白糖基化位点的鉴定
余园芳,陶冠军,刘小鸣,周 鹏﹡
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
在中间水分食品体系中,乳球蛋白很容易与葡萄糖等还原糖发生美拉德反应,使食品的色泽、风味和质构等发生变化。为了深入理解中间水分食品在贮藏过程中蛋白发生的糖基化修饰,电喷雾飞行时间质谱(ESI-TOF/MS)被用来分析蛋白经胰蛋白酶水解后的肽段,以便鉴定乳球蛋白与葡萄糖在45℃下贮藏2d后的糖基化位点。结果显示,乳球蛋白上被糖基化的氨基酸残基有L1、K47、K70、K77、K83、K91、K100和K135。
乳球蛋白,葡萄糖,糖基化反应,糖基化位点
中间水分食品通常是指水分活度在0.5~0.9之间的一类食品[1]。乳清蛋白是高蛋白中间水分食品中常用的蛋白源,其赖氨酸(Lys)含量高,所以它很容易与葡萄糖等还原糖发生美拉德反应,使食品的色泽、风味和质构等品质变差。因此,研究食品蛋白的糖基化修饰对于深入理解食品在加工和贮存过程中的物理化学变化及食品的稳定性尤为重要。文献中报道的主要是对较高程度的美拉德反应的研究,而对反应初期蛋白糖基化修饰的研究比较少。糖基化反应通常是指美拉德反应的初期[2],测定蛋白糖基化反应常见的方法有HPLC法测糠氨酸的含量[3],酶解比色法[4]和邻苯二甲醛法(OPA法)测定游离赖氨酸的含量[5-6]等。但这些方法只能评价较高程度的美拉德反应,不能鉴定出反应初期蛋白上哪些氨基酸残基被修饰了。质谱技术分析时间短[6],灵敏度高,因此逐渐被用来评价和描述蛋白糖基化反应,获得关于糖基化反应的更加准确和详细的信息。软离子化技术,例如电喷雾质谱(ESI-MS)和基质辅助激光解析质谱(MALDI-MS),结合酶解可以检测蛋白的糖基化位点[7-12],为研究糖基化修饰对食品蛋白物化性质的变化和延长食品保质期提供理论基础。本实验用胰蛋白酶水解蛋白,再用LC-ESIMS分析酶解后得到的肽段,来鉴定乳球蛋白的糖基化位点。
1 材料与方法
1.1 材料与仪器
乳球蛋白(LG) BioPURE,DaviscoFoods International,Inc.;葡萄糖 分析纯,国药集团化学试剂有限公司;胰蛋白酶(TPCK-treated trypsin,from bovine pancreas) 酶活力≥10,000 BAEE units/mg,Sigma公司;乙腈、甲酸 色谱纯,国药集团化学试剂有限公司。
高效十点磁力搅拌器 德国IKA公司;SHP-250生化培养箱 上海森信实验仪器有限公司;水分活度密闭容器(Plastic water activity sample cup) 美国Decagon公司;封口膜(Parafilm) 美国Pechiney Plastic Packaging公司;Hygrolab 2/3四通道台式水分活度仪 瑞士Novasina公司;透析袋(截留分子量7K) 美国联合碳化物公司;Platform ZMD 4000液相色谱-质谱联用仪 美国Waters公司。
1.2 实验方法
1.2.1 中间水分食品模型体系的制备 将葡萄糖溶解于水,加入甘油,搅拌均匀。再加入乳球蛋白粉,用手混合,揉成均匀的面团。放入水分活度密闭容器中,用封口膜密封,以防止水分丢失。将样品在室温下平衡2h,测定水分活度。测得体系的水分活度为0.54,处于中间水分食品体系的水分活度范围内。最后,将样品置于装有Mg(NO3)2过饱和溶液的干燥器(水分活度为0.529)中,放入恒温生化培养箱中,45℃下贮藏。模型体系的配方见表1。

表1 模型体系配方
1.2.2 乳清蛋白糖基化位点的鉴定 用电喷雾飞行时间质谱(ESI-TOF/MS)分析45℃下贮藏2d的样品,用0d的样品作对照。
取50mg蛋白面团,加到22.5mL超纯水中,室温下磁力搅拌1h,转速400r/min。量取12mL蛋白液到透析袋中,4℃下用超纯水透析。隔8h换一次水,共换两次。用0.05mol/L NH4OH将透析液的pH调至8.0,加入12μL胰蛋白酶(1mg/mL),37℃恒温水浴振荡16h,用0.05mol/L HCl调pH至低于2来终止酶解。将酶解液过0.45μm的滤膜,滤液直接用LC-MS分析。
用MassLynx V4.1(美国Waters公司)和ProteinLynx Global server 2.3(美国Waters公司)分析图谱。
1.3 液相色谱-质谱条件
1.3.1 色谱条件色谱柱:BEH C18(2.1×100mm);柱温:45℃;检测器:WATERS ACQUITY PDA;流动相:A液是100%的乙腈,B液是0.1%的甲酸溶液;洗脱梯度:100%B(0min)→60%B(30min)→0%B(50~55min);流速:300μL/min;进样量:2μL。
1.3.2 质谱条件 离子化方式:ESI,正离子模式;毛细管电压:2.0kV;锥孔电压:30V;离子源温度:100℃;脱溶剂气温度:250℃;质量扫描范围m/z:600~3000。
2 结果与讨论
用ProteinLynx软件在SWISSPROT-1.0数据库中搜索没有被糖基化的肽段(见表2)。
观察总离子流色谱图(见图1)发现,与对照组(0d的样品)相比,样品组的总离子流图中有的峰信号强度降低或消失,同时有新的峰出现。这些强度降低或消失的峰对应的肽段可能被糖基化了,而新出现的峰则可能是糖基化的肽段。以肽段1~8(图1,峰6)为例,其信号强度从0d的2.35e3降至2d的83.8,面积从1120降至39。1~8糖基化后的肽段(图1,峰B)信号强度为389,峰面积为172。另外,糖基化的肽段的质量数比理论肽段的大162n(n为整数)。在对照组[图2(1)]中,主要是肽段1~8的质谱峰(933.7603和467.3648),而对于2d的样品[图2(2)],还出现了m/z=1095.8567(z=1)和m/z=548.4205(z=2)的峰。1095.8567比933.7603大162,548.4205比467.3648大81,所以,1095.8567和548.4205应该是葡萄糖化后的肽段1~8,再次证明肽段1~8被糖基化了。乳清蛋白的糖基化位点主要是Lys残基,N末端氨基酸残基,也有少数几个Arg残基[13]。每个糖基化的肽段中存在2个可能的糖基化位点。以肽段70~75为例,它含有70位和75位Lys。胰蛋白酶特异性地切除Lys(K)和Arg羧基端的肽键,由于K75的羧基端被断开了,而Lys残基被糖基化后其羧基端是不会被切开的,所以K75没有被糖基化,K70是糖基化的氨基酸。
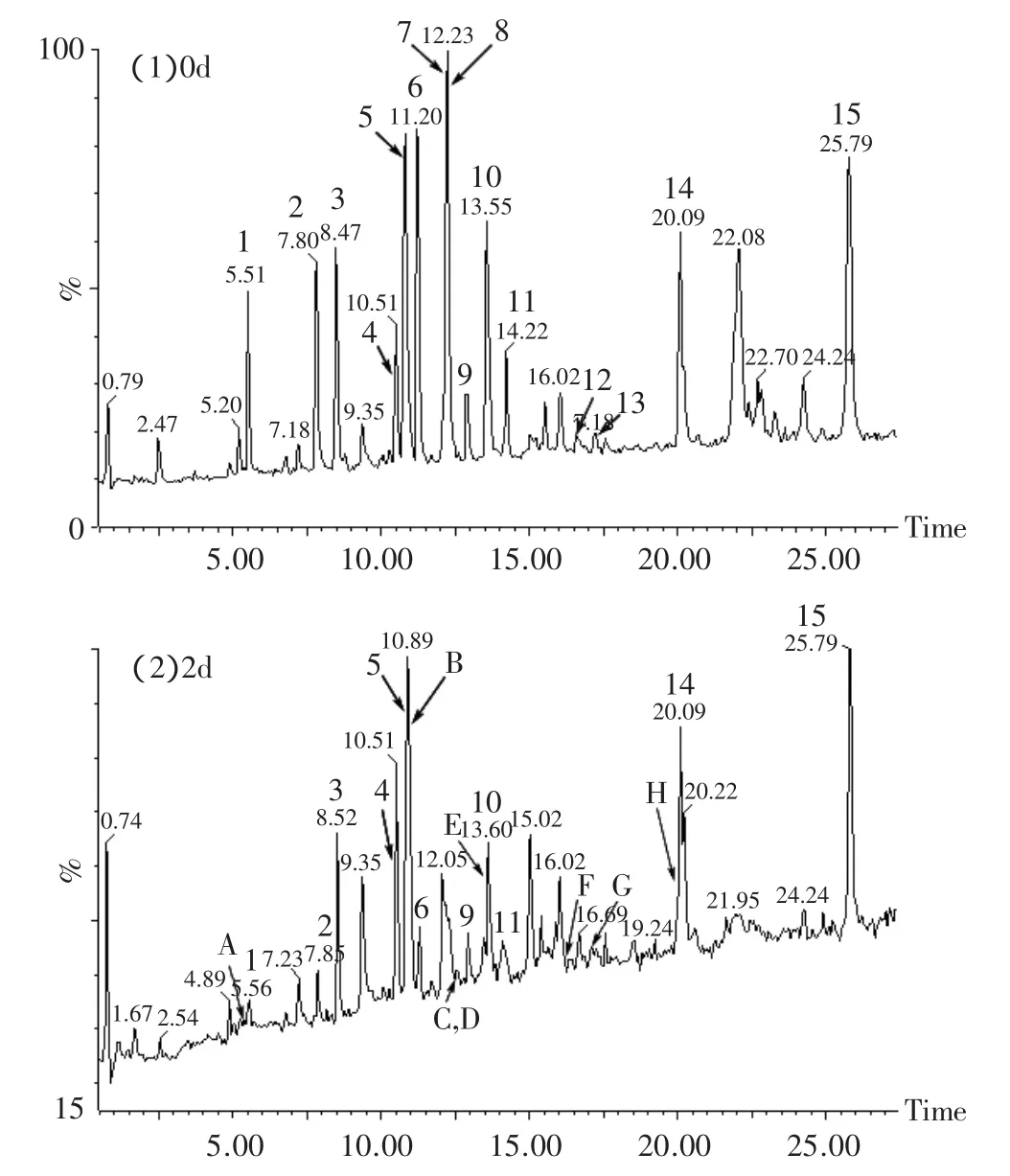
图1 肽段的总离子流色谱图
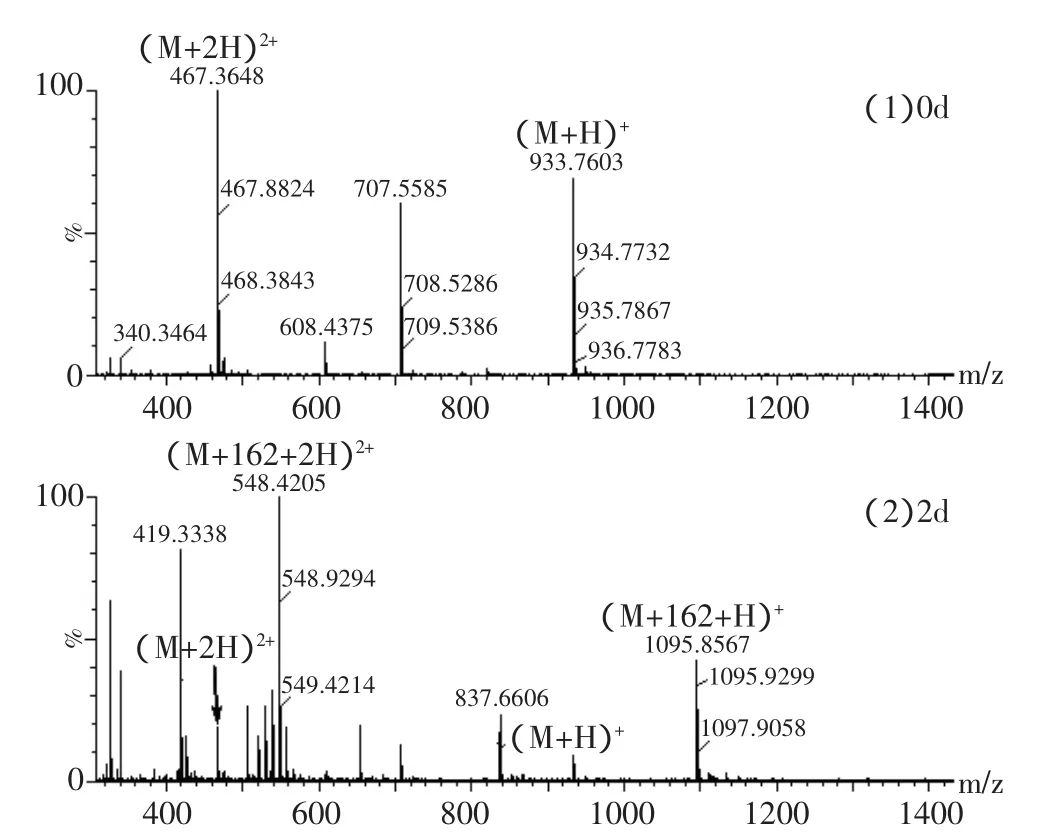
图2 肽段1~8的质谱图
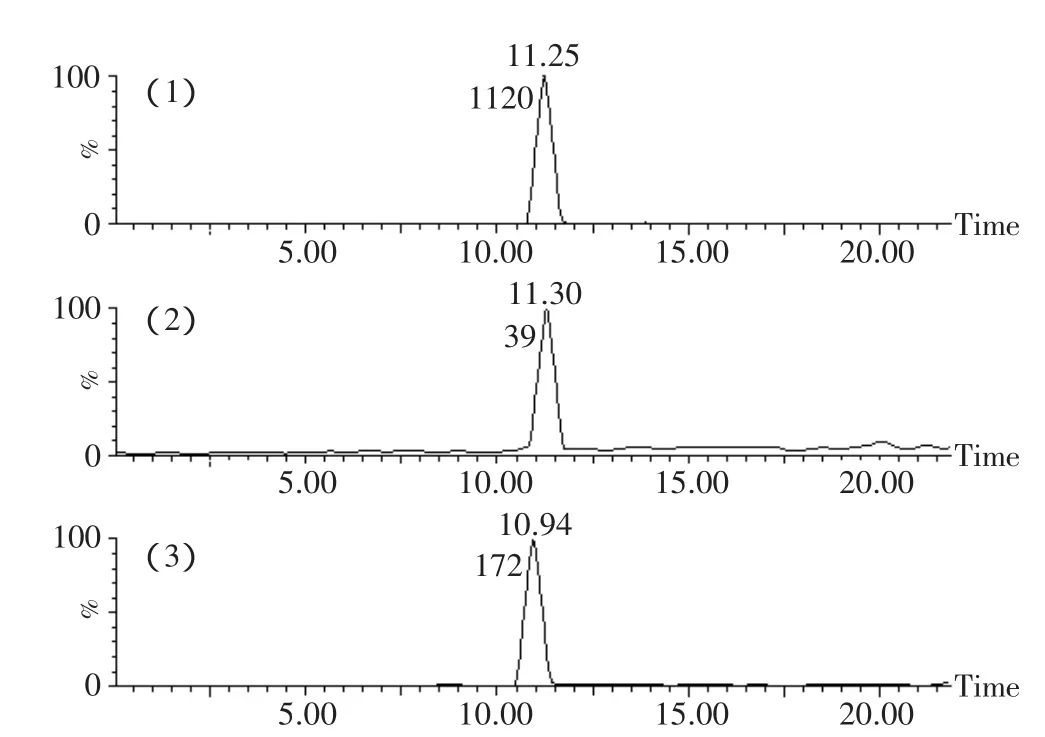
图3 求峰面积后的Tic图
检测到的糖基化的氨基酸有L1、K47、K70、K77、K83、K91、K100和K135(见表2)。Chevalier等[14]研究了乳球蛋白和葡萄糖的溶液模型体系在60℃下的糖基化反应,发现乳球蛋白的糖基化位点有L1、K14、K47、K69、K75、K100和K135。Marvin等[15]发现婴儿配方奶粉中乳球蛋白的乳糖化位点有L1、K69、K70、K75、K77、K83和K100。Morgan等[16]研究了乳球蛋白和乳糖在干状态(水分活度为0.65,50℃)下的糖基化反应,鉴定出乳球蛋白上最易被糖基化的位点是K47和K91,随后是L1、K14、K70和K100,接着是K60、K69、K75、K77、K83、K135和K138,最后是K14和K141。
另外,不同体系中同种蛋白的糖基化位点不完全相同,Morgan等[11,16]鉴定到的K8、K14、K60和K138等在本实验体系中并没有发现。Leonil等[18]鉴定出乳球蛋白上最先被乳糖化的位点是K47,而Fogliano等[9]却发现K100的活性最高。这些不同的实验结果可能是温度、水分活度等因素不同所导致的。
目前,对造成蛋白中的氨基酸残基糖基化活性不同的解释主要有两种。第一个因素是氨基酸残基的暴露程度。Chevalier等[17]发现K14和Arg40深藏于乳球蛋白四级结构的中间,K14位于N-末端区域疏水部分的末端,Arg40位于分子的β-折叠B的始端,不易被糖基化。另外,K70比K69先发生糖基化反应。因为在三维结构中,K69、K70位于β-折叠D上,但K70的侧链伸在外面,K69插入到疏水区,所以前者比后者先被糖基化。另一个因素是临近带电氨基酸的作用。Fogliano等[9]从蛋白数据库中得到乳球蛋白的三维结构模型,发现活性较高的K47的暴露程度却低于活性很低的K141的暴露程度,但K47非常接近带电氨基酸K70。而临近的带电氨基酸对Amadori重排有促进作用,所以K47的活性较高[5,9]。
有的被修饰的肽段未被检测到,导致部分位点没有被鉴定出,其原因有:与其他一起洗脱的肽段相比,这些肽段离子的量太少,不足以被检测到[5,14];一些糖基化了的肽段的质量数与未糖基化的肽段相同[5];含糖基化氨基酸的肽段的两端的氨基酸也被修饰了,抑制了胰蛋白酶的水解,因此不能水解得到这种肽段[14];这些肽段被糖基化后,其离子化特性发生了变化。Meltretter等[8]用AspN酶解蛋白样品后只检测到了一个或两个Amadori产物,而水解之前在完整的乳球蛋白和乳白蛋白中却发现四个Amadori产物,这说明糖基化改变了离子化特性。
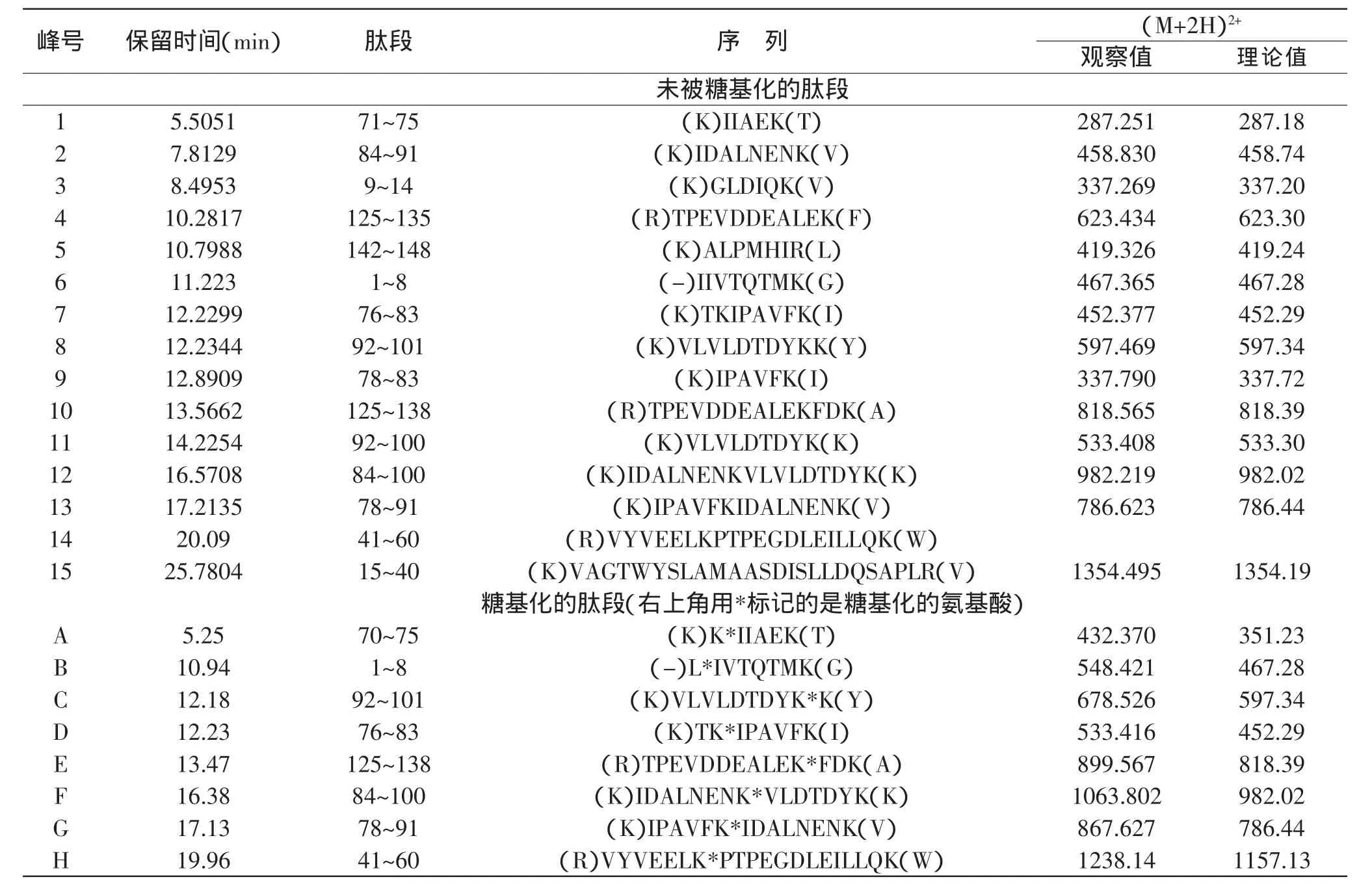
表2 胰蛋白酶水解后用LC-ESI-TOF/MS鉴定到的肽段
3 结论
在本实验中,用LC-MS鉴定出中间水分模型体系中乳球蛋白在45℃下与葡萄糖储藏2d后的糖基化位点有L1、K47、K70、K77、K83、K91、K100和K135。根据文献的报道可知,主要是这些氨基酸残基的暴露程度比较高或者这些氨基酸残基附近有带电氨基酸所造成的。
[1]Pomeranz Y.Advances in cereal science and technology[M].AACC Press,1988:91-128.
[2]Yeboah F K,Yaylayan V A.Analysis of glycated proteins by mass spectrometric techniques:Qualitative and quantitative aspects[J].Nahrung/Food,2001,45:164-171.
[3]Fenaille F,Parisod V,Visani P,et al.Modifications of milk constituents during processing:A preliminary benchmarking study[J].International Dairy Journal,2006,16:728-739.
[4]Rockland L.Water in foods[M].Academic Press:New York,1981:605-650.
[5]Ledesma-Osuna A I,Ramos-Clamont G,Vázquez-Moreno L.Characterization of bovine serum albumin glycated with glucose,galactose and lactose [J].Acta Biochimica Polonica,2008,55:491-497.
[6]Fenaille F,Campos-Gimenez E,Guy P A,et al.Monitoring of β-lactoglobulin dry-state glycation using various analytical techniques[J].Analytical Biochemistry,2003,320:144-148.
[7]Siciliano R,Rega B,Amoresano A,et al.Modern mass spectrometric methodologies in monitoring milk quality[J].Analytical Chemistry,2000,72:408-415.
[8]Meltretter J,Seeber S,Humeny A,et al.Site-specific formation of maillard,oxidation and condensation products from whey proteins during reaction with lactose[J].Journal of Agriculture and Food Chemistry,2007,55:6096-6103.
[9]Fogliano V,Monti S M,Visconti A,et al.Identification of a β-lactoglobulin lactosylation site [J].Biochimica et Biophysica Acta,1998,1388:295-304.
[10]Morgan F,LéonilJ,Mollé D,etal.Nonenzymatic lactosylation of bovine β-lactoglobulin under mild heat treatment leads to structural heterogeneity of the glycoforms[J].Biochemical and Biophysical Research Communications,1997,236:413-417.
[11]Fenaille F,Morgan F,Parisod V,et al.Solid-state glycation of β-lactoglobulin by lactose and galactose:localization of the modified amino acids using mass spectrometric techniques[J].Journal of Mass Spectrometry,2004,39:16-28.
[12]Mollé D,Morgan F,Bouhallab S,et al.Selective detection of lactolated peptides in hydrolysates by liquid chromatography/electrospray tandem mass spectrometry[J].Analytical Biochemistry,1998,259:152-161.
[13]Fenaille F,Morgan F,Parisod V,et al.Solid-state glycation of β-lactoglobulin monitored by electrospray ionisation mass spectrometry and gel electrophoresis techniques [J].Rapid Communnications in Mass Spectrometry,2003,17:1483-1492.[14]Chevalier F,Chobert J M,Mollé D,et al.Maillard glycation of β-lactoglobulin with several sugars:comparative study of the properties of the obtained polymers and of the substituted sites[J].Lait,2001,81:651-666.
[15]Marvin L,Parisod V,Fay L B,et al.Characterization of lactosylated proteins of infant formula powders using twodimensionalgelelectrophoresisand nanoelectrospray mass spectrometry[J].Electrophoresis,2002,23:2505-2512.
[16]Morgan F,Bouhallab S,Mollé D,et al.Lactolation of β -lactoglobulin monitored by electrospray ionization mass spectrometry[J].International Dairy Journal,1998,8:95-98.
[17]ChevalierF,ChobertJM,DalgalarrondoM,etal.Characterizationofthemaillardreactionproductsof β-lactoglobulin glucosylated in milk conditions [J].Journal Food Biochemistry,2001,25:33-55.
[18]Leonil J,Molle D,Fauquant J,et al.Characterization by ionization mass spectrometry of lactosyl β-lactoglobulin conjugates formed during heat treatment of milk and whey and identification of one lactose-binding site[J].Journal of Dairy Science,1997,80:2270-2281.
Identification of the glycation sites of beta-lactoglobulin in an intermediate moisture food system
YU Yuan-fang,TAO Guan-jun,LIU Xiao-ming,ZHOU Peng*
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Beta-lactoglobulin is liable to react with reducing sugars like glucose in intermediate moisture food system,causing changes to color,flavor and texture.In order to further understand the glycated modification,the glycation sites of beta-lactoglobulin were identified by using ESI-TOF/MS to analyze the peptides from tryptic digest of beta-lactoglobulin incubated with glucose at 45℃for two days.It was showed that the modified amino acid residues were L1,K47,K70,K77,K83,K91,K100 and K135.
beta-lactoglobulin;glucose;glycation reaction;glycation site
TS201.2+1
A
1002-0306(2011)10-0079-04
2010-09-10 *通讯联系人
余园芳(1986-),女,硕士在读,研究方向:食品结构与物性。
中央高校基本科研业务费专项资金(JUSRP21004)。

